 Problème 1 : Titrage dune solution dacide oxalique
Problème 1 : Titrage dune solution dacide oxalique
28 avr. 2016 La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de. 150 ans. Cette transformation présente des ...
 FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
1 janv. 2015 Afin de comprendre les différences observées on modélise la réaction d'oxydation de l'acide oxalique par les ions permanganate (notés M) à l' ...
 CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Les deux parties de cet exercice sont indépendantes. Partie A : la réaction chimique. Les ions permanganate de formule MnO4. - réagissent avec l'acide oxalique
 exercice chimie_f.brossard 10-03
exercice chimie_f.brossard 10-03
réaction entre l'acide oxalique. H2C2O4 et les ions permanganate MnO4. − . Dans le système étudié seul l'ion permanganate est coloré en solution. I. Réglage ...
 Réaction (55 pts) Les ions permanganate de formule MnO 4
Réaction (55 pts) Les ions permanganate de formule MnO 4
On mélange initialement un volume VA = 500 mL d'acide oxalique à la concentration CA = 2
 BACCALAURÉAT GÉNÉRAL Épreuve pratique de lenseignement
BACCALAURÉAT GÉNÉRAL Épreuve pratique de lenseignement
On se propose ici d'étudier la réaction des ions permanganate avec l'acide oxalique pour mesurant la différence entre la concentration initiale de ...
 Étude spectroscopique de la cinétique de la réaction MnO4
Étude spectroscopique de la cinétique de la réaction MnO4
Figure 10 : Évolution du spectre au cours de la réaction entre MnO2 et l'acide oxalique. La réaction permanganate/acide oxalique présente des propriétés.
 Exercice non spécialité : cinétique chimique
Exercice non spécialité : cinétique chimique
acide oxalique ? 2.3.c. Réécrire l'équation de la réaction entre les ions permanganate et l'acide oxalique puis dresser un tableau d'avancement. Calculer l ...
 ÉTUDE CINÉTIQUE DE QUELQUES TRANSFORMATIONS
ÉTUDE CINÉTIQUE DE QUELQUES TRANSFORMATIONS
- avec de l'acide oxalique H2C2O4 . Équation de la réaction : 2MnO4. − + 5H2C2O4 On étudie est la réaction entre les ions permanganate MnO4. - et l'acide ...
 TP de chimie n°3 Facteurs influant sur la vitesse dune réaction
TP de chimie n°3 Facteurs influant sur la vitesse dune réaction
On va réaliser la réaction entre les ions permanganate et l'acide oxalique à 3 températures différentes : dans un bain de glace à température ambiante puis
 Problème 1 : Titrage dune solution dacide oxalique
Problème 1 : Titrage dune solution dacide oxalique
28 avr. 2016 Le permanganate de potassium libère en solution des ions potassium K+ et des ions permanganate MnO4. -?. La réaction entre l'acide oxalique ...
 FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
Afin de comprendre les différences observées on modélise la réaction d'oxydation de l'acide oxalique par les ions permanganate (notés M) à l'aide des équations
 Etude cinétique dune réaction doxydoréduction suivie par
Etude cinétique dune réaction doxydoréduction suivie par
En ce lundi de rentrée l'étude de la réaction que nous nous proposons d'étudier
 CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Les deux parties de cet exercice sont indépendantes. Partie A : la réaction chimique. Les ions permanganate de formule MnO4. - réagissent avec l'acide oxalique
 Réaction (55 pts) Les ions permanganate de formule MnO 4
Réaction (55 pts) Les ions permanganate de formule MnO 4
On mélange initialement un volume VA = 500 mL d'acide oxalique à la concentration CA = 2
 1h I- Réaction entre lacide oxalique et les ions permanganate (10 +
1h I- Réaction entre lacide oxalique et les ions permanganate (10 +
16 févr. 2012 I- Réaction entre l'acide oxalique et les ions permanganate (10 + 1 points) ... permanganate de potassium en milieu acide. la seule espèce ...
 Étude spectroscopique de la cinétique de la réaction MnO4
Étude spectroscopique de la cinétique de la réaction MnO4
l'effet de la concentration initiale en acide oxalique (acide éthane- Il n'y a donc pas de réaction rapide impliquant les ions MnO4.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
27 févr. 2017 3.1- Ecrire l'équation de la réaction entre A et B. Nommer le produit ... 2- Oxydation de l'acide oxalique par les ions permanganate.
 Problème 1 : Titrage dune solution dacide oxalique Centrale PC
Problème 1 : Titrage dune solution dacide oxalique Centrale PC
28 avr. 2016 La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de. 150 ans. Cette transformation présente des ...
 Etude cinétique dune réaction doxydoréduction suivie par
Etude cinétique dune réaction doxydoréduction suivie par
L'étude de la réaction que nous nous proposons d'étudier entre les ions permanganate. MnO4. -? et l'acide oxalique H2C2O4
 [PDF] Réaction entre lacide oxalique et les ions permanganate (10 + 1 poin
[PDF] Réaction entre lacide oxalique et les ions permanganate (10 + 1 poin
16 fév 2012 · I- Réaction entre l'acide oxalique et les ions permanganate (10 + 1 points) Une solution incolore d'acide oxalique de formule H2C204(aq)
 [PDF] Réaction (55 pts) Les ions permanganate de formule MnO
[PDF] Réaction (55 pts) Les ions permanganate de formule MnO
Réaction (55 pts) Les ions permanganate de formule MnO - 4 réagissent avec l'acide oxalique de formule H2C2 O4 suivant l'équation suivante :
 [PDF] Problème 1 : Titrage dune solution dacide oxalique - Chimie en PCSI
[PDF] Problème 1 : Titrage dune solution dacide oxalique - Chimie en PCSI
28 avr 2016 · La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de 150 ans Cette transformation présente des
 [PDF] CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
[PDF] CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Partie A : la réaction chimique Les ions permanganate de formule MnO4 - réagissent avec l'acide oxalique de formule H2C2O4 suivant l'équation suivante :
 [PDF] Etude dune cinétique par spectrophotomètrie (9 points)
[PDF] Etude dune cinétique par spectrophotomètrie (9 points)
cinétique par spectrophotométrie d'une transformation lente mettant en jeu une réaction entre l'acide oxalique H2C2O4 et les ions permanganate MnO4
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
Les ions permanganate MnO4 - violet et les ions fer II Fe2+ réagissent ensemble pour donner des ions manganèse Mn2+ incolores et des ions fer III Fe3+
 [PDF] Étude spectroscopique de la cinétique de la réaction MnO4
[PDF] Étude spectroscopique de la cinétique de la réaction MnO4
participation de l'étape F de réduction directe du permanganate par l'acide oxalique moléculaire 9 ORIGINE DE L'AUTOCATALYSE L'effet autocatalytique de Mn(II)
 [PDF] Réaction lente et réaction rapide Exercices corrigés - AlloSchool
[PDF] Réaction lente et réaction rapide Exercices corrigés - AlloSchool
couple écrire l'équation de la réaction d'oxydoréduction Exercice 2 : La réaction de l'acide bilan entre les ions permanganate et l'acide oxalique
 [PDF] filière bcpst composition de chimie - Paris - ENS
[PDF] filière bcpst composition de chimie - Paris - ENS
1 jan 2015 · 1 Réaction entre l'acide oxalique et les ions permanganate 1 1 Étude cinétique La réaction entre les ions permanganate et l'acide oxalique
 [PDF] Thème : Cinétique chimique Fiche 6 - Studyrama
[PDF] Thème : Cinétique chimique Fiche 6 - Studyrama
de la réaction les proportions stoechiométriques sont obtenues si la quantité d'acide oxalique est 2 5 fois la quantité d'ions permanganate
Pourquoi l'ion permanganate est le reactif limitant ?
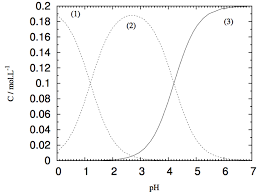
La seule esp? colorée, l'ion permanganate disparaît du milieu réactionnel à l'état final : MnO4- aq constitue le réactif limitant.Pourquoi les ions permanganate sont colorés en solution aqueuse ?
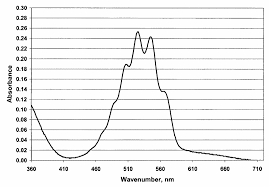
Les ions permanganate sont colorées car comme le montre le spectre d'absorption obtenu d'une solution aqueuse de permanganate de potassium, il existe une large bande de longueurs d'ondes autour de 475-575 nm que les ions permanganate absorbent.Est-ce que H2C2O4 est un acide fort ?
première acidité étant assez forte, la proportion de H2C2O4 au départ est à peine supérieure à 50%.- Il s'agit d'un acide organique que l'on trouve dans l'oseille ou dans la rhubarbe et qui ne laisse pas de résidus. 40 grammes d'A O par litre de sirop semble être le dosage adapté à notre région. Avant toute manipulation un léger enfumage est nécessaire avant d'ouvrir les ruches.

ÉCOLES NORMALES SUPÉRIEURES
ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES
CONCOURS D"ADMISSION SESSION 2015
FILIÈRE BCPST
COMPOSITION DE CHIMIE
Épreuve commune aux ENS de Cachan, Lyon, Paris et de l"ENPCDurée : 4 heures
L'utilisation des calculatrices n'est pas autorisée pour cette épreuve. Données utiles pour la résolution de la première partiePotentiels standard àT=298 K(àpH = 0
)CoupleCO 2 (g)/H 2 C 2 O 4 (aq)MnO 4- (aq)/Mn 2+ (aq)S 2 O 32-(aq)/S 4 O 62-
(aq) I2 (aq)/I (aq) E /V-0,491,510,090,65
On donne à 298 K :RTln10
F=0,06 V; ln10 = 0,693; logx=lnxln10.
Constantes d'équilibre àT=298 K
[Mn(C 2 O 4 2 (aq)--[Mn(C 2 O 4 (aq) + C 2 O 42-(aq)K ◦1 =2,5.10-7 [Mn(C 2 O 4 3 3- (aq)--[Mn(C 2 O 4 2 (aq) + C 2 O 42-
(aq)K ◦2 =1,4.10 -3
Données numériques
log2 = 0,3;e2 ?7,5;e 2,5 ?12 ;e 3 ?20.1 Réaction entre l'acide oxalique et les ions permanganate
1.1 Étude cinétique
La réaction entre les ions permanganate et l"acide oxalique (H 2 C 2 O 4 ) fait l"objet d"études de-puis plus de 150 ans. Cette transformation présente des caractéristiques cinétiques étonnantes.
L"équation ajustée de la réaction entre les ions permanganate et l"acide oxalique est la suivante :
2MnO4-
(aq) + 5H 2 C 2 O 4 (aq) + 6H (aq) =2Mn 2+ (aq) + 10CO2 (g) + 8H 2O(?)(1)
1.1.1Calculer la constante d"équilibre de la réaction (1) à 298 K et pH = 0. Conclure.
On suit l"évolution de cette transformation par spectroscopie UV-visible. On précise que l"acide
oxalique n"absorbe pas dans la région 400 - 600 nm. Le spectre d"absorption de l"ion perman- ganate en solution aqueuse est présentéfigure 1. 1 Figure1 - Spectre UV-visible de l"ion permanganate en solution aqueuseLa concentration en ions permanganate dans la solution est déterminée, à chaque instant, à
partir de la relation (2). [MnO 4- ]=A(528)- R (528) R (420)A(420)
p (528)?(2) dans laquelle :A(λ
i ) est l"absorbance de la solution à la longueur d"ondeλ i p i ) est le coefficient d"absorption molaire de l"ion permanganate à la longueur d"ondeλ i R i ) est le coefficient d"absorption molaire d"une autre espèceRprésente en solution, à la longueur d"ondeλ i?est la longueur de la cuve.
1.1.2Rappeler la relation deBeer-Lambert. Donner l"unité et la signification des différents
termes de cette relation. Donner les conditions de validité de cette relation.1.1.3Discuter le choix des longueurs d"onde utilisées dans l"équation (2) et l"emploi d"une
telle relation pour la détermination de la concentration en ions permanganate dans la solution. On commentera notamment le choix de ne pas simplement utiliser la valeur de l"absorbance à528 nm.
1.1.4Démontrer la relation (2).
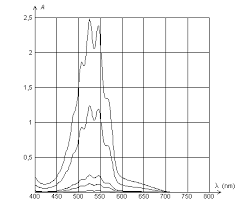
Yamashitaet ses collaborateurs ont suivi, par spectrophotométrie, l"évolution de la concen- tration en ions permanganate en solution au cours du temps. Les points expérimentaux obtenus sont présentésfigure 2. 2 0 1 2 3 4 5 60 2 4 6 8 10 12 14 16 18
10 4 [MnO 4- ] / mol.L -1 t / min + : concentration en ions permanganate en fonction du temps. : vitesse de disparition des ions permanganate en fonction du temps Figure2 - Suivi de l"évolution temporelle de la réaction (1) par spectroscopie UV-visible Cette transformation est réalisée dans les conditions suivantes : la température est maintenue constante (θ=20 C); les concentrations des espèces à l"instant initial sont : ?[MnO 4- 0 =5,00.10 -4 mol·L -1 ?[H 2 C 2 O 4 0 =0,225 mol·L -1 ?[HCl] 0 =96,0.10 -3 mol·L -1 On suppose dans un premier temps que la réaction (1) admet un ordre.1.1.5Donner, dans les conditions de l"expérience, l"expression de la vitesse de la réaction (on
considère que la réaction admet un ordre par rapport à chacun des réactifs).1.1.6En déduire l"expression de la vitesse, notéev, de disparition des ions permanganate.
1.1.7Déterminer la loi de variation de [MnO
4- ]enfonctiondutempssachantqueletempsde demi-réaction est indépendant de la concentration initiale en ions permanganate.1.1.8Donner l"allure de l"évolution de la concentration en ions permanganate et de l"évolution
de la vitesse de disparition des ions permanganate en fonction du temps (un graphe sommaire suffit dans les deux cas, le calcul de l"ensemble des points n"est pas demandé).1.1.9Comparer les courbes obtenues à la question1.1.8.aux courbes expérimentales de la
figure 2et indiquer les principales différences.Afin de comprendre les différences observées, on modélise la réaction d"oxydation de l"acide
oxalique par les ions permanganate (notésM) à l"aide des équations cinétiques (3) et (4). Les
paramètres de la modélisation sont les suivants :à l"instant initial : [M]
0 =c 0 et [N] 0 =0;àuninstantt,onnote[M]=c;
les actes sont supposés élémentaires. 3 M k 1 -→N(3) M+N k 2 -→produits(4)1.1.10Proposer un protocole expérimental permettant de mettre en évidence l"existence de la
seconde équation (4). Comment s"appelle ce phénomène?1.1.11Écrire l"équation différentielle donnant la vitessevde disparition totale des ions perman-
ganate en fonction dec,c 0 et des constantes de vitessek 1 etk 21.1.12Résoudre cette équation différentielle par une décomposition en éléments simples pour
obtenir l"expression de la concentrationcen fonction du temps au moyen des paramètres de description du système (c 0 ,k 1 ,k 21.1.13Analyser la fonctionc=f(t) obtenue et discuter l"accord entre cette courbe et les
résultats expérimentaux obtenus parYamashitafigure 2. Conclure quant à la validité du modèle.En traçant ln
v c 2 =f(t) on peut déterminer graphiquement les constantes de vitessek 1 et k 2 Le graphe correspondant est présentéfigure 3. L"expérience est réalisée à 20C dans les condi-
tions suivantes :[MnO
4- 0 =5,00.10 -4 mol·L -1[H
2 C 2 O 4 0 =0,225 mol·L -1[HCl]
quotesdbs_dbs33.pdfusesText_39[PDF] de la fécondation ? la naissance 4ème exercices
[PDF] svt 4ème les étapes de l accouchement
[PDF] de la fécondation ? la naissance svt 4ème pdf
[PDF] différence de carré
[PDF] style corps de texte word
[PDF] oursin fécondation interne ou externe
[PDF] mise en forme du texte definition
[PDF] reproduction oursin wikipedia
[PDF] un document composite est
[PDF] mise en forme d'un texte word
[PDF] exercice tableau croisé dynamique excel 2010 pdf
[PDF] tableau croisé dynamique excel 2013 tutorial
[PDF] document composite
[PDF] capacitation des spermatozoide durée
