 Problème 1 : Titrage dune solution dacide oxalique
Problème 1 : Titrage dune solution dacide oxalique
28 avr. 2016 La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de. 150 ans. Cette transformation présente des ...
 FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
1 janv. 2015 Afin de comprendre les différences observées on modélise la réaction d'oxydation de l'acide oxalique par les ions permanganate (notés M) à l' ...
 CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Les deux parties de cet exercice sont indépendantes. Partie A : la réaction chimique. Les ions permanganate de formule MnO4. - réagissent avec l'acide oxalique
 exercice chimie_f.brossard 10-03
exercice chimie_f.brossard 10-03
réaction entre l'acide oxalique. H2C2O4 et les ions permanganate MnO4. − . Dans le système étudié seul l'ion permanganate est coloré en solution. I. Réglage ...
 Réaction (55 pts) Les ions permanganate de formule MnO 4
Réaction (55 pts) Les ions permanganate de formule MnO 4
On mélange initialement un volume VA = 500 mL d'acide oxalique à la concentration CA = 2
 BACCALAURÉAT GÉNÉRAL Épreuve pratique de lenseignement
BACCALAURÉAT GÉNÉRAL Épreuve pratique de lenseignement
On se propose ici d'étudier la réaction des ions permanganate avec l'acide oxalique pour mesurant la différence entre la concentration initiale de ...
 Étude spectroscopique de la cinétique de la réaction MnO4
Étude spectroscopique de la cinétique de la réaction MnO4
Figure 10 : Évolution du spectre au cours de la réaction entre MnO2 et l'acide oxalique. La réaction permanganate/acide oxalique présente des propriétés.
 Exercice non spécialité : cinétique chimique
Exercice non spécialité : cinétique chimique
acide oxalique ? 2.3.c. Réécrire l'équation de la réaction entre les ions permanganate et l'acide oxalique puis dresser un tableau d'avancement. Calculer l ...
 ÉTUDE CINÉTIQUE DE QUELQUES TRANSFORMATIONS
ÉTUDE CINÉTIQUE DE QUELQUES TRANSFORMATIONS
- avec de l'acide oxalique H2C2O4 . Équation de la réaction : 2MnO4. − + 5H2C2O4 On étudie est la réaction entre les ions permanganate MnO4. - et l'acide ...
 TP de chimie n°3 Facteurs influant sur la vitesse dune réaction
TP de chimie n°3 Facteurs influant sur la vitesse dune réaction
On va réaliser la réaction entre les ions permanganate et l'acide oxalique à 3 températures différentes : dans un bain de glace à température ambiante puis
 Problème 1 : Titrage dune solution dacide oxalique
Problème 1 : Titrage dune solution dacide oxalique
28 avr. 2016 Le permanganate de potassium libère en solution des ions potassium K+ et des ions permanganate MnO4. -?. La réaction entre l'acide oxalique ...
 FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
FILIÈRE BCPST COMPOSITION DE CHIMIE 1 Réaction entre lacide
Afin de comprendre les différences observées on modélise la réaction d'oxydation de l'acide oxalique par les ions permanganate (notés M) à l'aide des équations
 Etude cinétique dune réaction doxydoréduction suivie par
Etude cinétique dune réaction doxydoréduction suivie par
En ce lundi de rentrée l'étude de la réaction que nous nous proposons d'étudier
 CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Les deux parties de cet exercice sont indépendantes. Partie A : la réaction chimique. Les ions permanganate de formule MnO4. - réagissent avec l'acide oxalique
 Réaction (55 pts) Les ions permanganate de formule MnO 4
Réaction (55 pts) Les ions permanganate de formule MnO 4
On mélange initialement un volume VA = 500 mL d'acide oxalique à la concentration CA = 2
 1h I- Réaction entre lacide oxalique et les ions permanganate (10 +
1h I- Réaction entre lacide oxalique et les ions permanganate (10 +
16 févr. 2012 I- Réaction entre l'acide oxalique et les ions permanganate (10 + 1 points) ... permanganate de potassium en milieu acide. la seule espèce ...
 Étude spectroscopique de la cinétique de la réaction MnO4
Étude spectroscopique de la cinétique de la réaction MnO4
l'effet de la concentration initiale en acide oxalique (acide éthane- Il n'y a donc pas de réaction rapide impliquant les ions MnO4.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
27 févr. 2017 3.1- Ecrire l'équation de la réaction entre A et B. Nommer le produit ... 2- Oxydation de l'acide oxalique par les ions permanganate.
 Problème 1 : Titrage dune solution dacide oxalique Centrale PC
Problème 1 : Titrage dune solution dacide oxalique Centrale PC
28 avr. 2016 La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de. 150 ans. Cette transformation présente des ...
 Etude cinétique dune réaction doxydoréduction suivie par
Etude cinétique dune réaction doxydoréduction suivie par
L'étude de la réaction que nous nous proposons d'étudier entre les ions permanganate. MnO4. -? et l'acide oxalique H2C2O4
 [PDF] Réaction entre lacide oxalique et les ions permanganate (10 + 1 poin
[PDF] Réaction entre lacide oxalique et les ions permanganate (10 + 1 poin
16 fév 2012 · I- Réaction entre l'acide oxalique et les ions permanganate (10 + 1 points) Une solution incolore d'acide oxalique de formule H2C204(aq)
 [PDF] Réaction (55 pts) Les ions permanganate de formule MnO
[PDF] Réaction (55 pts) Les ions permanganate de formule MnO
Réaction (55 pts) Les ions permanganate de formule MnO - 4 réagissent avec l'acide oxalique de formule H2C2 O4 suivant l'équation suivante :
 [PDF] Problème 1 : Titrage dune solution dacide oxalique - Chimie en PCSI
[PDF] Problème 1 : Titrage dune solution dacide oxalique - Chimie en PCSI
28 avr 2016 · La réaction entre l'acide oxalique et les ions permanganate fait l'objet d'études depuis plus de 150 ans Cette transformation présente des
 [PDF] CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
[PDF] CORRECTION de lÉVALUATION DE SCIENCES PHYSIQUES ET
Partie A : la réaction chimique Les ions permanganate de formule MnO4 - réagissent avec l'acide oxalique de formule H2C2O4 suivant l'équation suivante :
 [PDF] Etude dune cinétique par spectrophotomètrie (9 points)
[PDF] Etude dune cinétique par spectrophotomètrie (9 points)
cinétique par spectrophotométrie d'une transformation lente mettant en jeu une réaction entre l'acide oxalique H2C2O4 et les ions permanganate MnO4
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
Les ions permanganate MnO4 - violet et les ions fer II Fe2+ réagissent ensemble pour donner des ions manganèse Mn2+ incolores et des ions fer III Fe3+
 [PDF] Étude spectroscopique de la cinétique de la réaction MnO4
[PDF] Étude spectroscopique de la cinétique de la réaction MnO4
participation de l'étape F de réduction directe du permanganate par l'acide oxalique moléculaire 9 ORIGINE DE L'AUTOCATALYSE L'effet autocatalytique de Mn(II)
 [PDF] Réaction lente et réaction rapide Exercices corrigés - AlloSchool
[PDF] Réaction lente et réaction rapide Exercices corrigés - AlloSchool
couple écrire l'équation de la réaction d'oxydoréduction Exercice 2 : La réaction de l'acide bilan entre les ions permanganate et l'acide oxalique
 [PDF] filière bcpst composition de chimie - Paris - ENS
[PDF] filière bcpst composition de chimie - Paris - ENS
1 jan 2015 · 1 Réaction entre l'acide oxalique et les ions permanganate 1 1 Étude cinétique La réaction entre les ions permanganate et l'acide oxalique
 [PDF] Thème : Cinétique chimique Fiche 6 - Studyrama
[PDF] Thème : Cinétique chimique Fiche 6 - Studyrama
de la réaction les proportions stoechiométriques sont obtenues si la quantité d'acide oxalique est 2 5 fois la quantité d'ions permanganate
Pourquoi l'ion permanganate est le reactif limitant ?
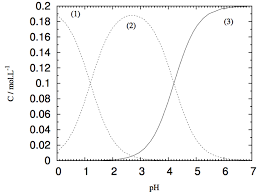
La seule esp? colorée, l'ion permanganate disparaît du milieu réactionnel à l'état final : MnO4- aq constitue le réactif limitant.Pourquoi les ions permanganate sont colorés en solution aqueuse ?
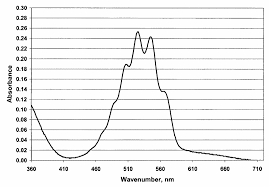
Les ions permanganate sont colorées car comme le montre le spectre d'absorption obtenu d'une solution aqueuse de permanganate de potassium, il existe une large bande de longueurs d'ondes autour de 475-575 nm que les ions permanganate absorbent.Est-ce que H2C2O4 est un acide fort ?
première acidité étant assez forte, la proportion de H2C2O4 au départ est à peine supérieure à 50%.- Il s'agit d'un acide organique que l'on trouve dans l'oseille ou dans la rhubarbe et qui ne laisse pas de résidus. 40 grammes d'A O par litre de sirop semble être le dosage adapté à notre région. Avant toute manipulation un léger enfumage est nécessaire avant d'ouvrir les ruches.
N° 768
Étude spectroscopique de la cinétique
de la réaction MnO 4- H 2 C 2 O 4 en milieu sulfurique Mise en évidence de deux intermédiaires réactionnels par V. PIMIENTA, D. LAVABRE, G. LEVY et J.-C. MICHEAULaboratoire des IMRCP, URA au CNRS 470,
Université Paul Sabatier - 31062 Toulouse
1.INTRODUCTION
La première étude approfondie [1] de la réaction MnO 4- H 2 C 2 O 4 a été effectuée en 1865. Depuis, cette réaction est restée un exemple d"école, car ses propriétés cinétiques sont particulièırement intéressantes et sa mise en oeuvre expérimentale est simple. Cette réaction permet, en effet, d"illustrer facilement quelques notions d"intérêt pédagogique : vitesse de réaction, autocatalyse, effet de la température, présence d"intermédiaires réactionnelsı [2]. Toutefois, son mécanisme est complexe ; la seule écriture de l"équation-bilan de la manganimétrie : 2 MnO 4- + 6 H 3 O + 5 H 2 C 2 O 4 = 2 Mn 2+ + 14 H 2O + 10 CO
2 (1) ne fournit aucune indication utile relative à cette complexité, mais seulement la stoechiométrie de la réaction ( [MnO 4- [H 2 C 2 O 4 ] = 12.5) et
la composition de l"état final. La dynamique de cette réaction se traduit par plusieurs caractéris- tiques notables : - contrairement à une cinétique classique pour laquelle la vitesse est maximale en début de réaction, la vitesse de disparition du permanga- nate est maximale alors qu"il a été presque entièrement consıommé, - Mn(II) est l"autocatalyseur comme le montre l"addition en débıut de réaction d"un peu d"une solution ayant déjà réagi ou simplement de Mn 2+BULLETIN DE L"UNION DES PHYSICIENS 1625
Vol. 88 - Novembre 1994
- la réaction est accélérée par l"acide sulfurique, - l"effet de la concentration initiale en acide oxalique (acide éthane- dioïque) est plus inhabituel : pour des concentrations proches de celles du rapport stoechiométrique correspondant à l"équation de bilan (1), la vitesse de décoloration du permanganate est ralentie quand la concen- tration initiale en acide oxalique augmente : cela correspond à un effet d"inhibition. Par contre, pour des concentrations initiales élevées : la vitesse de la réaction augmente avec la concentration initiale d"acide oxalique. Dans ce cas, une teinte jaune paille subsiste plusieurs minutes après que le permanganate ait entièrement disparu. Le but de cet article est de présenter, à la lumière de résultats expérimentaux récents [3], une étude cinétique et spectrale de cette réaction, et d"établir un mécanisme réactionnel qualitatif permettant d"interpréter les principales propriétés cinétiques.2. REPRÉSENTATION TRIDIMENSIONNELLE DE L"ÉVOLUTIONDES SPECTRES
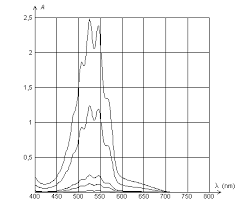
L"utilisation des spectrophotomètres à barrettes de diodes a permis le développement rapide des techniques UV-Visible en cinétique. En effet, ce type d"appareil peut enregistrer un spectre de plusieurs centaines de nanomètres en une fraction de seconde (0,1 s dans notre cas). On obtient ainsi directement l"enregistrement simultané de tous les points du spectre, sans la déformation due à un balayage lent. Les données peuvent être transférées vers une station de travail et traitées afin d"obtenir un spectre en trois dimensions (Abs, l, t). Le spectre tridimensionnel peut être représenté sous divers angles, ce qui permet de visualiser plus commodément tous les aspects de la réaction. Il présente deux zones distinctes [4] : - La première zone qui se situe entre 490 et 570 nm est relative aux ions MnO 4- . Ce massif [5] évolue sans déformation. Les absorbances aux diverses longueurs d"ondes sont proportionnelles entre elles tout au long de la réaction : on peut donc considérer qu"elles sont caractéristi- ques des ions MnO 4- uniquement. Le premier spectre (marqué en trait plein sur la figure 1) est identique à celui du permanganate en solution aqueuse. Il n"y a donc pas de réaction rapide impliquant les ions MnO 4- au moment du mélange. Le permanganate est le seul absorbant présent à cet instant. L"absorbance à 560 nm (e560MnO
4-1400 mol
1 L cm - 1 ) est1626 BULLETIN DE L"UNION DES PHYSICIENS
B.U.P. n° 768
Figure 1 : Spectres à trois dimensions de la réaction MnO 4- H 2 C 2 O 4 H 2 SO 4 [MnO 4- 0 5.10 4 mol L 1 , [H 2 C 2 O 4 01,25.10
- 3 mol L - 1 : rapport stoechiométri- que 1/(2,5) ; [H 2 SO 4 00,27 mol L
- 11 - Vue avec spectre initial au premier plan.
2 - Vue avec spectre final au premier plan. L"évolution des absorbances à 560 nm et
320 nm est soulignée en gras.
BULLETIN DE L"UNION DES PHYSICIENS 1627
Vol. 88 - Novembre 1994
choisie pour caractériser l"évolution de l"ion MnO 4 (dans ce domaine, l"acide oxalique n"est pas détectable). La disparition des ions MnO 4 montre une cinétique "auto-accélérée», la vitesse est faible en début de réaction, puis augmente et passe ensuite par un maximum alors que lepermanganate a presque entièrement disparu (figure 2).Figure 2 : a) Évolution de l"absorbance à 560 nm de la réaction de la figure 1 en fonc-
tion du temps. b) Vitesse d"évolution de l"absorbance dAbs 560dt) en fonction du temps. Noter la présence d"un maximum vers la fin de la réaction qui est la caractéristique d"une réac- tion auto-accélérante. - La seconde zone se situe entre 300 et 490 nm. Elle montre l"absorption d"une ou de plusieurs espèces transitoires. Pour obtenir l"information concernant la cinétique d"évolution de ces intermédiaires réactionnels, on a choisi de considérer l"absorbance à 320 nm. A cette longueur d"onde, les coefficients d"absorption molaires des intermédiai-
res sont importants et celui de l"acide oxalique est négligeable.1628 BULLETIN DE L"UNION DES PHYSICIENS
B.U.P. n° 768
On observe que le dernier spectre est plat : le produit final de la réaction, l"ion Mn 2+ a des coefficients d"absorption molaires très faibles dans cette gamme de longueur d"onde Tant que la vitesse de disparition du permanganate est faible, l"absorbance à 320 nm croît lentement. Son évolution semble symétri- que de celle à 560 nm. Ensuite, lorsque la concentration des ions MnO 4 décroît rapidement, l"absorbance des intermédiaires décroît à son tour après être passée par un maximum. En fin de réaction, la disparition des espèces intermédiaires présente un léger retard par rapport à celle du permanganate. Figure 3 : ooo : Évolution de l"absorbance à 320 nm de la réaction de la figure 1 ;Figure 3 :
. . . : Évolution correspondante à 560 nm. Les seules entités susceptibles d"absorber dans le domaine de
longueurs d"onde considéré sont des composés du manganèse ; Mn(II) étant le produit de la réaction, les intermédiaires sont donc des espèces dont le degré d"oxydation varie entre VII et II.4.INFLUENCE DE LA CONCENTRATION INITIALE EN ACIDE
SULFURIQUE ET EN ACIDE OXALIQUE
Pour réaliser l"étude cinétique, on a fait varier les concentrations des divers réactifs, ce qui nous a amené à sortir des conditions strictement stoechiométriques définies dans l"équation de bilan (1).BULLETIN DE L"UNION DES PHYSICIENS 1629
Vol. 88 - Novembre 1994
*e [Mn(H 2 O) 6 2+ = 0,016 à 530 nm et 0,03 mol -1 L cm -1à 402 nm.
A - Variation de la concentration initiale d"acide sulfurique A - ([H 2 SO 4 0 Figure 4 : Influence de la concentration d"acide sulfurique : [MnO 4- 0 5.10 4 mol L - 1 ; [H 2 C 2 O 4 0 = 3,12.10 3 mol L - 1 [H 2 SO 4 0 : a) 2,25.10 - 2 mol L 1 ; b) 4,5.10 - 2 mol L 1 ; c) 9.10 - 2 mol L 11) Évolution de l"absorbance à 320 nm ; 2) Évolution de l"absorbance à 560 nm.
Une augmentation de la concentration initiale en acide sulfurique[H 2 SO 4 0 entraîne une diminution du temps de réaction global. L"effet est visible à la fois à 320 et à 560 nm. D"autre part, dans ces conditions expérimentales, les cinétiques à 320 nm présentent toujours un léger retard ; ce dernier est d"autant plus grand que [H 2 SO 4 0quotesdbs_dbs13.pdfusesText_19[PDF] de la fécondation ? la naissance 4ème exercices
[PDF] svt 4ème les étapes de l accouchement
[PDF] de la fécondation ? la naissance svt 4ème pdf
[PDF] différence de carré
[PDF] style corps de texte word
[PDF] oursin fécondation interne ou externe
[PDF] mise en forme du texte definition
[PDF] reproduction oursin wikipedia
[PDF] un document composite est
[PDF] mise en forme d'un texte word
[PDF] exercice tableau croisé dynamique excel 2010 pdf
[PDF] tableau croisé dynamique excel 2013 tutorial
[PDF] document composite
[PDF] capacitation des spermatozoide durée
