 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Energie de première ionisation Ei: Ag →Ag++ e-. Ei= EAg+- EAg b e) Montrer que
 Hydrogénoı̈des et méthode de Slater
Hydrogénoı̈des et méthode de Slater
Il s'agit toujours d'un cation. Formule générale des hydrogénoïdes : Z X(Z-1)+ Énergie d'ionisation des hydrogénoïdes. La réaction de première ionisation d ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées. (On ne
 TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
b) L'énergie de première ionisation du cuivre est de 7724 eV. Calculer en utilisant la méthode de Slater
 Lélément Cobalt
Lélément Cobalt
II-4) Dans le cadre de la méthode de Slater poser le calcul pour déterminer l'énergie de première ionisation de l'atome de cobalt en fonction des charges
 Question 1 : [38] La première partie était tirée aléatoirement. Vous
Question 1 : [38] La première partie était tirée aléatoirement. Vous
énergie (en eV) de première ionisation du sodium selon. Slater ? [2]. 7.3. Le dication sodium Na2+. 15. Donner la configuration électronique à l'état ...
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
fonction de l'énergie de chaque énergies de 1ère et de 2ème ionisation du calcium. Ei1= ECa+ - ECa = E'4s - 2E4s. Ei
 I ATOMISTIQUE
I ATOMISTIQUE
énergie de 1ère ionisation de l'atome de chlore. L' énergie orbitalaire ... Déterminer par un calcul simple les molécules qui à coup sûr sont paramagnétiques ...
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
9) En utilisant le modèle de Slater calculer les deux premières énergies d'ionisation de l'atome de. Potassium et comparer aux valeurs expérimentales. K Z =
 Applied spectroscopy
Applied spectroscopy
maintenant l'énergie de. Les calculs effectués dans ce chapitre repré- ... Finalement on remarque que l'énergie de première ionisation tend rapide-.
 CCP Chimie 1 PC 2012 — Corrigé
CCP Chimie 1 PC 2012 — Corrigé
La première partie touche à la chimie générale et étudie en particulier l'élé- 1.2.3 Dans le modèle de Slater l'énergie de première ionisation ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées.
 Corrigé
Corrigé
Jan 1 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
e) Montrer que dans l'approximation de Slater
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
a/ Ecrire les équations de première et de seconde ionisation du calcium. e/ Calculer ces énergies d'ionisation sachant que l'énergie d'un électron 4s ...
 Atomes et molécules
Atomes et molécules
5) Définir pour un atome X
 Calculatrices interdites Loxygène
Calculatrices interdites Loxygène
Jan 1 2002 (Pour les calculs
 Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
4- En déduire l'énergie de première ionisation et l'affinité électronique de l'atome d'azote. 5- Que peut-on en conclure quant à la stabilité de N- par rapport
 CORRIGE
CORRIGE
première ionisation anormalement élevée par comparaison avec l'énergie calculée dans le modèle de Slater. Lequel ? Réponse A : Bore ( Z = 5).
 Corrigés du chapitre 4 - EPFL
Corrigés du chapitre 4 - EPFL
l’énergie de électron dans l’orbitale 3s E n = 13:6 2:202 32 = 7:31 eV Pour ioniser Na en Na+ et donc détacher l’électron le plus externe de Na il faut fournir 7 31 eV Bien qu’approxi-matif ce calcul donne un résultat assez proche de la mesure expérimentale 5 14 eV Exercice 4 2
 Hydrogéno??des et méthode de Slater - sorbonne-universitefr
Hydrogéno??des et méthode de Slater - sorbonne-universitefr
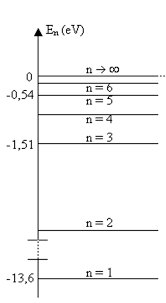
L’énergie de l’électron d‘un hydrogénoïde est donnée par l’expression : ' á( A 8) = ? 13 6 < 6 J 6 où n est le nombre quantique principal (entier positif non nul) qui désigne le numéro de la couche -19 J Énergie d’ionisation des hydrogénoïdes La réaction de première ionisation d’un hydrogénoïde s'écrit : X (Z -1
 ENQERGIE D’IONISATION
ENQERGIE D’IONISATION
La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié Ar Ar+ + e E i1 = 1576 ev La deuxième énergie d’ionisation nous permet d’arracher un deuxième électron Ar+ Ar++ + e E i2 = 2763 eV E i2 › E i1
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
C-2) Evaluer par différence l'énergie de première ionisation du bérylium EI = EBe+ - EBe = -39035 - -39822= 787 eV D) Energie de deuxième ionisation: Be+ = Be2+ + e-En utilisant la même démarche évaluer l'énergie de deuxième ionisation du bérylium EI2 = EBe2+ - EBe+ Be2+: 1s2 Z*1s = 4 – 03 = 37 E1s = -136 * 372 / 1 = -18618 eV
 Searches related to énergie de première ionisation calcul PDF
Searches related to énergie de première ionisation calcul PDF
II-6) L'énergie de première ionisation du fer est E i = 79 eV L'atome initialement dans son état fondamental est ionisé par un photon d'énergie E p = 10 eV a) Calculer l'énergie cinétique de l'électron éjecté b) Quelle serait l'énergie cinétique de l'électron éjecté si l'atome avait été préalablement préparé dans son
Comment calculer la première énergie d’ionisation ?
Cl est donc plus proche de la taille du cation K+. Sans chercher les valeurs numériques, classez les atomes suivants par ordre croissant de leur première énergie de ionisation : Se, Sr, Te, F,Br et Cs. Les tendances pour les premières énergies d’ionisations sont l’inverse des tendances pour les rayons atomiques(excercice 4.2).
Comment calculer l'énergie de deuxième ionisation ?
L'énergie de deuxième ionisation sera donc beaucoup plus élevée que l'énergie de première ionisation. 9) En utilisant le modèle de Slater, calculer les deux premières énergies d’ionisation de l’atome de Potassium et comparer aux valeurs expérimentales.
Quelle est la première énergie d’ionisation d’un atome?
Tout atome est caractérisé par plusieurs énergies d’ionisation. Exemple l’atome d’Argon (Z = 18) La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié. Ar Ar+ + e Ei1= 15,76 ev.
Comment calculer l’énergie d’ionisation de Na en Na+ ?
[eV], calculer l’énergie d’ionisation de Na en Na+. La con?guration électronique de Na est [Ne]3s1, que l’on peut expliciter en 1s22s22p63s1. La première énergie deionisation (pour obtenir Na+) correspond à l’énergie de l’électron le plus externe, ici celui qui occupe l’orbitale3s. Pour l’obtenir, on calculeZef f=Z Spour cet électron.
D.E.U.G. S.C.M. 1
ère
annéeEXAMEN DE CHIMIE 1
Janvier 2003
(durée: 2h 30)Corrigé
Toutes les parties sont indépendantes - Calculatrices interdites(Pour les calculs, utiliser les valeurs numériques données à la fin du sujet et simplifier au
maximum avant d'effectuer un calcul à la main) I- Atomistique- l'élément sodium Na ( 45 min) L'élément sodium a un numéro atomique égal à 11.1) Décrire la composition du noyau de l'isotope naturel, pour lequel le nombre de masse est
égal à 23.
Z=11 protons A= Z+N N =23-11=12neutrons2) Les lampes à vapeur de sodium émettent un rayonnement de longueur d'onde égale à 589
nm. A quel domaine du spectre électromagnétique appartient ce rayonnem ent ? Donner l'expression de la fréquence correspondante et poser le calcul dan s le système international d'unités. En donner une valeur approchée.Ȝ= 589nm il s'agit du domaine du visible
Ȟ= c/ Ȝ 5 10
14 s -1 3) Donner la configuration électronique de l'élément sodium et indiquer le nombre d'électrons de valence. A quelle famille de la classification périodique appartient-il ? 1s 2 2s 2 2p 6 3s 1 un électron de valenceIl fait partie de la famille des alcalins
4) Déf
inir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et
le tableau des coefficients donné ci-après, déterminer une valeur approchée de l'énergie
de première ionisation du sodium. La comparer à celles du lithium (Z = 3) et du magnésium (Z = 12). Justifier votre réponse en considérant la position relative de ces éléments dans la classification périodique.Na ĺ Na+
+ eI= E(Na
) - E(Na) =- E 3s = 13,6 .Z eff²/3²
Pour un électron 3s ı= 8.0,85+2.1 =8,8
Z eff =2,2I=13,6.(2,2)²/9 7eV
LiNa Mg L' énergie d' ionisation diminue le long d' une colonne ( de haut en
bas) et augmente sur une ligne de gauche à droite D'où I(Mg) >I(Na) et I(Na) 5) Pour un ion hydrogénoïde, l'orbitale atomique 3s est de la forme : 1 n, l, m (r, , ) = R n, l (r) Y l, m avec : Y l, m 1 2 et R n, l (r) = K [6 - 4Zr a 0 4 Z 2 r 2 9 a 0 2 ] e Zr 3a 0 pour simplifier les calculs, on pose = 2Zr / 3a 0 et l'expression de R devient alors : R n, l () = K (6 - 6 + 2 ) e 2 a) Préciser les noms des nombres quantiques n, l et m, ainsi que leurs valeurs dans le cas présent. n : nombre quantique principal l :nombre quantique secondaire ou azimutal m :nombre quantique magnétique n=3 , l=0 , m=0 b) Pour quelles valeurs de la densité électronique radiale s'annule-t-elle ? Expliciter la forme des surfaces de densité nulle.La densité radiale est proprtionnelle à r² R² ou ȡ² R(ȡ)² et s' annule pour ȡ=3+3 et
ȡ= 3-3
comme Y l,m (ș,ij)=constante les surfaces d' isodensité et en particullier de densité nulle sont des sphères. c) Exprimer la condition de normalisation permettant de calculer la constante K. ȥ²dIJ =1 dIJ= r².sinș dr dș dij d) Calculer K en choisissant comme variable. Pour cela on exprimera r et dr en fonction de et d et on donne : n e d = n! 0 et 362! -723! + 484! -125! + 6! = 72 1= ( 2 1 2 0 d 0 sind 0 )²(²drrRr 1=(22 4 1 xx Z a 2 303 0 )²(²dR =K² ( Z a 2 30
3 0 6543
)124872²36( de
1= K² (
Z a 2 303 (36x2 ! -72x3 ! +48x4! -12x5!+6!) K=( 0a Z 3/2 x 39
1 2 II- Liaison chimique - structure électronique des halogénures d'hydrogène HX (25 min)
1) Sachant que son numéro atomique est égal à 9 écrire la configuration électronique du
fluor. F 1s 2 2s 2 2p 52) Les énergies des orbitales atomiques de valence du fluor sont égales à -46,4 et -18,7 eV.
Placer sur un diagramme d'énergie les niveaux correspondant, ainsi que celui de l'atome d'hydrogène.Voir question suivante
3) Compléter le diagramme précédent en faisant apparaître les niveaux d'énergie de
s orbitales moléculaires de HF. -13,6eV ĹĻ 1s H ĹĻ ĹĻ ĹĻ ĹĻ Ĺ -18,7eV :2p F Ĺ Ļ Ĺ Ļ -46,4eV 2s F4) Ecrire chaque orbitale moléculaire sous forme d'une combinaison linéaire des orbitales
atomiques. En donner une représentation schématique.ı= c
1 1s H + c 2 2p zF avec c 2 >c 1 >0ı*= c'
1 1s H - c' 2 2p zF avec c' 1 >c' 2 >05) Commenter la polarité de la liaison HF.
Dans le développement de ı comme combinaison linéaire de 1s H et 2p z le coefficient de 2p z est supérieur à celui de 1s H . La densité électronique sur le fluor sera donc supérieure à celle sur l' hydrogène et la liaison polarisée :H Fĺ sens du moment dipolaire
6) On donne pour différents halogénures d'hydrogène la longueur de la liaison HX, ainsi
que son moment dipolaire.HF HCl HBr HI
d H-X (pm) 92 127 141 160 (Debye) 1,74 1,07 0,788 0,381 a) Commenter les variations de longueur de liaison et de moment dipolaire. 3 diminue. b) Pour quel halogénure la liaison HX sera-t-elle la plus covalente ? C' est donc pour HI que la liaison sera la plus covalente (µ le p lus faible et distance la plus longue) c) Poser le calcul du caractère ionique de la liaison HI et en déduir e une valeur approchée. % ionicité= exd exp 5%III- Cinétique (40 min)
On s'intéresse ici à la réaction CO + NO 2 CO 2 + NO en phase gazeuse1) Ecrire l'expression générale de la vitesse de la réaction en fonction des concentrations en
monoxyde de carbone et dioxyde d'azote. v= k[CO] [NO 22) On précise que l'ordre partiel de la réaction par rapport à CO est nul. Par ailleurs, le temps
de demi-réaction varie en fonction de la concentration initiale en NO 2 de la façon suivante : [NO 2 0 mol L -1 t 1/2 s 0,1 0,05 20 40En déduire l'ordre de la réaction, en justifiant votre réponse, ainsi que la valeur de la constante de vitesse observée.
Į=0 t
1/2 dépend de la concentration initiale est multiplié par 2 si [NO 2 0 est dividé par 2 donc ȕ=2 pour une réaction d' ordre 2 t 1/2 = 1/ (k.[NO 2 0 d' où k= 0,5 L.mol -1 .s -13) On propose pour la réaction précédente trois mécanismes :
Mécanisme 1 : CO + NO
2 CO 2 + NOMécanisme 2 : NO
2 + NO 2 NO 3 + NO lente NO 3 + CO NO 2 + CO 2 rapideMécanisme 3 : NO
2NO + O lente
CO + O CO
2 rapide Quel mécanisme retiendrez-vous ? Justifiez votre réponse. Si la réaction était élémentaire comme pour le mécanisme1 on aurait Į=1 et ȕ=1
Pour les mécanisme 2 et 3 l' étape lente impose sa vitesse ; la réaction étant d' ordre2 par
rapport à NO 2 on retiendra le mécanisme 2 44) Au dessus de 500 K, le mécanisme de la réaction est différent. Le tableau suivant donne
les vitesses initiales mesurées pour différentes valeurs des concentrations initiales en CO et NO 2à une température T> 500K.
expérience [CO] 0 mol L -1 [NO 2 0 mol L -1 v initiale mol L -1 h -1 1 2 3 4 55,1 10
-45,1 10
-45,1 10
-4 1 10 -31,5 10
-30,35 10
-40,70 10
-40,18 10
-40,35 10
-40,35 10
-43,4 10
-86,8 10
-81,7 10
-86,8 10
-810,2 10
-8En déduire l'ordre partiel de chacun des réactifs, ainsi que la valeur de la constante de vitesse
quotesdbs_dbs35.pdfusesText_40[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale
[PDF] morphologie des insectes pdf
[PDF] classification des insectes pdf
[PDF] biologie des insectes pdf
[PDF] cours dentomologie générale pdf
[PDF] systématique des insectes pdf
