 Corrigé
Corrigé
1 janv. 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après ...
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Energie de première ionisation Ei: Ag →Ag++ e-. Ei= EAg+- EAg b e) Montrer que
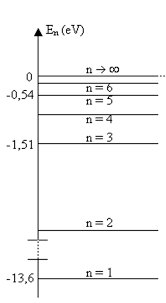 Hydrogénoı̈des et méthode de Slater
Hydrogénoı̈des et méthode de Slater
Il s'agit toujours d'un cation. Formule générale des hydrogénoïdes : Z X(Z-1)+ Énergie d'ionisation des hydrogénoïdes. La réaction de première ionisation d ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées. (On ne
 TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
b) L'énergie de première ionisation du cuivre est de 7724 eV. Calculer en utilisant la méthode de Slater
 Lélément Cobalt
Lélément Cobalt
II-4) Dans le cadre de la méthode de Slater poser le calcul pour déterminer l'énergie de première ionisation de l'atome de cobalt en fonction des charges
 Question 1 : [38] La première partie était tirée aléatoirement. Vous
Question 1 : [38] La première partie était tirée aléatoirement. Vous
énergie (en eV) de première ionisation du sodium selon. Slater ? [2]. 7.3. Le dication sodium Na2+. 15. Donner la configuration électronique à l'état ...
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
fonction de l'énergie de chaque énergies de 1ère et de 2ème ionisation du calcium. Ei1= ECa+ - ECa = E'4s - 2E4s. Ei
 I ATOMISTIQUE
I ATOMISTIQUE
énergie de 1ère ionisation de l'atome de chlore. L' énergie orbitalaire ... Déterminer par un calcul simple les molécules qui à coup sûr sont paramagnétiques ...
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
9) En utilisant le modèle de Slater calculer les deux premières énergies d'ionisation de l'atome de. Potassium et comparer aux valeurs expérimentales. K Z =
 Applied spectroscopy
Applied spectroscopy
maintenant l'énergie de. Les calculs effectués dans ce chapitre repré- ... Finalement on remarque que l'énergie de première ionisation tend rapide-.
 CCP Chimie 1 PC 2012 — Corrigé
CCP Chimie 1 PC 2012 — Corrigé
La première partie touche à la chimie générale et étudie en particulier l'élé- 1.2.3 Dans le modèle de Slater l'énergie de première ionisation ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées.
 Corrigé
Corrigé
Jan 1 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
e) Montrer que dans l'approximation de Slater
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
a/ Ecrire les équations de première et de seconde ionisation du calcium. e/ Calculer ces énergies d'ionisation sachant que l'énergie d'un électron 4s ...
 Atomes et molécules
Atomes et molécules
5) Définir pour un atome X
 Calculatrices interdites Loxygène
Calculatrices interdites Loxygène
Jan 1 2002 (Pour les calculs
 Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
4- En déduire l'énergie de première ionisation et l'affinité électronique de l'atome d'azote. 5- Que peut-on en conclure quant à la stabilité de N- par rapport
 CORRIGE
CORRIGE
première ionisation anormalement élevée par comparaison avec l'énergie calculée dans le modèle de Slater. Lequel ? Réponse A : Bore ( Z = 5).
 Corrigés du chapitre 4 - EPFL
Corrigés du chapitre 4 - EPFL
l’énergie de électron dans l’orbitale 3s E n = 13:6 2:202 32 = 7:31 eV Pour ioniser Na en Na+ et donc détacher l’électron le plus externe de Na il faut fournir 7 31 eV Bien qu’approxi-matif ce calcul donne un résultat assez proche de la mesure expérimentale 5 14 eV Exercice 4 2
 Hydrogéno??des et méthode de Slater - sorbonne-universitefr
Hydrogéno??des et méthode de Slater - sorbonne-universitefr
L’énergie de l’électron d‘un hydrogénoïde est donnée par l’expression : ' á( A 8) = ? 13 6 < 6 J 6 où n est le nombre quantique principal (entier positif non nul) qui désigne le numéro de la couche -19 J Énergie d’ionisation des hydrogénoïdes La réaction de première ionisation d’un hydrogénoïde s'écrit : X (Z -1
 ENQERGIE D’IONISATION
ENQERGIE D’IONISATION
La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié Ar Ar+ + e E i1 = 1576 ev La deuxième énergie d’ionisation nous permet d’arracher un deuxième électron Ar+ Ar++ + e E i2 = 2763 eV E i2 › E i1
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
C-2) Evaluer par différence l'énergie de première ionisation du bérylium EI = EBe+ - EBe = -39035 - -39822= 787 eV D) Energie de deuxième ionisation: Be+ = Be2+ + e-En utilisant la même démarche évaluer l'énergie de deuxième ionisation du bérylium EI2 = EBe2+ - EBe+ Be2+: 1s2 Z*1s = 4 – 03 = 37 E1s = -136 * 372 / 1 = -18618 eV
 Searches related to énergie de première ionisation calcul PDF
Searches related to énergie de première ionisation calcul PDF
II-6) L'énergie de première ionisation du fer est E i = 79 eV L'atome initialement dans son état fondamental est ionisé par un photon d'énergie E p = 10 eV a) Calculer l'énergie cinétique de l'électron éjecté b) Quelle serait l'énergie cinétique de l'électron éjecté si l'atome avait été préalablement préparé dans son
Comment calculer la première énergie d’ionisation ?
Cl est donc plus proche de la taille du cation K+. Sans chercher les valeurs numériques, classez les atomes suivants par ordre croissant de leur première énergie de ionisation : Se, Sr, Te, F,Br et Cs. Les tendances pour les premières énergies d’ionisations sont l’inverse des tendances pour les rayons atomiques(excercice 4.2).
Comment calculer l'énergie de deuxième ionisation ?
L'énergie de deuxième ionisation sera donc beaucoup plus élevée que l'énergie de première ionisation. 9) En utilisant le modèle de Slater, calculer les deux premières énergies d’ionisation de l’atome de Potassium et comparer aux valeurs expérimentales.
Quelle est la première énergie d’ionisation d’un atome?
Tout atome est caractérisé par plusieurs énergies d’ionisation. Exemple l’atome d’Argon (Z = 18) La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié. Ar Ar+ + e Ei1= 15,76 ev.
Comment calculer l’énergie d’ionisation de Na en Na+ ?
[eV], calculer l’énergie d’ionisation de Na en Na+. La con?guration électronique de Na est [Ne]3s1, que l’on peut expliciter en 1s22s22p63s1. La première énergie deionisation (pour obtenir Na+) correspond à l’énergie de l’électron le plus externe, ici celui qui occupe l’orbitale3s. Pour l’obtenir, on calculeZef f=Z Spour cet électron.
DUREE : 45 minutes
Questionnaire à choix multiple mais à réponse unique. Vous devez choisir la bonne réponse parmis les cinq propositions qui vous sont faites.CORRIGEDONNEES
Constantes d'écran de Slater
Célérité de la lumière dans le videC = 3 108 m.s-1Constante de RydbergRH = 1,096 107 m-1
Constante de Planckh = 6,62 10-34 J.s
Charge élémentairee = 1,602 10-19 C
Energie d'ionisation de l'hydrogèneE0 = 13,6 eV = 2,18 10-18 J = 1312 kJ.mol-1 1 / 7 QUESTION 1 :(2 points) Pour l'atome de numéro atomique Z = 42, la configurationélectronique peut s'écrire :
Réponse A : (Kr) 5s2 5p4
Réponse B : (Kr) 4s2 4p4
Réponse C : (Kr) 3d4 4s2
Réponse D : K2 L8 M18 N12 O2
Réponse E : K2 L8 M18 N14
Z = 42 = 36 + 6 = (Kr) + 6
(Kr) 5s2 4d4 (Kr) 4d4 5s21s2 2s2 2p6 3s2 3p6 3 d10 4s2 4p6 4d4 5 s2
K2 L8 M18 N12 O2
Réponse D : K2 L8 M18 N12 O2
2 / 7 QUESTION 2 : (2 points) Pour un électron de valence de l'atome de numéro atomique Z = 33, la charge nucléaire effective de Slater Z* est :Réponse A : Z* = 4,55
Réponse B : Z* = 3,3
Réponse C : Z* = 7,5
Réponse D : Z* = 6,3
Réponse E : Z* = 8,45
Z = 33 = 18 + 15 = (Ar) + 15 = (Ar) 4s2 3d10 4 p3 = (Ar) 3d10 4s2 4 p3 groupe1s2s 2p3s 3p3d4s 4pEffet d'écran sur 4s 4p110,850,850,35
Nombre d'électron total288105
Z* = 33 - ( 10 * 1 ) - (18*0,85 ) - ( 4*0,35 ) = 6,3Réponse D : Z* = 6,3
QUESTION 3 : (4 points) Par utilisation du modèle de Slater, évaluer l'énergie de troisième ionisation de l'atome Na de numéro atomique Z = 11. On trouve :Réponse A : E.I3 = 96,5 eV
Réponse B : E.I3 = 71,3 eV
Réponse C : E.I3 = 87,8 eV
Réponse D : E.I3 = 14,2 eV
Réponse E : E.I3 = 25,6 eV
Z=11 = 1s2 2s2 2p6 3s1
Na1s2 2s2 2p6 3s1
Na+1s2 2s2 2p6
Na2+1s2 2s2 2p52 E1 + 7 E2
Na3+1s2 2s2 2p42 E1 + 6 E'2
Na3+1s2 2s2 2p3
Troisième ionisation : passage de Na2+ à Na3+EI3 = ENa3+ - ENa2+
EI3 = 6 E'2 - 7 E2
En = -E0 Z*2 / n2
3 / 7Calcul de E2 :
Z* = 11 - ( 6 * 0,35 ) - ( 2 * 0,85 ) = 7,2
E2 = -176,3 eV
Calcul de E'2 :
Z* = 11 - ( 5 * 0,35 ) - ( 2 * 0,85 ) = 7,2 + 0,35 = 7,55E2 = -193,8 eV
Calcul de EI3 :
EI3 = ( 6 * -176,3 ) - ( 7 * -193,8 ) = 71,3 eV
Réponse B : E.I3 = 71,3 eV
QUESTION 4 : (2 points) Un des atomes suivants possède une énergie de première ionisation anormalement élevée, par comparaison avec l'énergie calculée dans le modèle de Slater. Lequel ?Réponse A : Bore ( Z = 5)
Réponse B : Carbone (Z = 6)
Réponse C : Azote ( Z = 7)
Réponse D : Oxygène ( Z = 8)
Réponse E : Fluor ( Z = 9)
Une énergie d'ionisation anormalement élevée correspont à une ionisation particulièrement difficile,
l'atome de départ doit donc être très stable, sa couche de valence doit donc comporter soit une sous-
couche totalement remplie, soit une sous-couche à moitié remplie. Parmis les atomes qui nousinteresse ici, seul l'azote est dans ce cas avec sa configuration 2s2 2p3 et sa sous couche p à moitié
remplie.Réponse C : Azote ( Z = 7)
QUESTION 5 : (2 points) Il existe quatre isotopes différents de l'élément Scandium (Z = 21) notés 44Sc, 45Sc, 46Sc et 47Sc. Un seul de ces isotopes est stable, les trois autres sont radioactifs. On donne la masse molaire atomique du Scandium qui est de 44,95 g.mol-1. Choisir l'unique proposition exacte concernant la stabilité ou le type de radioactivité des quatre isotopes.44Sc45Sc46Sc47Sc
Réponse Ab+b-stableb+
Réponse Bb-stableb+b+
Réponse Cb-b-stableb+
Réponse Db-stableb+b+
Réponse Eb+stableb-b-
4 / 7 La masse molaire très proche de 45 nous donne la nature de l'isotope stable.45ScLes isotopes 46Sc et 47Sc qui " contiennent » des neutrons excédentaires par rapport à 45Sc vont chercher à se stabliser en trans formant un neutron en proton, ce seront donc
des émeteurs b-. L'isotope 44Sc qui " contient » un neutron de moins par rapport à 45Sc va chercher à se stabliser en trans formant un proton en, neutron ce sera donc un émeteur b+.Réponse E
Remarque : Les réponses B et D étant identiques, elles étaient obligatoirement inexactes et il suffisait donc d'identifier l'isotope stable pour trouver la solution. QUESTION 6 : (3 points) L'électron de l'atome d'Hydrogène en " retombant » de son niveau n = 6 à son niveau n = 3, émet un photon de longueur d'onde :Réponse A : l = 4800 nm
Réponse B : l = 109,5 nm
Réponse C : l = 1095 nm
Réponse D : l = 480 nm
Réponse E : l = 5950 nm
Formule de Balmer-Rydberg :
1 / l = RH (1/n2 - 1/p2)
1 / l = 1,096 107 ( 1 / 9 - 1 / 36 ) = 913333 m-1
l = 1095 nmMéthode générale :
DE = Ep - En = -E0/p2 + E0/n2 = E0 (1/n2-1/p2)
DE = h n = h C / l
1 / l = DE / hC = ( E0 / h / C ) * (1/n2-1/p2)
( E0 / h / C ) = 2,18 10-18 / 6,62 10-34 / 3 108 = 1,098 1071 / l = 1,098 107 ( 1 / 9 - 1 / 36 ) = 915000 m-1
l = 1093 nm Au arrondis près (valeurs de C, h et E0) on obtient bien la même valeur.Réponse C : l = 1095 nm
5 / 7 QUESTION 7 : (1 point) Pour un électron du niveau de la sous-couche 4d, les valeurs des quatre nombres quantiques n, l, m et s peuvent être : nlmsCouche 4 donc n = 4
l = 0 : s ; l = 1 : p ; l = 2 : d ; l = 4 : f ...Ici sous-couche d donc l = 2
s = +/- ½Réponse A
QUESTION 8 : (2 points) A quelle colonne de la classification l'élément dont le schéma de Lewis est le suivant appartient-il ?Réponse A : Colonne 17
Réponse B : Colonne 16
Réponse C : Colonne 15
Réponse D : Colonne 14
Réponse E : Colonne 13
Configuration s2 p4 = Colonne 16
Réponse B
6 / 7 QUESTION 9 : (2 points) Classer les atomes suivants par ordre croissant de leur rayon atomique : C (Z=6) - O (Z=8) - Mg (Z=12) - Si (Z=14)Réponse A : RMg < RC < RO < RSi
Réponse B : RC < RMg < RO < RSi
Réponse C : RC < RO < RMg < RSi
Réponse D : RC < RSi < RMg < RO
Réponse E : RO < RC < RSi < RMg
Le rayon atomique varie comme n2/Z*
Sur une ligne Z* augmente régulièrement de gauche à droite et n reste constant, le rayon diminue
donc de gauche à droite sur une même ligne de la classification.Sur une colonne Z* augmente très légérement de haut en bas puis devient rapidement constant;
tandis que n raugmente de une unité à chaque ligne.L'effet d'augmentation rapide de n (puissance 2)
l'emporte sur la très légère augmentation de Z*. Le rayon augmente donc de haut en bas sur une
même colonne de la classification. C et O sont sur la même ligne 2 .avec O à droite de C : RC > RO Mg et Si sont sur la même ligne 3, avec Si à droite de Mg : RMg > RSi C et Si sont dans la même colonne 14 avec C au dessus de Si : RSi > RCRéponse E : RO < RC < RSi < RMg
7 / 7quotesdbs_dbs35.pdfusesText_40[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale
[PDF] morphologie des insectes pdf
[PDF] classification des insectes pdf
[PDF] biologie des insectes pdf
[PDF] cours dentomologie générale pdf
[PDF] systématique des insectes pdf
