 Corrigé
Corrigé
1 janv. 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après ...
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Energie de première ionisation Ei: Ag →Ag++ e-. Ei= EAg+- EAg b e) Montrer que
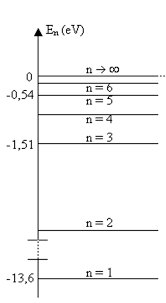 Hydrogénoı̈des et méthode de Slater
Hydrogénoı̈des et méthode de Slater
Il s'agit toujours d'un cation. Formule générale des hydrogénoïdes : Z X(Z-1)+ Énergie d'ionisation des hydrogénoïdes. La réaction de première ionisation d ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées. (On ne
 TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
b) L'énergie de première ionisation du cuivre est de 7724 eV. Calculer en utilisant la méthode de Slater
 Lélément Cobalt
Lélément Cobalt
II-4) Dans le cadre de la méthode de Slater poser le calcul pour déterminer l'énergie de première ionisation de l'atome de cobalt en fonction des charges
 Question 1 : [38] La première partie était tirée aléatoirement. Vous
Question 1 : [38] La première partie était tirée aléatoirement. Vous
énergie (en eV) de première ionisation du sodium selon. Slater ? [2]. 7.3. Le dication sodium Na2+. 15. Donner la configuration électronique à l'état ...
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
fonction de l'énergie de chaque énergies de 1ère et de 2ème ionisation du calcium. Ei1= ECa+ - ECa = E'4s - 2E4s. Ei
 I ATOMISTIQUE
I ATOMISTIQUE
énergie de 1ère ionisation de l'atome de chlore. L' énergie orbitalaire ... Déterminer par un calcul simple les molécules qui à coup sûr sont paramagnétiques ...
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
9) En utilisant le modèle de Slater calculer les deux premières énergies d'ionisation de l'atome de. Potassium et comparer aux valeurs expérimentales. K Z =
 Applied spectroscopy
Applied spectroscopy
maintenant l'énergie de. Les calculs effectués dans ce chapitre repré- ... Finalement on remarque que l'énergie de première ionisation tend rapide-.
 CCP Chimie 1 PC 2012 — Corrigé
CCP Chimie 1 PC 2012 — Corrigé
La première partie touche à la chimie générale et étudie en particulier l'élé- 1.2.3 Dans le modèle de Slater l'énergie de première ionisation ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées.
 Corrigé
Corrigé
Jan 1 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
e) Montrer que dans l'approximation de Slater
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
a/ Ecrire les équations de première et de seconde ionisation du calcium. e/ Calculer ces énergies d'ionisation sachant que l'énergie d'un électron 4s ...
 Atomes et molécules
Atomes et molécules
5) Définir pour un atome X
 Calculatrices interdites Loxygène
Calculatrices interdites Loxygène
Jan 1 2002 (Pour les calculs
 Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
4- En déduire l'énergie de première ionisation et l'affinité électronique de l'atome d'azote. 5- Que peut-on en conclure quant à la stabilité de N- par rapport
 CORRIGE
CORRIGE
première ionisation anormalement élevée par comparaison avec l'énergie calculée dans le modèle de Slater. Lequel ? Réponse A : Bore ( Z = 5).
 Corrigés du chapitre 4 - EPFL
Corrigés du chapitre 4 - EPFL
l’énergie de électron dans l’orbitale 3s E n = 13:6 2:202 32 = 7:31 eV Pour ioniser Na en Na+ et donc détacher l’électron le plus externe de Na il faut fournir 7 31 eV Bien qu’approxi-matif ce calcul donne un résultat assez proche de la mesure expérimentale 5 14 eV Exercice 4 2
 Hydrogéno??des et méthode de Slater - sorbonne-universitefr
Hydrogéno??des et méthode de Slater - sorbonne-universitefr
L’énergie de l’électron d‘un hydrogénoïde est donnée par l’expression : ' á( A 8) = ? 13 6 < 6 J 6 où n est le nombre quantique principal (entier positif non nul) qui désigne le numéro de la couche -19 J Énergie d’ionisation des hydrogénoïdes La réaction de première ionisation d’un hydrogénoïde s'écrit : X (Z -1
 ENQERGIE D’IONISATION
ENQERGIE D’IONISATION
La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié Ar Ar+ + e E i1 = 1576 ev La deuxième énergie d’ionisation nous permet d’arracher un deuxième électron Ar+ Ar++ + e E i2 = 2763 eV E i2 › E i1
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
C-2) Evaluer par différence l'énergie de première ionisation du bérylium EI = EBe+ - EBe = -39035 - -39822= 787 eV D) Energie de deuxième ionisation: Be+ = Be2+ + e-En utilisant la même démarche évaluer l'énergie de deuxième ionisation du bérylium EI2 = EBe2+ - EBe+ Be2+: 1s2 Z*1s = 4 – 03 = 37 E1s = -136 * 372 / 1 = -18618 eV
 Searches related to énergie de première ionisation calcul PDF
Searches related to énergie de première ionisation calcul PDF
II-6) L'énergie de première ionisation du fer est E i = 79 eV L'atome initialement dans son état fondamental est ionisé par un photon d'énergie E p = 10 eV a) Calculer l'énergie cinétique de l'électron éjecté b) Quelle serait l'énergie cinétique de l'électron éjecté si l'atome avait été préalablement préparé dans son
Comment calculer la première énergie d’ionisation ?
Cl est donc plus proche de la taille du cation K+. Sans chercher les valeurs numériques, classez les atomes suivants par ordre croissant de leur première énergie de ionisation : Se, Sr, Te, F,Br et Cs. Les tendances pour les premières énergies d’ionisations sont l’inverse des tendances pour les rayons atomiques(excercice 4.2).
Comment calculer l'énergie de deuxième ionisation ?
L'énergie de deuxième ionisation sera donc beaucoup plus élevée que l'énergie de première ionisation. 9) En utilisant le modèle de Slater, calculer les deux premières énergies d’ionisation de l’atome de Potassium et comparer aux valeurs expérimentales.
Quelle est la première énergie d’ionisation d’un atome?
Tout atome est caractérisé par plusieurs énergies d’ionisation. Exemple l’atome d’Argon (Z = 18) La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié. Ar Ar+ + e Ei1= 15,76 ev.
Comment calculer l’énergie d’ionisation de Na en Na+ ?
[eV], calculer l’énergie d’ionisation de Na en Na+. La con?guration électronique de Na est [Ne]3s1, que l’on peut expliciter en 1s22s22p63s1. La première énergie deionisation (pour obtenir Na+) correspond à l’énergie de l’électron le plus externe, ici celui qui occupe l’orbitale3s. Pour l’obtenir, on calculeZef f=Z Spour cet électron.
DEUG MIAS 1ère année
Module de Chimie
EPREUVE DE CHIMIE
DUREE 1h30
LES CALCULATRICES SONT STRICTEMENT INTERDITES
* Les deux parties sont indépendantes. * Les données numériques nécessaires aux calculs sont regroupé es en fin de sujet. Vérifier que le sujet comprend bien une page imprimée recto-verso.Corrigé
Partie A : ATOMISTIQUE
-I- L'un des isotopes de l'argent est représenté par le symbole 1 407 7 Ag. a) Déterminer, pour un atome, le nombre d'électrons et la composition du noyau.
47 protons, 107-47 =60 neutrons, 47 électrons
b) En quoi diffèrent les isotopes d'un élément ? Envisager un exemple pour Ag. Leur nombre de protons est identique mais le nombre de neutrons est différent donc le nombre de
masse A diffère c) L'argent Ag et le cuivre Cu se trouvent dans la même colonne et possèdent une structureélectronique externe similaire. Ecrire la configuration électronique de l'état fondamental de
Ag.Ag : 1s
2 2s 2 2p 6 3s 23p6 3d 10 4s 2 4p 6 4d 10 5s 1
d) Quel type d'ion a-t-il tendance à former principalement ? Justifier votre réponse. Il a tendance à perdre un électron ,l' électron 5s et à d
onner l'ion Ag e) Donner la configuration électronique de l'or Au qui se situe juste au-dessous de Ag. Justifier que le numéro atomique de Au est 79.Remplissage : 5s 4d 5p 6s 4f 5d
2 10 6 2 14 10 pour arriver à l' or( Au) on doit rajouter 1+6+1+14+10 électrons
=32 d'où Z(Ua) = 47+32=79f) Définir succinctement l'électronégativité et montrer schématiquement son évolution à travers
la classification périodique. Classer par ordre croissant d'électronégativité 9 F, 47Ag et 55
Cs. Electronégativité : mesure relative de la tendance d' un atome
à perdre ou capter un électron
Cs( 1ère
colonne)F( 17 colonne
,2ligne)De Cs , Ag à
F l' électronégativité croit
-II- On se place dans l'approximation de Slater pour calculer le potentiel de 1ère ionisation de Ag.
a) Expliquer schématiquement le processus d'ionisation et définir le potentiel de 1ère ionisation
E i de Ag.AĺA
q+ + qeEnergie de première ionisation ,E
i Ag Ag + e E i = E Ag+ - E Agb) Ecrire l'expression générale de l'énergie d'un électron dans l'approximation de Slater.
Expliciter les différents symboles utilisés.En= -13,6 Z
n *²/n²Z*: charge effective
N: nombre quantique principal
c) Reprendre la configuration électronique de Ag, ainsi que de son ion Ag , en regroupant les électrons par valeurs croissantes du nombre quantique principal n. Ag : 1s 2 /2s 2 2p 6 /3s 2 3p 6 /4s 2 4p 6 /4d 10 d) Ecrire l'expression de l'énergie totale de Ag et Ag en fonction de l'énergie de chaqueélectron.
E Ag = 2 E 1s + 8E 2s,2p +8 E 3s,3p +10E 3d + 8 E 4s,4p +10E 4d +E 5s E Ag+ = 2E' 1s + 8 E' 2s,2p + 8E' 3s,3p +10E' 3d +8 E' 4s,4p + 10E' 4d e) Montrer que, dans l'approximation de Slater, le calcul de l'énergie de 1ère ionisation ne nécessite l'évaluation que d'une seule charge effective Z*.Calculer numériquement E
i L' électron supplémentaire de Ag est extérieur et n' é crante pas les autres électronsDonc E
nl = E' nl E i = - E 5s donc seule Z* 5s reste à calculer Z* 5s = 47 -(2x1+8x1+8x1+10x1+8x0,85+10x0,85) =3,7 E 5s = -13,6 3,7²/5²=-7,5eV E i = 7,5eVPartie B : ETAT SOLIDE
-I- La maille élémentaire de l'argent contient des atomes aux sommets et aux centres des faces d'un
cube d'arête a=0,41 nm. a) Dans quel système cristallise ce cristal ? c.f.c b) Définir et établir la coordinence des atomes de la maille. La coordinence est le nombre de plus proches voisins. 3+6+3 pour une str ucture compactec) Faire un schéma de l'une des faces du cube élémentaire en supposant que le modèle des
sphères rigides et tangentes est applicable. En déduire la valeur du rayon atomique R Ag de l'argent. 2 a=4R R=0,14nmd) Donner la définition de la compacité, établir son expression dans le cas de ce cristal. Donner
un exemple d'un autre système de cristallisation de même compacité. Compacité= volume des atomes dans la maille /volume de la maille= 0,7 4L' hexagonal compact a même compacité
e) Etablir l'expression littérale de la masse volumique du cristal en fonction de R Ag , du nombre d'Avogadro N A et de la masse molaire M Ag de l'argent. En donner une valeur numérique approchée en kg m -3ȡ=4 M
Ag /( N A x a 3 ) =10 4 kg.m -3 -II- On va considérer une solution solide constituée majoritairement d'argent. a/ Définir les deux types de solution solide en décrivant succinc tement leurs différences.Solution solide de substitution : mélange de deux solides métalliques constitués d' atomes de rayon
atomique très proche qui cristallisent en général dans le même système dont les électronégativités ne
sont pas très éloignés. Position des atomes aléatoires suiva nt leur proportion dans ce système.Solution solide d' insertion : les gros atomes imposent la géométrie et les petits s' insérent dans les
sites intersticielsb/ Définir et préciser la position des sites tétraédriques dans le cristal d'argent étudié ci-dessus.
Etablir la condition d'insertion (r/R) d'atomes de rayon atomique r dans ces sites. Ils sont définis par 4 atomes , en c.f.c ils sont au centre des petit s cubes ( a/2) a2= 4R 4 .1a3R+r r/R0,225
c/ Définir et préciser la position des sites octaédriques dans ce même cristal d'argent. Etablir la
condition d'insertion (r/R) dans ce cas. Ils sont définis par 8 atomes ; en cfc ils sont situés au de la ma ille et au milieu des arêtes a2= 4R a2R+2r r/R 0,414 d/ L'or, de rayon atomique R Au =0,14 nm, donne une solution solide avec l'argent. D'après les résultats précédents, préciser à quel type de solution so lide appartient cet alliage et, le cas échéant, la position des atomes d'or. R Au = R donc impossible insertion d'où la solution solide est de substitutione/ Sachant que le paramètre de maille de l'or est 0,41 nm, en déduire la structure cristalline de
l'or. Montrer ainsi que la formation de la solution solide établie dans la question précédente est
favorisée. A Au =0,41 =a et R Au =R donc Au cristallise aussi en cfc ce qui favorise la formation de la solution solideDonnées numériques
Masse molaire de Ag M
Ag =0,11 kg mol -1 3/2 = 1,2 2 = 1,4 3 = 1,7 N A =6.0 10 23ʌ = 3,1
Tableau des constantes d'écran :
Electron faisant écran
Electron considéré
1s 2s,2p 3s,3p 3d 4s,4p 4d 4f 5s,5p1s 0,31
2s,2p 0,85 0,35
3s,3p 1 0,85 0,35
3d 1 1 1 0,35
4s,4p 1 1 0,85 0,85 0,35
4d 1 1 1 1 1 0,35
4f 1 1 1 1 1 1 0,35
5s,5p 1 1 1 1 0,85 0,85 0,85 0,35
x 0,72 0,74 0.76 x 20.52 0.55 0.58
quotesdbs_dbs35.pdfusesText_40[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale
[PDF] morphologie des insectes pdf
[PDF] classification des insectes pdf
[PDF] biologie des insectes pdf
[PDF] cours dentomologie générale pdf
[PDF] systématique des insectes pdf
