 Corrigé
Corrigé
1 janv. 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après ...
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Energie de première ionisation Ei: Ag →Ag++ e-. Ei= EAg+- EAg b e) Montrer que
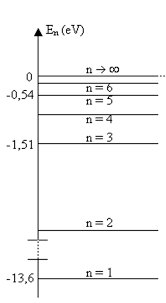 Hydrogénoı̈des et méthode de Slater
Hydrogénoı̈des et méthode de Slater
Il s'agit toujours d'un cation. Formule générale des hydrogénoïdes : Z X(Z-1)+ Énergie d'ionisation des hydrogénoïdes. La réaction de première ionisation d ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées. (On ne
 TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
b) L'énergie de première ionisation du cuivre est de 7724 eV. Calculer en utilisant la méthode de Slater
 Lélément Cobalt
Lélément Cobalt
II-4) Dans le cadre de la méthode de Slater poser le calcul pour déterminer l'énergie de première ionisation de l'atome de cobalt en fonction des charges
 Question 1 : [38] La première partie était tirée aléatoirement. Vous
Question 1 : [38] La première partie était tirée aléatoirement. Vous
énergie (en eV) de première ionisation du sodium selon. Slater ? [2]. 7.3. Le dication sodium Na2+. 15. Donner la configuration électronique à l'état ...
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
fonction de l'énergie de chaque énergies de 1ère et de 2ème ionisation du calcium. Ei1= ECa+ - ECa = E'4s - 2E4s. Ei
 I ATOMISTIQUE
I ATOMISTIQUE
énergie de 1ère ionisation de l'atome de chlore. L' énergie orbitalaire ... Déterminer par un calcul simple les molécules qui à coup sûr sont paramagnétiques ...
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
9) En utilisant le modèle de Slater calculer les deux premières énergies d'ionisation de l'atome de. Potassium et comparer aux valeurs expérimentales. K Z =
 Applied spectroscopy
Applied spectroscopy
maintenant l'énergie de. Les calculs effectués dans ce chapitre repré- ... Finalement on remarque que l'énergie de première ionisation tend rapide-.
 CCP Chimie 1 PC 2012 — Corrigé
CCP Chimie 1 PC 2012 — Corrigé
La première partie touche à la chimie générale et étudie en particulier l'élé- 1.2.3 Dans le modèle de Slater l'énergie de première ionisation ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées.
 Corrigé
Corrigé
Jan 1 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
e) Montrer que dans l'approximation de Slater
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
a/ Ecrire les équations de première et de seconde ionisation du calcium. e/ Calculer ces énergies d'ionisation sachant que l'énergie d'un électron 4s ...
 Atomes et molécules
Atomes et molécules
5) Définir pour un atome X
 Calculatrices interdites Loxygène
Calculatrices interdites Loxygène
Jan 1 2002 (Pour les calculs
 Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
4- En déduire l'énergie de première ionisation et l'affinité électronique de l'atome d'azote. 5- Que peut-on en conclure quant à la stabilité de N- par rapport
 CORRIGE
CORRIGE
première ionisation anormalement élevée par comparaison avec l'énergie calculée dans le modèle de Slater. Lequel ? Réponse A : Bore ( Z = 5).
 Corrigés du chapitre 4 - EPFL
Corrigés du chapitre 4 - EPFL
l’énergie de électron dans l’orbitale 3s E n = 13:6 2:202 32 = 7:31 eV Pour ioniser Na en Na+ et donc détacher l’électron le plus externe de Na il faut fournir 7 31 eV Bien qu’approxi-matif ce calcul donne un résultat assez proche de la mesure expérimentale 5 14 eV Exercice 4 2
 Hydrogéno??des et méthode de Slater - sorbonne-universitefr
Hydrogéno??des et méthode de Slater - sorbonne-universitefr
L’énergie de l’électron d‘un hydrogénoïde est donnée par l’expression : ' á( A 8) = ? 13 6 < 6 J 6 où n est le nombre quantique principal (entier positif non nul) qui désigne le numéro de la couche -19 J Énergie d’ionisation des hydrogénoïdes La réaction de première ionisation d’un hydrogénoïde s'écrit : X (Z -1
 ENQERGIE D’IONISATION
ENQERGIE D’IONISATION
La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié Ar Ar+ + e E i1 = 1576 ev La deuxième énergie d’ionisation nous permet d’arracher un deuxième électron Ar+ Ar++ + e E i2 = 2763 eV E i2 › E i1
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
C-2) Evaluer par différence l'énergie de première ionisation du bérylium EI = EBe+ - EBe = -39035 - -39822= 787 eV D) Energie de deuxième ionisation: Be+ = Be2+ + e-En utilisant la même démarche évaluer l'énergie de deuxième ionisation du bérylium EI2 = EBe2+ - EBe+ Be2+: 1s2 Z*1s = 4 – 03 = 37 E1s = -136 * 372 / 1 = -18618 eV
 Searches related to énergie de première ionisation calcul PDF
Searches related to énergie de première ionisation calcul PDF
II-6) L'énergie de première ionisation du fer est E i = 79 eV L'atome initialement dans son état fondamental est ionisé par un photon d'énergie E p = 10 eV a) Calculer l'énergie cinétique de l'électron éjecté b) Quelle serait l'énergie cinétique de l'électron éjecté si l'atome avait été préalablement préparé dans son
Comment calculer la première énergie d’ionisation ?
Cl est donc plus proche de la taille du cation K+. Sans chercher les valeurs numériques, classez les atomes suivants par ordre croissant de leur première énergie de ionisation : Se, Sr, Te, F,Br et Cs. Les tendances pour les premières énergies d’ionisations sont l’inverse des tendances pour les rayons atomiques(excercice 4.2).
Comment calculer l'énergie de deuxième ionisation ?
L'énergie de deuxième ionisation sera donc beaucoup plus élevée que l'énergie de première ionisation. 9) En utilisant le modèle de Slater, calculer les deux premières énergies d’ionisation de l’atome de Potassium et comparer aux valeurs expérimentales.
Quelle est la première énergie d’ionisation d’un atome?
Tout atome est caractérisé par plusieurs énergies d’ionisation. Exemple l’atome d’Argon (Z = 18) La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié. Ar Ar+ + e Ei1= 15,76 ev.
Comment calculer l’énergie d’ionisation de Na en Na+ ?
[eV], calculer l’énergie d’ionisation de Na en Na+. La con?guration électronique de Na est [Ne]3s1, que l’on peut expliciter en 1s22s22p63s1. La première énergie deionisation (pour obtenir Na+) correspond à l’énergie de l’électron le plus externe, ici celui qui occupe l’orbitale3s. Pour l’obtenir, on calculeZef f=Z Spour cet électron.
C o u r s d e c h i m i e m é d e c i n e 2 0 1 5-2 0 1 6 . P r . L E G S E I R B e l g a c e m| 1
ENQ :énergie d'ionisation d'un atome est l'énergie qu'il faut fournir à un atome neutre pour arracher
un électron (le moins lié) à l'état gazeux et former un ion positif. On la note Ei. er le premier électron le moins lié.Ar Ar+ + e Ei1= 15,76 ev.
Ar+ Ar++ + e Ei2 = 27,63 eV.
Ei2 i1
1re : 15,759610 eV 2e : 27,62966 eV
3e : 40,74 eV 4e : 59,81 eV
5e : 75,02 eV 6e : 91,009 eV
7e : 124,323 eV 8e : 143,460 eV
9e : 422,45 eV 10e : 478,69 eV
11e : 538,96 eV 12e : 618,26 eV
13e : 686,10 eV 14e : 755,74 eV
15e : 854,77 eV 16e : 918,03 eV
17e : 4 120,8857 eV 18e : 4 426,2296 eV
Ei8 = 143,46 ev Ei9 = 422,45 ev
Ei16 = 918,03 ev Ei17 = 4120.8 ev un
trois groupes qui contiennent 8, 8 et 2 électrons. le 9 ème électron qui est plus lié et occupe un niveau plus stable.Le deuxième saut est expliqué pareillement
enlève le 17 ème électron qui nécessite une énergie plus importante (4120 ev) c'est-à-dire que les deux
électrons 17ème et 18ème occupe un niveau plus stable.M (8) 3p
3sL (8) 2p
2sK (2) 1s
C o u r s d e c h i m i e m é d e c i n e 2 0 1 5-2 0 1 6 . P r . L E G S E I R B e l g a c e m| 2
Structure électronique des atomes poly-électroniques : -électronique est la façon dont ses Z électrons sont distribués entre les couches et les sous-couches.Règle de Klechkowsky :
donc une stabilité maximale. gie des orbitales dépend de n et l c'est-à- subdivise en sous niveaux énergétiques -couches est donné par la règle de Klechkowsky cet ordre est le suivant : 1s2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s1s, 2s, 2p, 3s, 3p, 4s-3d, 4p, 5s-4d,
(n + l). Si deux niveaux ont la même valeur de (n +l) le niveau le plus stable est celui qui possède n petit.Exp 4s (n = 4, l = 0, n +l = 4)
niveau 3d (n = 3, l=2, n +l = 5) niveau 3p (n = 3, l = 1, n +l = 4) Donc on remplit 4s avant 3d, et on remplit 3p avant 4s. et 6s.Pauli :
Dans un atome, deux électrons ne peuvent avoir leurs quatre nombres quantiques identiques. Par exemple si
n, l et m sont les mêmes, on a et s =-Exemple : 1s2 on a deux électrons dans la couche n = 1. La sous couche est s donc l=0 et m = 0 pour
chaque électron donc le nombre de spin ces deux électrons ont de nombres de spin différents1er électron : n=1, l=0, m=0, s=+1/2 2ème électron : n=1, l=0, m=0, s=-1/2
Règle de Hund :
Dans la même sous-couche, les électrons occupent le (cases quantiques) avec des spins de même sens. Exemple : 7N : 1s22s22p3 Faire les cases quantiques.8O : 1s22s22p4 Faire les cases quantiques
Remarque 2n2.
Couche de valence :
Les électrons de la couche dont le nombre n est le plus grand jouent le rôle principal dans les réactions
chimiques. Et en particulier à la formation des liaisons chimiques entre les atomes, on appelle cette couche :
couche externe périphérique où encore couche de valence. Exemple : 3Li : 1s² 2s1 couche de valence 2 valence 16C : 1s² 2s² 2p2 Couche de valence n=2 valence 4
C o u r s d e c h i m i e m é d e c i n e 2 0 1 5-2 0 1 6 . P r . L E G S E I R B e l g a c e m| 3
LA CLASSIFICATION PERIODIQUE DES ELEMENTS
I- Description du tableau périodique de MENDELIEFFclassification périodique, à dire la répartition des lignes (ou périodes) et colonnes (ou groupes) des
éléments.
1- Les lignes ou périodes :
La ligne ou période correspond à une couche électronique identifiée par son nombre quantique principal
noté n. périodique standard numérotées de 1 à 7.2- Les colonnes ou groupes
8 en sous-groupe A et 10 en sous-groupe B.1- Sous-groupe A : Les 8 familles
sont dites principales numérotées de IA jusqu'à VIIIA. Et représentées par 2 blocsS et P.
2- Sous-groupe B : Familles situées
entre IIA et IIIA. Représentées par le bloc d (éléments de transition).C o u r s d e c h i m i e m é d e c i n e 2 0 1 5-2 0 1 6 . P r . L E G S E I R B e l g a c e m| 4
Les éléments de la même famille ont le même nombrevalence. Le numéro de la famille, correspond auUn élément appartient à la famille A si ses électrons de valence sont repartis dans la sous couche (n S) et (n
S n P).
Un élément appartient à la famille B si ses électrons de valence sont repartis dans la couche n S (n-1) d.
Exemple : 1H 1s1 2He 1s2
11Na 1s2 2s2 2p6 3s1 = [ Ne] 3s1 18Ar 1s2 2s2 2p6 3s2 3p6
Groupe A : les électrons de valence sont des électrons S ou P.Structure nS nP
Groupe ou Famille IA IIA IIIA IVA VA VIA VIIA VIIIAConfiguration électronique de la
couche de valence ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5 ns2np61 2 3 4 5 6 7 8
3Li 12Mg 13Al 6C 7N 8O 9F 10Ne
Les éléments du Bloc d ayant la sous couche d non saturée sont appelés les métaux de transition.
Les éléments du groupe IB (colonne 11) possèdent la même configuration électronique :29Cu: [18Ar]3d104s1 47Ag: [36Kr]4d105s1 79Au: [54Xe]: 4f145d106s1
Au lieu de ns2(n-1) d9 pour avoir la sous couche d pleine qui est plus stable.On obtient un tableau de 18 colonnes et 7 lignes.
IA IIA IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB IIIA IVA VA IVA VIIA VIIIIALe 24Cr selon KLECKOWSKY : 1s22s22p63s23p64s23d4 un électron de là sous couche 4s passe à là sous
structure est : 1s22s22p63s23p64s13d5Exemples :
1- groupe IIA et à la période 5.
2-3- 4 éléments du tableau périodique A ; B ; C et D.
-Les deux éléments A et B appartiennent au groupe de Potassium (19K). -Les deux éléments C et D appartiennent au groupe de Brome (9F). -Les deux éléments A et C appartiennent à la période Du Phosphore (15P). -Les deux éléments B et D appartiennent à la période du Zirconium (40Zr). Trouver le numéro atomique Z de chaque élément.quotesdbs_dbs10.pdfusesText_16[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale
[PDF] morphologie des insectes pdf
[PDF] classification des insectes pdf
[PDF] biologie des insectes pdf
[PDF] cours dentomologie générale pdf
[PDF] systématique des insectes pdf
