 Corrigé
Corrigé
1 janv. 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après ...
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Energie de première ionisation Ei: Ag →Ag++ e-. Ei= EAg+- EAg b e) Montrer que
 Hydrogénoı̈des et méthode de Slater
Hydrogénoı̈des et méthode de Slater
Il s'agit toujours d'un cation. Formule générale des hydrogénoïdes : Z X(Z-1)+ Énergie d'ionisation des hydrogénoïdes. La réaction de première ionisation d ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées. (On ne
 TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
TD1– Atomistique – Orbitales– Méthodes de Slater – Energie d
b) L'énergie de première ionisation du cuivre est de 7724 eV. Calculer en utilisant la méthode de Slater
 Lélément Cobalt
Lélément Cobalt
II-4) Dans le cadre de la méthode de Slater poser le calcul pour déterminer l'énergie de première ionisation de l'atome de cobalt en fonction des charges
 Question 1 : [38] La première partie était tirée aléatoirement. Vous
Question 1 : [38] La première partie était tirée aléatoirement. Vous
énergie (en eV) de première ionisation du sodium selon. Slater ? [2]. 7.3. Le dication sodium Na2+. 15. Donner la configuration électronique à l'état ...
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
fonction de l'énergie de chaque énergies de 1ère et de 2ème ionisation du calcium. Ei1= ECa+ - ECa = E'4s - 2E4s. Ei
 I ATOMISTIQUE
I ATOMISTIQUE
énergie de 1ère ionisation de l'atome de chlore. L' énergie orbitalaire ... Déterminer par un calcul simple les molécules qui à coup sûr sont paramagnétiques ...
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de
9) En utilisant le modèle de Slater calculer les deux premières énergies d'ionisation de l'atome de. Potassium et comparer aux valeurs expérimentales. K Z =
 Applied spectroscopy
Applied spectroscopy
maintenant l'énergie de. Les calculs effectués dans ce chapitre repré- ... Finalement on remarque que l'énergie de première ionisation tend rapide-.
 CCP Chimie 1 PC 2012 — Corrigé
CCP Chimie 1 PC 2012 — Corrigé
La première partie touche à la chimie générale et étudie en particulier l'élé- 1.2.3 Dans le modèle de Slater l'énergie de première ionisation ...
 Lélément Cobalt
Lélément Cobalt
II-4) Poser le calcul pour estimer l'énergie de première ionisation de l'atome de fer en fonction des charges effectives des espèces concernées.
 Corrigé
Corrigé
Jan 1 2003 4) Définir l'énergie de première ionisation d'un élément. En utilisant le modèle de Slater et le tableau des coefficients donné ci-après
 Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
Université Pierre et Marie Curie Session de Juin 2001 DEUG MIAS
e) Montrer que dans l'approximation de Slater
 Université Pierre et Marie Curie
Université Pierre et Marie Curie
a/ Ecrire les équations de première et de seconde ionisation du calcium. e/ Calculer ces énergies d'ionisation sachant que l'énergie d'un électron 4s ...
 Atomes et molécules
Atomes et molécules
5) Définir pour un atome X
 Calculatrices interdites Loxygène
Calculatrices interdites Loxygène
Jan 1 2002 (Pour les calculs
 Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
Exercice III-10: Modèle de Slater et calcul des énergies de lazote et
4- En déduire l'énergie de première ionisation et l'affinité électronique de l'atome d'azote. 5- Que peut-on en conclure quant à la stabilité de N- par rapport
 CORRIGE
CORRIGE
première ionisation anormalement élevée par comparaison avec l'énergie calculée dans le modèle de Slater. Lequel ? Réponse A : Bore ( Z = 5).
 Corrigés du chapitre 4 - EPFL
Corrigés du chapitre 4 - EPFL
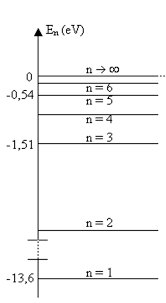
l’énergie de électron dans l’orbitale 3s E n = 13:6 2:202 32 = 7:31 eV Pour ioniser Na en Na+ et donc détacher l’électron le plus externe de Na il faut fournir 7 31 eV Bien qu’approxi-matif ce calcul donne un résultat assez proche de la mesure expérimentale 5 14 eV Exercice 4 2
 Hydrogéno??des et méthode de Slater - sorbonne-universitefr
Hydrogéno??des et méthode de Slater - sorbonne-universitefr
L’énergie de l’électron d‘un hydrogénoïde est donnée par l’expression : ' á( A 8) = ? 13 6 < 6 J 6 où n est le nombre quantique principal (entier positif non nul) qui désigne le numéro de la couche -19 J Énergie d’ionisation des hydrogénoïdes La réaction de première ionisation d’un hydrogénoïde s'écrit : X (Z -1
 ENQERGIE D’IONISATION
ENQERGIE D’IONISATION
La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié Ar Ar+ + e E i1 = 1576 ev La deuxième énergie d’ionisation nous permet d’arracher un deuxième électron Ar+ Ar++ + e E i2 = 2763 eV E i2 › E i1
 TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
TRAVAUX DIRIGES : « ATOMES ET MOLECULES » - Cours de Thierry
C-2) Evaluer par différence l'énergie de première ionisation du bérylium EI = EBe+ - EBe = -39035 - -39822= 787 eV D) Energie de deuxième ionisation: Be+ = Be2+ + e-En utilisant la même démarche évaluer l'énergie de deuxième ionisation du bérylium EI2 = EBe2+ - EBe+ Be2+: 1s2 Z*1s = 4 – 03 = 37 E1s = -136 * 372 / 1 = -18618 eV
 Searches related to énergie de première ionisation calcul PDF
Searches related to énergie de première ionisation calcul PDF
II-6) L'énergie de première ionisation du fer est E i = 79 eV L'atome initialement dans son état fondamental est ionisé par un photon d'énergie E p = 10 eV a) Calculer l'énergie cinétique de l'électron éjecté b) Quelle serait l'énergie cinétique de l'électron éjecté si l'atome avait été préalablement préparé dans son
Comment calculer la première énergie d’ionisation ?
Cl est donc plus proche de la taille du cation K+. Sans chercher les valeurs numériques, classez les atomes suivants par ordre croissant de leur première énergie de ionisation : Se, Sr, Te, F,Br et Cs. Les tendances pour les premières énergies d’ionisations sont l’inverse des tendances pour les rayons atomiques(excercice 4.2).
Comment calculer l'énergie de deuxième ionisation ?
L'énergie de deuxième ionisation sera donc beaucoup plus élevée que l'énergie de première ionisation. 9) En utilisant le modèle de Slater, calculer les deux premières énergies d’ionisation de l’atome de Potassium et comparer aux valeurs expérimentales.
Quelle est la première énergie d’ionisation d’un atome?
Tout atome est caractérisé par plusieurs énergies d’ionisation. Exemple l’atome d’Argon (Z = 18) La première énergie d’ionisation est l’énergie nécessaire pour arracher le premier électron le moins lié. Ar Ar+ + e Ei1= 15,76 ev.
Comment calculer l’énergie d’ionisation de Na en Na+ ?
[eV], calculer l’énergie d’ionisation de Na en Na+. La con?guration électronique de Na est [Ne]3s1, que l’on peut expliciter en 1s22s22p63s1. La première énergie deionisation (pour obtenir Na+) correspond à l’énergie de l’électron le plus externe, ici celui qui occupe l’orbitale3s. Pour l’obtenir, on calculeZef f=Z Spour cet électron.
S!""#$%&
!Introduction" #Discussiondelastructureénergét ique$ %Hamiltonien& 'Particulesindiscernables!( !Fonctiond'onde!( #Leprin ciped'exclusiondePauli!% "Niveauxd'énergiesselonla théoriedesperturbations!" !!éoriedesperturbat ions !" #L'étatfondamenta l:!s %Étatsexcités:con )guration:!s-#s!* $Niveauxd'énergieselonla méthodevariationnelle## !Con)guration!s #Étatsexcités:con )guration!s#s#' &Laboratoire#* !Objectifs#* #Instrumentation#* %Mesuresaulaborat oire#+ 'Analyseexpérimentale%( pasdedi cultésimportantes,c arnoussavonscommenttraiterdefaçonrigo u- reuselenombrea tomiq ueZetles corr ectionsrelativistes,dumoinslors queZ n'estpastrèsg rand.C'estl arépulsioncou lombienneentrelesélect ronsquipré- senteunedi cultéconsidérable,car celle-cidépenddelapositionrespe ctive deséle ctrons,quicontrairementaunoyau, sedéplacent constamment.Ainsi, rontcorrélés. même,desatomesp lus complexesquicomposentlet ableaupériodique. #)$/+*//$!')&,#/(%*+(*%&.'&% 0.( $1*& del' atomed'hélium.Àcete et,la gure!.!présentelapositiondesnivea ux énergétiquesdéterminésexpérimentalem ent.Cettediscussio npermettrad'in- laméca niquequantiquedanslasuit edecechapitre. Lepremierp hénomèneimpo rtantquelesdonnéesdela gure!.!révèlent estquelesdeux électro nsin terag issentfortement,carl'énergiedep remièreio- nisationdel'atomed'h élium danssonétatfondamental !s estbeauco upplus sioncoulom bienneconsidérable.Pourévaluerl'imp ortancedecete et,con si- déronsunmomentlesdeux élec tronsindépendants.Da nsce cas, l'atomed'hé- liumestré duitàuna tomehydrogénoïdeet l'én ergiedeliaisondechaqueélec- tronseraitde!ZRy=!'Ry.
Ainsi,l'énergiede premièreionisationseraitde!.Un Rydberg (Ry)équivautà!%.$($eV.eVpourdeux électronsin dépend ants.Comparonsmaintenantl'én ergiedeLescalcu lse-ectuésdanscecha pitrerepré-
senterontlaplupartdutemps l'énerg ienéces- tenirl'éner gienécessairepourioniserq u'un seuldesdeuxélect ro ns,i lsu rad' ajouter l'énergied'ionisationdel'électron sdel'atome He quiestdeZRy="'.'#eVselon lemo-
dèledel'a to mehydrogénoïde premièreionisation calculée( eV)aveccel leobtenueexpériment alement.Lesdonnées dela
gure!.!révèlentquel'énergied'ioni sationm esuréepourla con guration !s estde eV.Ladi del' atomed'héliumdevraobligatoir ementinclureuntermederépu lsioncou- Étantdonnéquelarép ulsiondépenddel aposition relati vedesélectronsetque ceux-cise déplacentcon stamment,ilestdi cilederigo ureu sementtraiterles atomesmultiélectro niques. liumdans unecon gurationoùlesélect ronssera ientt ousdeuxdansdesétats excités.Ene et,lor squedeuxélectronsso ntex citéssimultanément,l'énergie dusystème esttellequ'unéle ctrones tautomatiquemen téjecté,produi santun ionHe .Ain si,lorsdutrait ementdesétatséner gétiquesdel 'atomed'hélium neutre ,leni vea ufondamental !sesttou joursoccupéparaumoinsunéle c-#.He Icorresp ond àl'héliumneutreetHeIIà He tron. Lacon !snlindi- quantqu'unélectronestdansl'orbitale avoirconstaté ci-dessusquelemodèlehydrogénoïder eproduittrèsmall'éner- giedespremier sniv eauxdel'atome d'hélium,ilpeutsembler cur ieuxd'utiliser pitre,nousutilisons toutdemêmecesfo nctionsd'ondepourlesdeuxraisons suivantes: n d'obtenirlesfonctionsd'o ndes tationnairesspéci quesàcel ui-ciet )lesf onc- tionsd'ondehydr ogénoïdess ont,commenousleco nstaterons, uneapproxima- tionraisonn ableet,surtout,unexcellentpointdedépar tp ourlesméthodes d'approximationquenousallonsutiliser.Nota mment,lam éthodevariation- nelle(section!.$)ré vèlequelesformesmath ématiquesdes fo nctionsd'onde hydrogénoïdesdé criventrelativementbienles fonctionsd'ondedel'atomehé- liumetqu 'il nesu radem odi erque quelquespa ramètrespouramé liorersi- gni cativementl'accordentrelesrésult atsthéoriquesetexpériment aux.Ainsi, nousutiliseron slesnombresquantiquesassociésàl'ato med 'hydrogènepour décrirelesétatsdesdeuxé lect ronsdel'at ome hé lium(n ,l ,m ,m s,! etn ,l m ,m s,# L'atomed'héliumestcomposé dedeuxélectronsidentiquesdontles fonc- tionsd'ondese chevauchent:ilsson tdoncindi scernables.L'indiscernabilitéaf- fectesigni ilseratra itéendét aildanscechapitr e,t ouslesétatsexcités del'atomed'hé lium serontcomposésdedeuxniv eaux:unétatsinguletLdontlasomm edesspins
estS=(etunét att ripletLdontlasomm edesspins estS=!.En semble,la
répulsioncoulombienneetl'in discernabilitédesélectronspr odui sentcequ'on appellel'interactiond'échange .Sanséquivalentclassique,cetteinteractionlève%.At tention,ilnes'agitpasd' uneinteract ion supplémentairequenousavionsjusqu'àp ré- lombienneetduprinciped 'indi scernab ilité ladégénéres cencedesniveauxexcités.Elleest maxima lepourlacon guration !s#setdimin ueavecletn,ca rsonimport anceestprop ortionnelleauchevau- chementdesfonctionsd 'on dedesdeuxélectrons. Finalement,onremarqueq uel'énerg iedepremièreionisationtendra pide- Cete etest reliéàl' écrantagep art ieldelachargenucléaire(Z=+ )pa rl'élec- tron !sproduisant,selonlethéorèmedeGauss, unechargee-ectivenucléaire réduite, !HeliumH
Fig.3.4Theenerg ylevelsofthehelium atomwiththoseofhyd rogenf orcompar ison.The1s 2 groundconfiguration istightlybound.Fortheexc itedconfig urationso fheliumthe1s-electro nscreenstheouterelectronfromthenuclear charge sothatthe
1snlconfigurationsinheliumhavesimilarenergy tothes hellwithprincipalq uantumnumbe rninhy drogen.Thehydrogenic
levelsareindicated ontherig ht.Theintervalbetweenthe 1 Land 3 Lte rms(equaltotwic etheexchangeintegr al)is clearfor the1s 2s,1s2p,1s3s,1s3p and1s4sconfigurations butitissmall erforhi ghernandl.F$0*%&!.!:Éner giesdepremièreionisa tion
del' atomed'hélium.Lesniveauxson tsépa- résencolonn ess elonlemomentangu laire totalLetle mom entangulairedespinto tal S.Les étatssingu letssontreprés entésparles termesspectrauxLetlesét atst ripletspar
lester mesL.Àdes )nsdecomp arai son,les
niveauxénergétiquesdel' atomed'hydrogène sontaussireprés entés.Figurereproduit edeAtomicphysicsdeC.J.Footsansenavoir,pour
lemo ment,l'autorisat ion.DescriptionTerme
Énergiecinétique(i=!,#)H
k #m e iAttractionnoyau-électron(i=!,#)H
e!n Ze r iRépulsionélectron-électr onH
e!e e rInteractionspin-orbite(i=!,#)H
so l i s i m e c r i dV dr iInteractionspin-spinH
s!sInteractionorbite-orbiteH
o!o =cL i #L jInteractionhyper
ne(i=!,#)H hf g p e m e m p %(I"ˆr i )(S"ˆr i )!I"S r i g p e m e m pI#S#(r)
DécalagedeLamb(i=!,#)H
Lamb Masse niedu noyau(Z= )m e #m e (m p +m n m e +#(m p +m n électrons,nousneconsidéreronsqueles troispremierster meset,même pour ceca ssimpli é,ilsera nécessair ederecour iràdesméthodesd'approximation. Pourunatom ecom poséd'unnoyaudechar geZetde deuxéle ctr ons,l'ha- miltoniens'écrira, H(r ,r )=H +H +H e,e oùlesdeuxpr emierst ermes représententresp ectivementl'éner giecinétiqueet l'énergied'attractionélec tron-noyaudesélectrons et etoù letroi sièmet erme quenous tenteronsderésoudr eestlesuivant, H(r ,r #m Ze r #m Ze r e #r !r oùr i estlevec teur représentantlapositio ndel'électronietoù lelaplacien " i n'agitquesurl'électro ni. .En coor donnéessphériques,lelaplacienest i "r i r i "r i r cos$ i sin$ i i r i i r i sin i i sionestpr oblémat iquepourdeuxraisons: )il exclutt outesolutionana lytique riqueset important,doncilestdi ciledelenég ligero udele considérerpetitdevan tles autrestermesdel'ha miltonien. Nousallonsuti liserdeuxtechniquesd'app roximationa ndedét erminer les niveauxénergétiquesdel' atomed'hélium.Àlasect ion!.",no usverronsque lathéo riedesperturbationsdonnedebo nsr ésultats,surtoutsionconsidère l'amplitudedelaperturbationcompara ti vementaux principauxtermesdel'ha- d'excellentsrésultatsetferaress ortir,parl'intermédiairedes para mètresvar ia- tionnels,unemeilleurecompr éhensiondes e etsre liésàl'interact iondes deuxélectrons.
Avantderésoudrel' hami ltonienprésentéàl'é quation!.!,il estd'ab ordné- profondesdel'indiscernabilité deséle ctronssurlafonctiond'ondeetsurlesni- veauxd'énergiede l'atomehélium. '2#%($+*,&/$')$/+&%'#3,&/ Deuxélect ronsliésàunnoyausontindiscernables lors que: )il ssontiden- spin)et )leurs fonctio nsd'ondesechevauchent.Lorsqu 'indiscernables,ilest etd'unepermutation desdeuxé lect rons. Nousallonsdon cdansunpremiertempsdisc uterducrit èred'invariance quedoiven trespecterlesfonctio nsd'ondesdécrivantlesparticu lesindi scer- nables.Cettediscu ssionestnécessair epourletraitementdel'atome d'hélium, maisellen'estpasspéci siquecompos édeparticulesindiscerna bles. A ndefa ireun traitementgén éral decetin discer nabilité,nousallonsconsidérerdeuxparticulesquineso ntpas nécessairementdesélectrons. !4!'+($!')'!')& Lorsqu'iln'yaaucuncouplageentre lapositiond 'une particuleets onspin, .Ce quiestlecaspourl'atomed'héliumetun bonnombr edesystèmesphysiques. lafonc tiond'ondetotaled'uneparticules 'exprimeparleproduitdedeuxfon c- tionsd'onde, j (r,S)=# j (r)'(S). Lapremièr edépenddescoordonnées spatiales,r,etl adeuxième dépenddu spin,S.Ici ,jspéci)eleo ulesn ombresq ua ntiquesassociésàlaparties patiale. Nousallonsmain tenantconsidérerlasymét riedepermutationdelafonction allonsconsidérerlesdeuxpar tiedelafonction d'o nde séparément.4!'+($!')'!')&/2#( $#,&
identiquesetsansinterac tionestlepro duit desfonctionsd'ondespa tia lesdes deuxpa rticulesindépendantes, j,k (r ,r j (r k (r Pourdesparticulesindis-$.Si lespartic ulesin teragissent,# j,k (rquotesdbs_dbs35.pdfusesText_40[PDF] la morphologie en linguistique
[PDF] énergie d'ionisation calcul
[PDF] morphologie flexionnelle et dérivationnelle
[PDF] morphologie des mots exercices
[PDF] cours de morphologie linguistique pdf
[PDF] analyse morphologique des mots exercices
[PDF] fin de l'ancien régime
[PDF] morphologie flexionnelle et dérivationnelle pdf
[PDF] la morphologie lexicale
[PDF] morphologie des insectes pdf
[PDF] classification des insectes pdf
[PDF] biologie des insectes pdf
[PDF] cours dentomologie générale pdf
[PDF] systématique des insectes pdf
