 Les CULTURES in vitro VEGETALES
Les CULTURES in vitro VEGETALES
biotechnologies.education page 2. DES PROPRIETES : A savoir ! Les techniques de culture in vitro végétales utilisent la propriété de totipotence des cellules.
 Cours Biotechnologie végétale 2016-2017
Cours Biotechnologie végétale 2016-2017
cellulaire imposée par la culture in vitro. Page 17. Totipotence: aptitude de la cellule Comparaison culture in vitro / culture in situ. Culture in vitro ...
 Cours biotechnologies végétales
Cours biotechnologies végétales
30 déc. 2022 utilisé largement en culture in vitro. 1964 Guha et Maheshwari ... Capacité des cellules végétales cultivées in vitro de générer des embryons.
 Cours 1: Bases biologiques des cultures in vitro
Cours 1: Bases biologiques des cultures in vitro
Module: Biotechnologies et culture des tissus végétaux. Page 2. 1. généralités cellules végétales par Haberland. Un tissu végétal est capable de régénérer ...
 Cours de Biotechnologies L3 BPV Dr. CHAIB Ghania
Cours de Biotechnologies L3 BPV Dr. CHAIB Ghania
- la découverte de la totipotence des cellules végétales à la base des multiples technologies de culture in vitro : culture de méristèmes
 cours L3 biotechnologie végétale
cours L3 biotechnologie végétale
Les techniques de culture in vitro végétales utilisent la propriété de totipotence des cellules végétales mise en évidence en 1902 par Haberlandt. en
 Présentation PowerPoint
Présentation PowerPoint
BIOTECHNOLOGIE VEGETALE. Culture in vitro de cellules végétales. OBJECTIF. Générer de la biomasse végétale en cultivant des cellules de plantes. POLYPHENOLS
 LExpression de la variabilité biochimique induite dans les cultures
LExpression de la variabilité biochimique induite dans les cultures
une exploitation biotechnologique des cellules végétales : In Production de substances naturelles par culture in vitro de tissus et de cellules de végétaux.
 Parcours de la mention Biotechnologies
Parcours de la mention Biotechnologies
Séance de TP : Culture in vitro des cellules rétiniennes de l'œil de bœuf. 5 Approches biotechnologiques : cultures des cellules végétales. Page 239. 239.
 La biotechnologie de la cellule végétale : un enjeu industriel davenir
La biotechnologie de la cellule végétale : un enjeu industriel davenir
cellules végétales cultivées in vitro. Les connaissances dans ce domaine sont en qu'en France
 [PDF] Cours Biotechnologie vegetale 2016-2017pdf
[PDF] Cours Biotechnologie vegetale 2016-2017pdf
VEGETALE CULTURE IN VITRO (Cours : module biotechnologies végétales Module M Module M 33 Pr Guédira ) ?Utilisation des cellules végétales
 [PDF] Cours 1: Bases biologiques des cultures in vitro
[PDF] Cours 1: Bases biologiques des cultures in vitro
Module: Biotechnologies et culture des tissus végétaux Les biotechnologies végétales sont des cellule * protoplaste 3 La Culture in vitro
 [PDF] Culture in vitro des Végétaux
[PDF] Culture in vitro des Végétaux
Pour cela il faut d'abord une prolifération cellulaire par mitose qui se réalise au niveau de tissus spécialisés : les méristèmes (= zone de prolifération
 [PDF] Introduction à la culture in vitro chez les végétaux
[PDF] Introduction à la culture in vitro chez les végétaux
Le but de la culture in vitro est de permettre la régénération de la plante entière autonome et fertile à partir de la propriété des cellules végétales : la
 [PDF] Culture in vitro
[PDF] Culture in vitro
Culture in vitro (micropropagation) L3 biotechnologie végétale explants (graines organes tissus cellules ou protoplastes) sur un milieu
 [PDF] LA CULTURE IN VITRO
[PDF] LA CULTURE IN VITRO
hormone végétale la seule connue à l'époque : l'auxine* En 1939 Gautheret obtient à partir de tissu carotte un amas de cellules dédifférenciées : un cal
 [PDF] Les biotechnologies végétales
[PDF] Les biotechnologies végétales
Les Biotechnologies végétales sont des technologies qui recouvrent toutes les Cette technique de culture in vitro est appelée sauvetage d'embryons
 [PDF] Application de la biotechnologie de la culture in vitro pour les
[PDF] Application de la biotechnologie de la culture in vitro pour les
La culture de tissus végétaux repose sur le fait que de nombreuses cellules végétales ont la capacité de régénérer une plante entière (totipotence) Des
 [PDF] Cours de Biotechnologies L3 BPV Dr CHAIB Ghania
[PDF] Cours de Biotechnologies L3 BPV Dr CHAIB Ghania
- la découverte de la totipotence des cellules végétales à la base des multiples technologies de culture in vitro : culture de méristèmes culture d'embryons
1Célia NOVELLO
Julien TAP
Maîtrise IUP SIAL 2005
Introduction à la culture in vitro
chez les végétauxIntroduction
Définition
La culture in vitro est basée sur la mise en culture d'explant en milieu artificielcontrôlé, à l'abri de toutes contaminations (en axenie). Le but de la culture in vitro est de
permettre la régénération de la plante entière autonome et fertile à partir de la propriété des
cellules végétales : la totipotenceLa totipotence est l'habilité d'une cellule à se différencier puis après de se développer
en un nouvel organisme à part. Les techniques de culture in vitro sont des outils quipermettent d'améliorer les plantes mais aussi d'assainir les variétés ou bien de réduire les
coûts de productions. Cependant bien d'autres applications sont possibles.Exemple d'applications
" Racines transformées de Crepis capillaries : un système sensible pour l'évaluation de la mutagenicité des agents abiotiques » par Jolanta JUDRIMINK et Jolanta MALUSZYNSKA.
Université de Silésie, Pologne, janvier 2005. 565(2):129-38. La présence d'un large nombre de polluant incluant les agents mutagéniques est un réel problème pour l'environnement. Cependant, grâce au développement des techniques de culture in vitro et des méthodes de transformations cellulaires ont permis d'utiliser des racinestransformées de Crepis capillaries pour l'évaluation cytogénétique des effets mutagènes des
agents abiotiques. Dans cet exemple d'application, la culture in vitro permet de créer rapidement deslignées de racines transformées et standardisées. D'autant plus que les racines transformées
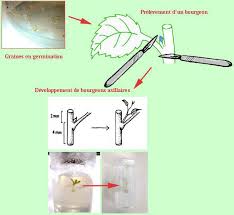
sont isogéniques. La conclusion de l'article propose, du fait de la bonne sensibilité de ces racines transformées, que cet outil biologique soit employé spécialement pour des échantillons d'eau ou bien des mixtures chimiques. 2 Principe et bases biologiques de la culture in vitro. Figure 1: influence des équilibres hormonales sur l'organogénèse Figure 2 : Schéma de la régénération d'une planteMatériel et méthodes
Matériel végétal
Pour les expériences réalisées, les organismes végétaux suivants ont été utilisés :
Le Saint-Paulia
Le tabac
Les pépins de pomme
La carotte
Nom commun de la
planteFamille Genre Espèce
Saint-Paulia Gesnéniacées Saintpaulia ionanthaLe tabac Solanacées Nicotiana tabacum
Les pépins de pomme Rosacées Pyrus malus
La carotte Apiacées Daucus carota spp sativusMatériel bactérien
Des souches d'Agrobacterium ont été utilisées pour l'expérience de " transgénèse active par
agrobactéries natives ». Différents types de souches ont été utilisées.Cytokinine Auxine
Caulogénèse,
Rhizogénèse
Callogénèse
Plante
donneuse Explant primaireCallogénèse
Caulogénèse +
phylogenèse Rhizogenèse Plante régénérée entière et fertileOrganogénèse
direct Or ganogénèse indirect 3Espèce Souche Plasmide Type
Agrobacterium Tumefaciens C 58 pTi Armée
Agrobacterium Tumefaciens C 58 C1 Ø DésarméeAgrobacterium Rhizogenes A4 pRi Armée
Milieux de culture
Les cultures réalisées à partir des explants prélevés ont été effectuées sur 3 milieux différents :
Le milieu " carotte » : Il s'agit d'un milieu pauvre puisqu'il est constitué d'eau du robinet et d'agar. Le milieu Murashige et Skoog est le milieu de base des deux autres milieux utilisés. Ce milieu contient des sels minéraux, des sucres, des vitamines B, des auxines et des cytokinines. Ce milieu rend possible la culture et la prolifération de méristèmes de tiges jusqu'alors réfractaires à la multiplication végétative in vitro. Le milieu MS-H : Il s'agit du milieu Murashige et Skoog sans hormones. Le milieu MS/4 : Il s'agit du milieu Murashige et Skoog contenant 4 fois plus de cytokinines que d'auxines. Tous les milieux doivent être stériles afin d'éviter toutes contaminations pouvant nuire aux manipulations.Méthodes
Les différentes expériences réalisées sont consignées dans le tableau récapitulatif suivant.
Expériences Matériel vivant Milieux
Effet de la composition du
milieu de culture Saint-PauliaTabac Carotte
MS-H MS/4Mise en évidence du transfert
hormonal Saint-PauliaTabac MS-H
Transgénèse active par
agrobactéries natives Carotte CarotteSauvetage d'embryon de
pommes Pépin de pomme MS-H " mou »Micropropagation par culture
de méristèmes Vitroplants de tabac MS-H 4Résultats et discussion
Toutes les observations ont été faites après 18 jours de mise en culture. Expérience 1 :Effet de la composition du milieu de cultureObservation
Pour le Saint Paulia nous avons pu observer :
Milieux Observations
Carotte Pas de multiplication cellulaire
MS-H Formation de boursouflures au niveau des sections préférentiellement et début de formation de poils absorbants. MS/4 Développement plus important de l'amas cellulaire et formation de protofeuilles Avec les limbes de Tabac, nous avons pu observer :Milieux Observations
Carotte Cal neigeux au niveau des nervures
MS-H Cal neigeux avec formation de protofeuilles
MS/4 Développement plus intense d'amas cellulaire avec un cal plus important et le début de formation du bourgeon axillaireInterprétation sur l'effet du milieu
Le milieu carotte est constitué d'eau du robinet et d'agar les cellules survivent donc grâce à leurs propres réserves car le milieu n'apporte pas les nutriments, ce qui explique l'absence de multiplication cellulaire pour le Saint Paulia et un léger développement pour le tabac mais seulement au niveau des nervures qui contiennent des hormones. Le possible développement d'un cal s'effectuera plus difficilement avec le milieu MS-H, car même si ce milieu apporte tous les nutriments nécessaires il n'est pas supplémenté en
hormones (dont auxine et cytokinine). Les cellules réagissent en fonction du contenu hormonal de leurs tissus pour se développer L'apparition d'amas de cellules montre qu'il y a multiplication cellulaire avec début de formation de poils absorbants. Ce développement est dû à la présence d'auxine dans la feuille. Pour le milieu MS/ 4 le développement plus intense et plus marqué est dû à la présence d'hormones dans le milieu, en l'occurrence la cytokinine qui permet d'induire la phyllogénèse et la caulogenèse. C'est pour cela que nous observons le développement de protofeuilles et de protobourgeons axillaires. Ce sont les éléments nutritifs qui ont permis l'impulsion du phénomène.Influence quantitative de l'orientation
Les deux plantes étudiées sont hypostomatées (les stomates se situent principalementau niveau abaxial). Les échanges sont donc facilités au niveau abaxial, par l'intermédiaire des
stomates mais aussi, car la cuticule est plus fine du coté abaxial que du coté adaxial.Conclusion
Cette expérience nous a permis de mettre évidence le caractère totipotent des cellulesvégétales, l'effet des différentes hormones et donc l'intérêt des unes par rapport aux autres.
5 Expérience 2 :Mise en évidence du transfert hormonalObservations
Observations
Coté biseauté
hors gélose Développement d'une chevelure racinaire puis apparition de feuillesCoté biseauté
dans la gélose Développement plus lentInterprétation
La formation d'une chevelure racinaire est le témoin du phénomène de rhizogénèse provoqué par l'accumulation d'auxine. Puis la formation de feuille marque par la suite lephénomène de phyllogénèse due à l'induction de la cytokinine synthétisée dans les racines
néoformées Lorsque le côté biseauté se situe dans la gélose il y a un manque d'oxygène ce qui explique le développement plus lent.Conclusion
Le flux d'auxine est donc polarisé de l'apex vers les racines et ce transport ne dépendpas de la gravité. A l'inverse la cytokinine est synthétisée au niveau des racines et va avoir un
flux ascendant pour induire la phyllogénèse. Expérience 3 : Transgénèse native par AgrobacteriumObservation
Observations
PI : verdissement du cambium et formation du cal au niveau de cambiumTemoin
PN : verdissement du cambium dans la gélose
PN : Formation d'un cal au niveau des points d'inoculation. C58 (armé) PI : Formation d'un cal plus important que le témoin et que PNC58 C1 Même observation que pour le témoin
A4 Même observation que pour le témoin
Interprétation
Au niveau du cambium (zone méristématique avec cellules indifférenciées) un cal est formé, ceci est dû au flux d'hormones. Les racines synthétisent et sont donc source decytokinine, de plus il y a un flux d'auxine vers le pôle inversé. L'accumulation d'auxine et la
présence de cytokinine à un équilibre entre les deux hormones, d'où le phénomène de
caulogenèse L'observation au niveau des points d'inoculation de phénomènes, de multiplicationcellulaire important, est dû aux agrobactéries qui ont transféré aux noyaux de la cellule
végétale la région T de leur plasmide pTi. Cette région T contient 2 groupes de gènes importants pour ce phénomène : Permet de synthétiser des opines (sources nutritives de la bactérie) Induit une surproduction hormonale conduisant à la formation d'une tumeur appelée galle.6Ceci confère une multiplication incontrôlée des cellules végétales, tout en favorisant la
multiplication d'agrobactérium.Pour C58C1 les agrobactéries sont désarmées, c'est à dire qu'elles ne possèdent pas de
plasmide ainsi il n'y a pas de régions T transféré et donc pas de production d'opine et de surproduction d'auxine. C'est donc bien le plasmide TI qui induit le transport d'information génétique. Pour A4, l'échec de la formation de racine montre qu'il y a eu un problème au niveaudu transfert génétique car le plasmide de la bactérie qui aurait dû par le transfert de sa région
T n'est pas exprimé. Il n'a donc pas impliqué la synthèse d'auxine et donc la formation anarchique de racine.Conclusion
Les hypothèses suivantes peuvent être émises : Problème au niveau de l'agrobactérie qui aurait perdu son plasmide Les signaux émis par la plante (monosaccharides et polyphénols) ne sont pas reconnus par la bactérie.Expérience 4 : Sauvetage d'embryon de pomme
Observations
Graine intacte pas de développement de plantule Graine sans tégument développement important de la plantule (feuille, tige et racine). Les cotylédons sont présents et ont verdint Embryon seul développement de la plantule moins rapide absence des cotylédons.Interprétation
Le non développement de plantule de la graine entière est dû à la présence dutégument. En effet, il induit la dormance chimique des graines par la présence de polyphénol
ce qui empêche la germination. En revanche, l'association entre l'embryon et les cotylédons a permis le développement de la plantule d'une part en raison de l'absence d'induction de dormante et d'autre part la présence des cotylédons qui sont une source d'énergie. La formation plus lente de l'embryon seul est due au fait que le milieu de culture se substitue aux cotylédons et nourrit l'embryon.Conclusion
L'embryon est capable de germer en milieu artificiel donc le sauvetage d'embryon fonctionne. Expérience 5 : Micropropagation par culture de méristèmesObservation
Le noeud et l'apex ont formé des plantules (feuilles, racines, tiges) avec un développement plus important pour le noeudInterprétation
En retirant la dominance apicale pour le noeud la dormance du bourgeon axillaire a été supprimée. Dans un premier temps, les bourgeons s'allongent accompagnés d'un phénomènede rhizogénèse. Il y a synthèse d'auxine de l'apex et des feuilles jeunes de l'apex vers la base
7de la tige car le flux de l'auxine est polarisé. Ceci induit la formation de racine adventive
formée à la base de la tige. Remarque : Lors de la contamination du milieu par un microorganisme, comme par exemple un champignon, on observe alors une compétition entre le champignon et la plante avec un envahissement plus important des champignons qui possèdent un cycle cellulaire plus court.Conclusion
La propriété de la propagation par culture de méristèmes permet la multiplication rapide du matériel végétal.Conclusion
Ce TP nous a permis de nous familiariser avec les bases des techniques de culture in vitro chez les végétaux. Nous avons pu observer en particulier l'importance des équilibres hormonaux dans lesprocessus d'organogénèse. L'étude des différents milieux de culture nous a permis d'étudier
la totipotence des cellules végétales notamment par l'observation de cals. La transgénèse par les agrobactéries natives nous ont permis d'étudier et d'approcher les méthodes et les outils de biotechnologie offrant un large potentiel pour l'avenir.quotesdbs_dbs25.pdfusesText_31[PDF] Biotechnologies - Espace Educatif - Rennes
[PDF] Biotechnologies de 4 génération
[PDF] Biotechnologies et ressources marines
[PDF] Biotechnologies Industrielles pour un Développement Durable - De L'Automobile Et Des Véhicules
[PDF] BIOTECON - dornier-ltf
[PDF] BIOTERRA INFOBLATT GÄRTNERN IM HOCHBEET
[PDF] Biothérapies et thérapies ciblées
[PDF] Biotherm eco - Dohse Aquaristik
[PDF] BIOTHERM Produits de soins pour le corps Déodorants Nettoyants - Anciens Et Réunions
[PDF] Biothers Vetocanis - Laboratoires VETOCANIS - France
[PDF] BIOTINE (vitamine H, B8)
[PDF] BIOTINE BAYER 5 mg, comprimé Encadré - Chirurgie
[PDF] Biotine Biotin - Anciens Et Réunions
[PDF] biotop 2014 - Ma Cave Fleury
