 TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction
Biologie – TP B13-14. Correction. TP B13-14. Enzymologie – Correction. I. Etude de la vitesse d'une enzyme en fonction du temps. 1. Loi de Beer-Lambert et la
 manuel des travaux pratiques enzymologie et biochimie
manuel des travaux pratiques enzymologie et biochimie
ENZYMOLOGIE ET BIOCHIMIE METABOLIQUE. (M21/SVI4). RESPONSABLE : Pr. Khalil HAMMANI - Connaître le contenu du cours et travaux dirigés en relation avec les TP.
 Corrig TP catalase de radis
Corrig TP catalase de radis
Corrigé TP catalase de radis. La catalase est une enzyme (hémoprotéine contenant 4 groupements hème). Dans les cellules elle se trouve dans les.
 Untitled
Untitled
Récapitulez les objectifs de ce TP: Séance du : 2/10/09. Etudier la cynétique de la B-galactosidase (enzyme) qui catalyse naturellement la reaction lactose
 TP Sciences de la Vie
TP Sciences de la Vie
› TP réalisables : Enzymologie loi de Beer-Lambert Compact
 TP 8 Détermination de lactivité spécifique dune enzyme.
TP 8 Détermination de lactivité spécifique dune enzyme.
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Détermination de l'activité spécifique d'une enzyme. Les objectifs de cette séance
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
Mise en situation et recherche à mener. Nous consommons différents glucides tels que l'amidon
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
Mise en situation et recherche à mener. Nous consommons différents glucides tels que l'amidon
 TP B14. Enzymologie III. Etude de linfluence du pH sur la cinétique
TP B14. Enzymologie III. Etude de linfluence du pH sur la cinétique
Biologie – TP B13-14. Enzymologie - Correction. TP B14. Enzymologie. Eléments de correction. III. Etude de l'influence du pH sur la cinétique enzymatique. 1
 TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction. I. Etude de la vitesse d'une enzyme en fonction du temps. 1. Loi de Beer-Lambert et la mesure de l'absorbance.
 Enzymologie TP 1
Enzymologie TP 1
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Etude cinétique de la Béta galactosidase. Les objectifs de cette séance :.
 Extraction et Eude cinétique de linvertase
Extraction et Eude cinétique de linvertase
Module : ENZYMOLOGIE ET METABOLISME. Travaux Pratiques T. P.. 3.2. Préparation de la gamme étalon pour le dosage des sucres réducteurs.
 Corrigé TD Biologie Nutrition-alimentation Technologies et
Corrigé TD Biologie Nutrition-alimentation Technologies et
Corrigé. TD. Biologie. Nutrition-alimentation. Technologies et techniques professionnelles. CAP Petite enfance BTSE. 2 e édition. Jacqueline Gassier.
 TP 8 Détermination de lactivité spécifique dune enzyme.
TP 8 Détermination de lactivité spécifique dune enzyme.
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8 Adapter les manipulations de chimie en TP de biologie.
 Corrigé type de lExamen denzymologie appliquée - Exercices 1
Corrigé type de lExamen denzymologie appliquée - Exercices 1
Corrigé type de l'Examen d'enzymologie appliquée. Exercices 1. Répondez brièvement aux questions suivantes. 1. Pour quelles raisons le sulfate d'ammonium
 TP n°8 : Enzymologie 1 - BioDj
TP n°8 : Enzymologie 1 - BioDj
24 avr. 2015 Depuis 1812 on savait que certaines substances étaient capables d'accélérer des réactions chimiques sans être elles-mêmes modifiées par la ...
 TP B13-14. Enzymologie
TP B13-14. Enzymologie
Enzymologie. But du TP : – Etudier la vitesse d'une réaction enzymatique en fonction du temps. – Caractériser la vitesse initiale d'une enzyme selon le
 Enzymologie Appliquée
Enzymologie Appliquée
Le contenu de cette matière d'enzymologie appliquée destinée aux étudiants de. Master 1 spécialité biochimie appliquée
 Corrig TP catalase de radis
Corrig TP catalase de radis
Corrigé TP catalase de radis. La catalase est une enzyme (hémoprotéine contenant 4 groupements hème). Dans les cellules elle se trouve dans les.
 [PDF] TP B13-14 Enzymologie – Correction - Joseph Nicolas – SVT
[PDF] TP B13-14 Enzymologie – Correction - Joseph Nicolas – SVT
TP B13-14 Enzymologie – Correction I Etude de la vitesse d'une enzyme en fonction du temps 1 Loi de Beer-Lambert et la mesure de l'absorbance
 [PDF] CORRECTION TD ENZYMOLOGIE - F2School
[PDF] CORRECTION TD ENZYMOLOGIE - F2School
CORRECTION TD ENZYMOLOGIE SÉANCE 1 : 1 Définissez « enzyme » Une enzyme est un catalyseur biologique de nature protidique C'est-à-dire une protéine qui
 [PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
[PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1: Calcul des Activités enzymatiques a) Ecrivons la réaction catalysée par la lactase ou
 [PDF] manuel des travaux pratiques enzymologie et biochimie
[PDF] manuel des travaux pratiques enzymologie et biochimie
- Connaître le contenu du cours et travaux dirigés en relation avec les TP Manipulations: - Il faut prévoir une répartition du temps de travail de façon à
 [PDF] Extraction et Eude cinétique de linvertase - takweencom
[PDF] Extraction et Eude cinétique de linvertase - takweencom
Module : ENZYMOLOGIE ET METABOLISME Travaux Pratiques T P 3 2 Préparation de la gamme étalon pour le dosage des sucres réducteurs
 [PDF] TP 8 Etude cinétique de la Béta galactosidase
[PDF] TP 8 Etude cinétique de la Béta galactosidase
BTSA 1 Enzymologie module M55 Ph A biotechnologies education page 1 TP 8 Etude cinétique de la Béta galactosidase Les objectifs de cette séance :
 Examen corrige Corrigé denzymologie
Examen corrige Corrigé denzymologie
Corrige-type-Enzymologie-approfondie pdf Module: Enzymologie Approfondie Corrigé type ???? ???? Exercice 1 (8 pts) Une enzyme catalyse la réaction
 TP B13-14 Enzymologie ? Correction - Joseph Nicolas ? SVT
TP B13-14 Enzymologie ? Correction - Joseph Nicolas ? SVT
Exercice 1 : a Le site de fixation établie des liaisons covalentes avec le substrat Faux EXERCICES D'ENZYMOLOGIE - livres ebooks gratuits au format pdf
 [PDF] TD1 ENZYMOLOGIEpdf
[PDF] TD1 ENZYMOLOGIEpdf
TD1 D'ENZYMOLOGIE APPROFONDIE GENERALITES CLASSIFICATION STRUCTURE ET DOSAGE DES ENZYMES 3éme ANNEE LICENCE BIOCHIMIE ANNEE 2020-2021 Exercice N° 1
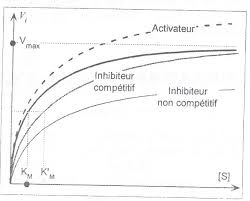
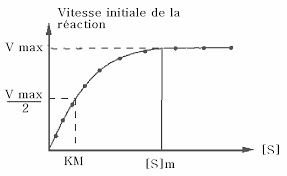
Comment déterminer kM et Vmax ?
Le coefficient Km doit être défini ainsi : c'est la concentration en substrat qui conduit à vi=Vmax/2 (sachant que Vmax est une valeur asymptotique). Que l'on peut énoncer aussi ainsi : c'est la concentration en substrat qui conduit à un taux de saturation de 50% de l'enzyme.Comment calculer l'activité d'une enzyme ?
AM = Vmax / nombre de mole d' enzyme. L'enzyme catalyse la transformation de 3 x 10-5 mol de P/min pour 1 litre de milieu réactionnel. Or la concentration de l'enzyme est de 150 mg/ml donc dans 1 litre on a : 150 x 10-6 x 1000 = 0,15 g d'enzyme.Comment calculer vitesse initiale enzymologie ?
La vitesse de réaction (caractérisée par la vitesse d'apparition du produit, soit v=d[P]dt) varie avec le temps (voir graphique 1). La vitesse de la réaction à un instant t s'obtient en mesurant la pente de la tangente à la courbe à cet instant t.- L'enzymologie est la partie de la biochimie qui étudie les propriétés structurales et fonctionnelles des enzymes (la relation structure - fonction). En particulier, elle s'applique à décrire la vitesse des réactions catalysées par les enzymes.

BTSA 1 Enzymologie module M55
Ph.A biotechnologies.education page 1
TP 8Etude cinétique
de la Béta galactosidaseLes objectifs de cette séance :
- Savoir réaliser une réaction enzymatique en fonction du temps et faire le lien avec la vitesse initiale. - Faire des cinétiques enzymatiques en fonctions des concentrations en substrat et en fonctions des inhibiteurs. - Réaliser des droites de corrélations en lien avec les mathématiques.Quelques précautions pour cette manipulation
Cette manipulation exige un soin constant ent
affecter son activité (verrerie la glace en dehors oNPG est un réactif coûteux : vouspouvez le détériorer complètement en introduisant par mégarde une pipette ayant
touché la solution enzymatique.BTSA 1 Enzymologie module M55
Ph.A biotechnologies.education page 2
I Etude cinétique de la Béta galactosidase.
EC 3.2.1.23
I.1 Test préalable.
Etudier la réaction enzymatique de la Béta galactosidase (en double). Se souvenir du TP précédent pour bien réaliser la manipulation.Manipulation
Ǧ 0.5 ml
Tampon TS pH=7.3 0.4 ml
Placer pendant 5 minutes les tubes à 30°C.
Enzyme 0.1 ml
(Cette solution est déjà diluée 10 fois) a 1M: lireQuestions pour cette manipulation.
I.11 Noter les absorbances.
I.12 Expliquer comment vous faites le blanc.
I.13 Quel est le rôle du carbonate de Na dans cette manipulation ?I.14 Expliquer le rôle de ce test.
BTSA 1 Enzymologie module M55
Ph.A biotechnologies.education page 3
I.2 Influence de la concentration en enzyme sur la vitesse de la réaction. Préparer 3 séries de tubes à hémolyses numérotées de la façon suivante :Série 1 10 11 12 13 14 15 16
Série 2 20 21 22 23 24 25 26
Série 3 30 31 32 33 34 35 36
Ajouter dans tous les tubes 1 ml de carbonate à 1M.Ajouter dans les tubes 10,20 et 30
Tampon TS 0,85 ml
oNPG (0,75 g.L-1) 0,15 ml Ces tubes serviront de témoins colorimétriques pour les lecturesDans un grand portoir allant au bain marie à 30°C, placer trois tubes à essais (Ce ne sont pas
des tubes plastiques) numérotés E1, E2 et E3 contenantE1 1(0,75 g.L-1) 8,25 ml de tampon TS
E2 (0,75 g.L-1) 8 ml de tampon TS
E3 (0,75 g.L-1) 7,5 ml de tampon TS
Préparer 3 pipettes de 1 ml
Placer les tubes à essais dans le bain marie pendant 5 minutes. e à t=0, remuer, déclencher le chronomètre et à t=30s, faire un prélèvement de 1ml pour le placer dans le tube 11. min puis ---------------------------------------------------. Faire des prélèvements à 5, 10, 15, 20, 30 et 45 minutes. Faire une lecture des absorbances à 420 nm contre un blanc. Expliquer la notion de blanc dans cette démarcheBTSA 1 Enzymologie module M55
Ph.A biotechnologies.education page 4
I.3 Influence de la concentration en substrat sur la vitesse de la réaction. concentration en enzyme constantes.Manipulation
Disposer dans des tubes numNPG et de tampon TS.
Série 1 10 11 12 13 14 15 16 17 18 19
Tampon TS ml 0.9 0.2 0.3 0.4 0.5 0.7 0.8 0.85 0.86 0.88 oNPG en ml - 0.7 0.6 0.5 0.4 0.2 0.1 0.05 0.04 0.02 commençant par le tube 10 puis après 30 secondes dans le tube 11 et ainsi de suite. Après 10 minutes arrêter la réaction enzymatique avec 1ml de carbonate de Na 1M selon les modalités précédentes.Questions pour cette manipulation.
I.21 Noter les absorbances pour cette étude.
I.22 Tracer le graphe 1/v =KM/VM x 1/[S] + 1/VM sur une feuille de papiermillimétré. Tracer pour les tubes 13, 14, 15, 16, 17, 18 et 19. Donner les vitesses en M.mnǦ
les concentrations en M.Détailler les calculs sur votre copie pour les points de cette droite. Veiller au soin du tracé.
I.23 Donner un titre à ce graphe.
I.24 Déterminer par le graphe les valeurs de KM et VMI.25 Donner une définition de KM et VM.
Remarque : 301.
Prendre pour valeur du ǦǦ
BTSA 1 Enzymologie module M55
Ph.A biotechnologies.education page 5
I.4 cinétique enzymatique.
enzyme constantes et en ajoutant un inhibiteur.Manipulation
Disposer dans des NPG et de tampon TS
Série 2 20 21 22 23 24 25 26 27 28 29
Tampon TS ml 0.85 0.15 0.25 0.35 0.45 0.65 0.75 0.80 0.81 0.83 oNPG en ml - 0.7 0.6 0.5 0.4 0.2 0.1 0.05 0.04 0.021.5g.LǦ
IPTG en ml 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 4mM commençant par le tube 10 puis après 30 secondes dans le tube 11 et ainsi de suite. Après 10 minutes arrêter la réaction enzymatique avec 1ml de carbonate de Na 1M selon les modalités précédentes.Série 3 30 31 32 33 34 35 36 37 38 39
Tampon TS ml 0.85 0.15 0.25 0.35 0.45 0.65 0.75 0.80 0.81 0.83 oNPG en ml - 0.7 0.6 0.5 0.4 0.2 0.1 0.05 0.04 0.021.Ǧ
IPTG en ml 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 8mM commençant par le tube 10 puis après 30 secondes dans le tube 11 et ainsi de suite. Après 10 minutes arrêter la réaction enzymatique avec 1ml de carbonate de Na 1M selon les modalités précédentes.Questions pour cette manipulation.
I.31 Noter les absorbances pour cette étude et tracer les droites sur le même graphe que pour I.22. paramètres enzymatiques qui sont influencés. (KM ou VM ).I.33 Déterminer le K I.
Donner les vitesses en M.mnǦ
BTSA 1 Enzymologie module M55
Ph.A biotechnologies.education page 6
Et autoévaluation par les étudiants
Objectifs de valeurs
demandées.Activité enzymatique pour Cf partie I.1
Activité ____________nanokatal /2
Courbe : Absorbance en fonction du temps. Cf partie I.23 Courbes /1.5
Interprétation
Proportionnelle à la
concentration en enzyme /05Courbes en double inverse. Cf partie I.2 et I.3
Les 3 courbes passent par 1/VM
Sinon 1 pt par courbe
/3Interprétations graphiques des paramètres cinétiques. A partir du tracé en double
inverseVM KM KM série 2 KM série 3
4 valeurs à déterminer /8pts
Calculs des param. A partir du tracé en double inverse.Ki série 2 Ki série 3 Moyenne
/3ptsInterprétation personnelle sur votre travail :
BTSA 1 Enzymologie module M55
Ph.A biotechnologies.education page 7
Matériel commun
Un bain marie thermostaté à 30 °C
Trois spectrophotomètres.
pH mètre agitateur gantsSolution commune à ne pas renverser
1.5 mg dans 20ml de TS A faire par les préparatrices
1l de tampon TS + Na2CO3 A faire par les préparatrices
ONPG 0.75g.lʛଉ¹ et ONPG 1.5 g.lʛଉ¹ A faire par les préparatrices IPTG2mM et 8 mM A faire par les préparatricesUn flacon NaOH 1M
Produits sigma à peser par les étudiants
Tampon monosodique
Tampon disodique
Na2CO3
Sur les paillasses. Prévoir 5 binômes
P1000, P100 mettre le maximum pour les étudiantsFiole jaugée de 100ml et 50 ml
3 flacons pour mettre les solutions
Bécher
Tubes hémolyses
Bouchons pour tubes
Cônes bleus
Cônes jaunes
Eau distillée, sopalin
Poubelle plastiques
Flacons pour mettre les solutions tampons
Préparation des solutions tampons par les étudiants. TAMPON TS -Préparer 50 ml de phosphate 100mM. Phosphate monobasique anhydre.Peser 0.59 g. A faire par les préparatrices
-Préparer 100 ml de tampon phosphate (tampon final) 100 mM en préparant 100ml de solution phosphate dibasique anhydre et ajuster le pH à 7.3 en rajoutant quelques gouttes de la solution précédente.Peser 1.42 g. A faire par les préparatrices
Préparation de 50ml de Na2CO3 1M Peser 8.9 g Bloque la réaction enzymatique. A faire par les préparatricesquotesdbs_dbs28.pdfusesText_34[PDF] comment calculer la vitesse initiale
[PDF] tp determination de la vitesse initiale d'une reaction enzymatique
[PDF] latis pro eurosmart
[PDF] latis pro analyse fourier
[PDF] calcul debit verin pneumatique
[PDF] calcul force d'un verin pneumatique
[PDF] tableau effort verin pneumatique
[PDF] calcul vitesse verin hydraulique
[PDF] tableau pourcentage vma temps distance
[PDF] vo2 max
[PDF] physiologie de l'effort pdf
[PDF] interpretation epreuve d'effort respiratoire
[PDF] epreuve d'effort vo2 max
[PDF] protocole de bruce tapis roulant
