 TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction
Biologie – TP B13-14. Correction. TP B13-14. Enzymologie – Correction. I. Etude de la vitesse d'une enzyme en fonction du temps. 1. Loi de Beer-Lambert et la
 Enzymologie TP 1
Enzymologie TP 1
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Etude cinétique de la Béta galactosidase. Les objectifs de cette séance : - Savoir réaliser
 manuel des travaux pratiques enzymologie et biochimie
manuel des travaux pratiques enzymologie et biochimie
ENZYMOLOGIE ET BIOCHIMIE METABOLIQUE. (M21/SVI4). RESPONSABLE : Pr. Khalil HAMMANI - Connaître le contenu du cours et travaux dirigés en relation avec les TP.
 Corrig TP catalase de radis
Corrig TP catalase de radis
Corrigé TP catalase de radis. La catalase est une enzyme (hémoprotéine contenant 4 groupements hème). Dans les cellules elle se trouve dans les.
 Untitled
Untitled
Récapitulez les objectifs de ce TP: Séance du : 2/10/09. Etudier la cynétique de la B-galactosidase (enzyme) qui catalyse naturellement la reaction lactose
 TP Sciences de la Vie
TP Sciences de la Vie
› TP réalisables : Enzymologie loi de Beer-Lambert Compact
 TP 8 Détermination de lactivité spécifique dune enzyme.
TP 8 Détermination de lactivité spécifique dune enzyme.
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Détermination de l'activité spécifique d'une enzyme. Les objectifs de cette séance
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
Mise en situation et recherche à mener. Nous consommons différents glucides tels que l'amidon
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
Mise en situation et recherche à mener. Nous consommons différents glucides tels que l'amidon
 TP B14. Enzymologie III. Etude de linfluence du pH sur la cinétique
TP B14. Enzymologie III. Etude de linfluence du pH sur la cinétique
Biologie – TP B13-14. Enzymologie - Correction. TP B14. Enzymologie. Eléments de correction. III. Etude de l'influence du pH sur la cinétique enzymatique. 1
 TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction. I. Etude de la vitesse d'une enzyme en fonction du temps. 1. Loi de Beer-Lambert et la mesure de l'absorbance.
 Enzymologie TP 1
Enzymologie TP 1
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Etude cinétique de la Béta galactosidase. Les objectifs de cette séance :.
 Extraction et Eude cinétique de linvertase
Extraction et Eude cinétique de linvertase
Module : ENZYMOLOGIE ET METABOLISME. Travaux Pratiques T. P.. 3.2. Préparation de la gamme étalon pour le dosage des sucres réducteurs.
 Corrigé TD Biologie Nutrition-alimentation Technologies et
Corrigé TD Biologie Nutrition-alimentation Technologies et
Corrigé. TD. Biologie. Nutrition-alimentation. Technologies et techniques professionnelles. CAP Petite enfance BTSE. 2 e édition. Jacqueline Gassier.
 TP 8 Détermination de lactivité spécifique dune enzyme.
TP 8 Détermination de lactivité spécifique dune enzyme.
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8 Adapter les manipulations de chimie en TP de biologie.
 Corrigé type de lExamen denzymologie appliquée - Exercices 1
Corrigé type de lExamen denzymologie appliquée - Exercices 1
Corrigé type de l'Examen d'enzymologie appliquée. Exercices 1. Répondez brièvement aux questions suivantes. 1. Pour quelles raisons le sulfate d'ammonium
 TP n°8 : Enzymologie 1 - BioDj
TP n°8 : Enzymologie 1 - BioDj
24 avr. 2015 Depuis 1812 on savait que certaines substances étaient capables d'accélérer des réactions chimiques sans être elles-mêmes modifiées par la ...
 TP B13-14. Enzymologie
TP B13-14. Enzymologie
Enzymologie. But du TP : – Etudier la vitesse d'une réaction enzymatique en fonction du temps. – Caractériser la vitesse initiale d'une enzyme selon le
 Enzymologie Appliquée
Enzymologie Appliquée
Le contenu de cette matière d'enzymologie appliquée destinée aux étudiants de. Master 1 spécialité biochimie appliquée
 Corrig TP catalase de radis
Corrig TP catalase de radis
Corrigé TP catalase de radis. La catalase est une enzyme (hémoprotéine contenant 4 groupements hème). Dans les cellules elle se trouve dans les.
 [PDF] TP B13-14 Enzymologie – Correction - Joseph Nicolas – SVT
[PDF] TP B13-14 Enzymologie – Correction - Joseph Nicolas – SVT
TP B13-14 Enzymologie – Correction I Etude de la vitesse d'une enzyme en fonction du temps 1 Loi de Beer-Lambert et la mesure de l'absorbance
 [PDF] CORRECTION TD ENZYMOLOGIE - F2School
[PDF] CORRECTION TD ENZYMOLOGIE - F2School
CORRECTION TD ENZYMOLOGIE SÉANCE 1 : 1 Définissez « enzyme » Une enzyme est un catalyseur biologique de nature protidique C'est-à-dire une protéine qui
 [PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
[PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1: Calcul des Activités enzymatiques a) Ecrivons la réaction catalysée par la lactase ou
 [PDF] manuel des travaux pratiques enzymologie et biochimie
[PDF] manuel des travaux pratiques enzymologie et biochimie
- Connaître le contenu du cours et travaux dirigés en relation avec les TP Manipulations: - Il faut prévoir une répartition du temps de travail de façon à
 [PDF] Extraction et Eude cinétique de linvertase - takweencom
[PDF] Extraction et Eude cinétique de linvertase - takweencom
Module : ENZYMOLOGIE ET METABOLISME Travaux Pratiques T P 3 2 Préparation de la gamme étalon pour le dosage des sucres réducteurs
 [PDF] TP 8 Etude cinétique de la Béta galactosidase
[PDF] TP 8 Etude cinétique de la Béta galactosidase
BTSA 1 Enzymologie module M55 Ph A biotechnologies education page 1 TP 8 Etude cinétique de la Béta galactosidase Les objectifs de cette séance :
 Examen corrige Corrigé denzymologie
Examen corrige Corrigé denzymologie
Corrige-type-Enzymologie-approfondie pdf Module: Enzymologie Approfondie Corrigé type ???? ???? Exercice 1 (8 pts) Une enzyme catalyse la réaction
 TP B13-14 Enzymologie ? Correction - Joseph Nicolas ? SVT
TP B13-14 Enzymologie ? Correction - Joseph Nicolas ? SVT
Exercice 1 : a Le site de fixation établie des liaisons covalentes avec le substrat Faux EXERCICES D'ENZYMOLOGIE - livres ebooks gratuits au format pdf
 [PDF] TD1 ENZYMOLOGIEpdf
[PDF] TD1 ENZYMOLOGIEpdf
TD1 D'ENZYMOLOGIE APPROFONDIE GENERALITES CLASSIFICATION STRUCTURE ET DOSAGE DES ENZYMES 3éme ANNEE LICENCE BIOCHIMIE ANNEE 2020-2021 Exercice N° 1
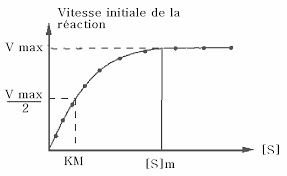
Comment déterminer kM et Vmax ?
Le coefficient Km doit être défini ainsi : c'est la concentration en substrat qui conduit à vi=Vmax/2 (sachant que Vmax est une valeur asymptotique). Que l'on peut énoncer aussi ainsi : c'est la concentration en substrat qui conduit à un taux de saturation de 50% de l'enzyme.Comment calculer l'activité d'une enzyme ?
AM = Vmax / nombre de mole d' enzyme. L'enzyme catalyse la transformation de 3 x 10-5 mol de P/min pour 1 litre de milieu réactionnel. Or la concentration de l'enzyme est de 150 mg/ml donc dans 1 litre on a : 150 x 10-6 x 1000 = 0,15 g d'enzyme.Comment calculer vitesse initiale enzymologie ?
La vitesse de réaction (caractérisée par la vitesse d'apparition du produit, soit v=d[P]dt) varie avec le temps (voir graphique 1). La vitesse de la réaction à un instant t s'obtient en mesurant la pente de la tangente à la courbe à cet instant t.- L'enzymologie est la partie de la biochimie qui étudie les propriétés structurales et fonctionnelles des enzymes (la relation structure - fonction). En particulier, elle s'applique à décrire la vitesse des réactions catalysées par les enzymes.
Biologie - TP B13-14. Correction
TP B13-14. Enzymologie - Correction
I.Etude de la vitesse d'une enzyme en fonction du temps 1.Loi de Beer-Lambert et la mesure de l'absorbance
2.Manipulations
a)Solution de référence b)Solution étalon c)Mesures de la vitesse de la réaction en fonction du temps3.Exploitation des résultats
a)Détermination du lien absorbance - concentration •Calculez la concentration d'amidon dans la solution étalon.On fait un bilan de matière :c1v1=c2v2=cm2v2
M⇒c1=cm2v2
Mv1Où :
-c1 et v1 sont la concentration molaire et le volume de la solution finale, respectivement -c2 et v2 sont la concentration molaire et le volume de la solution initiale, respectivement -cm2 est la concentration massique de la solution initiale-M est la " concentration molaire d'amidon » c'est-à-dire le nombre de moles de glucose polymérisé sous
forme d'amidon par litre.A.N. : c1 = 5,14.10-4 mol.L-1.
•Déduisez-en la valeur de ελL LL.A = ελ c1 L → ελ L = A/c1. On connait c1 (question précédente), et on lit la valeur de A sur le spectrophotomètre.
L'absorbance réelle varie selon les groupes (à cause des incertitudes de mesure et de manipulation). La valeur retenue
ici pour les calculs est A = 0,54 pour la solution étalon.On en déduit ελ L = 1050 L.mol-1.
b)Détermination de la vitesse en fonction du temps •Justifiez que v=-12ελLdA
dt, avec v la vitesse de la réaction, ελ l'absoptivité et L la longueur de la cuve.La vitesse est définie commev=d[maltose]
dt, doncv=-12d[amidon]
dt(car un maltose correspond à une ablation de 2 molécules de glucose). Or [amidon]=AελL, doncv=-1
2ελLdA
dt. •Tracez le graphe de la vitesse de la réaction en fonction du temps.Les résultats ont été assez variables sur la salle, avec parfois des vitesses particulièrement importantes, de façon non
expliquée. On présente ici un exemple d'une évolution normale (attendue).1 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS
Biologie - TP B13-14. Correction
0102030405060700,0400,0600,0800,1000,1200,140[amidon] en fonction du temps
temps (s)[amidon] (mmol.L-1)0102030405060700,0000,0010,0010,0020,0020,0030,0030,0040,004Vitesse en fonction du temps
Temps (s)
Vitesse (mmol.L-1.s-1)Pour information, on a inséré la courbe de [amidon] en fonction de t. La courbe de v en fonction de t est déterminée en
déterminant le coefficient directeur de quelques tangentes à la courbe de gauche. •Commentez votre résultat.La vitesse diminue au cours du temps, ce que l'on interprète comme étant l'effet de la diminution de la concentration en
substrat disponible, la concentration en enzyme ne variant pas. II.Etude de la vitesse initiale d'une enzyme en fonction de la concentration en substrat1.Manipulations
a)Préparation des solutions volume solution →12345 eau distillée2,65 mL2,70 mL2,75 mL2,80mL2,85 mL solution d'amidon (1 g.L-1)250 μL200 μL150 μL100 μL50 μL lugol 1 %20 μL20 μL20 μL20 μL20 μL solution d'enzyme100 μL100 μL100 μL100 μL100 μL total3,02 mL3,02 mL3,02 mL3,02 mL3,02 mL concentration en amidon (g.L-1)0,0830,0670,0500,0330,017 concentration en amidon (mol.L-1)5,1.10-44,1.10-43,1.10-42,0.10-41,0.10-4 b)Mesure de la vitesse initiale2.Exploitation des résultats
•Déterminez pour chaque solution la concentration molaire initiale en amidon (valeurs à compléter dans
le tableau II.1.a) (voir plus haut)2 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS
Biologie - TP B13-14. Correction
•Déterminez viL Lpour chacune des cinq solutions. NB : on notera que la relation entre l'absorbance et la
vitesse utilisée en I.3.b. reste valable ici.0,050,10,150,20,250,30,350,40,450,50,5500,10,20,30,40,50,60,70,80,9vi en fonction de [S]
[S] (mmol.L-1)vi (mmol.L-1.s-1)On a déterminé vi en traçant, pour différentes concentrations initiales, la concentration en fonction de t, et en
déterminant la pente de la courbe pour t = 0 (vitesse initiale).Il est difficile, avec ce seul graphe, de déterminer si l'enzyme est michaélienne ou non. Seule la représentation de
Lineweaver-Burk le permet.
•Tracez le graphe donnant 1 vien fonction de 1 [S]. -10-505101500,511,522,533,544,5f(x) = 0,3218 x + 0,6301R² = 0,99681/vi en fonction de 1/C
Linear ()
1/C (mmol-1.L)
•Montrez que l'α-amylase de blé est michaélienne, et déterminez son KM et son vmax.En représentation de Lineweaver-Burk, on peut voir que les points sont à peu près alignés. Il faudrait faire plusieurs
fois la manipulation, et surtout avec plus de 5 valeurs de vitesse, pour étayer ce résultat. On rappelle que sous cette
3 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS
Biologie - TP B13-14. Correction
hypothèse, on a : v=vmax[S]KM+[S], donc 1
v=KM vmax1 [S]+1 vmax. L'alignement des valeurs de 1/vi valide donc le modèlede la cinétique michaelienne. On peut déterminer vmax et KM : 1/vmax est l'ordonnée de l'intersection entre la droite et
l'axe des ordonnées, et -1/KM est l'abscisse de l'intersection entre la droite et l'axe des abscisses. On a donc :
vmax = 1/0,7 = 1,4 mmol.L-1.s-1KM = -1/(-0,2) = 5 mmol.L-1
La validité de l'adéquation au modèle se mesure par le coefficient de corrélation linéaire R. Ici, R2 = 0,9968, ce qui est
correct. III. Etude de l'influence du pH sur la cinétique enzymatique1.Manipulations
a)Préparation des solutions volume à prélever solution tampon21,5 mL solution de glucose2,5 mL solution d'enzyme1 mL total25 mL b)Mesures de la vitesse de la réaction en fonction du temps2.Exploitation des résultats
•Montrez quev=-d[O2] dt.O2 est un produit de la réaction, coefficient stoechiométrique de 1. Mêmes raisons que dans la partie I.
•Pour chaque pH, déterminez la vitesse initiale de la réaction. Construisez le graphe viL L=L Lf(pH).
4 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS
Biologie - TP B13-14. Correction
pHvitesse (mg.L-1.s-1)•ConcluezOn en déduit que l'enzyme connaît son maximum d'activité pour un pH proche de 6. Ce pH correspond au pH du milieu
dans lequel cette enzyme est normalement rencontrée (en l'occurrence, le cytoplasme d'un champignon).
IV. Exercices d'enzymologie
1.La cétostéroïde-isomérase
a)En l'absence d'inhibiteur, peut-on estimer simplement la vitesse maximale ?C'est une question plutôt qualitative. Il faudrait pour cela tracer vi en fonction de [S]. On constate alors que la courbe
se rapproche rapidement d'une asymptote pour les plus grandes valeurs de [S]. On propose grâce à ce graphe une
valeur de vmax de 0,31 mol.L-1.Courbe suivante :
-carrés bleus : sans inhibiteur -losanges oranges : avec inhibiteur5 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS
Biologie - TP B13-14. Correction
b)Montrez que la cétostéroïde-isomérase est une enzyme michaélienne, et déterminez vmax et Km.
Afin de déterminer si l'enzyme est michaélienne ou non, et de déterminer précisément les valeurs de vmax et Km, on passe
par la représentation en double inverse.Courbe suivante :
-carrés bleus : sans inhibiteur -losanges oranges : avec inhibiteurLa régression linéaire est a priori tout à fait satisfaisante : l'enzyme est michaelienne. On trouve grâce à la courbe :
vmax = 1/2,5 = 0,4 mol.L-1.s-1. Cette valeur montre qu'il faut être prudent quand on détermine " à vue de nez » la vitesse
maximale : on est loin des 3,1 mol.L-1.s-1 proposés dans la question précédente. -5-3-11357911130510152025 f(x) = 1,4115 x + 2,4243R² = 0,9993
f(x) = 0,8101 x + 2,5171R² = 0,9989
1/[S] (mol-1.L)1/vi (mol-1.L.s)6 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS00,20,40,60,811,21,400,050,10,150,20,250,30,35
[S] (mol.L-1) vi (mol.L-1.s-1)Biologie - TP B13-14. Correction
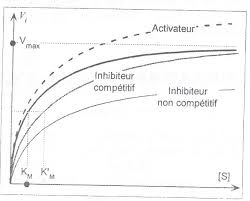
c)Déterminez vmax' et Km' dans le cas de l'inhibition. Déduisez-en si l'inhibition est compétitive ou non
compétitive.On fait les mêmes manipulations, et on construit la représentation de Lineweaver-Burk de la cinétique avec inhibiteur.
vmax n'est pas modifié. En revanche, KM est modifié : il passe à 1,72 mol.L-1. L'inhibition est donc compétitive.2.L'hexokinase
L'hexokinase est une enzyme catalysant la réaction glucose + ATP → glucose-6-phosphate + ADP.
a)Justifier le nom de cette enzyme.L'hexokinase est une kinase (qui phosphoryle une molécule) spécifique des hexoses (oses à six carbones).
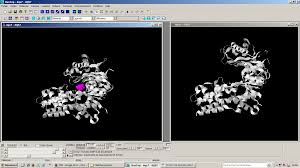
b)Ouvrez le logiciel RasTop, dans le dossier " logiciel prépa. » Téléchargez les fichiers 4qs7.pdb et 4qs8.pdb sur
https://www.rcsb.org/, et chargez-les dans RasTop. Ces fichiers correspondent à des structures
tridimensionnelles de l'hexokinase avec ou sans son ligand respectivement. Utilisez les fonctionnalités du
logiciel de façon à mettre en évidence un changement de forme de l'enzyme lorsqu'elle est liée à son substrat.
Interprétez ces changements.
En traitant les deux enzymes et en distinguant le substrat, on peut afficher :On y voit une modification de la conformation de l'enzyme lors de la fixation de son substrat, qu'on appelle
l'ajustement induit.c)Il existe plusieurs types d'hexokinases. L'hexokinase hépatique est appelée glucokinase. On rappelle que le foie
permet le stockage du glucose sous forme de glycogène. Interpréter ce rôle à l'aune du document.
L'hexokinase généraliste, présente dans tous les tissus, a un KM petit, et donc une activité forte. Une fois active, cette
enzyme est capable d'utiliser le glucose même à très petites concentrations. Cela permet à des cellules d'utiliser le
glucose, pour la glycolyse notamment, en toute circonstance.L'hexokinase hépatique a un KM bien plus élevé, et ne peut donc catalyser la phosphorylation du glucose que pour des
concentrations en glucose beaucoup plus élevée. Cette activité de la glucokinase uniquement pour des concentrations
élevées de glucose permettrait d'expliquer que le foie soit capable d'absorber et de métaboliser le glucose dans des cas
d'hyperglycémie.7 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS
Biologie - TP B13-14. Correction
NB : le KM de la glucokinase, c'est à dire la concentration de glucose pour laquelle l'enzyme est à la moitié de son
activité maximale, est justement proche de 0,6 mmoL.L-1, c'est à dire 1,1 g.L-1, soit une glycémie un peu élevée, à la
limite de l'hyperglycémie.8 BCPST1 - Lycée Châtelet - Douai - Joseph NICOLAS
quotesdbs_dbs11.pdfusesText_17[PDF] comment calculer la vitesse initiale
[PDF] tp determination de la vitesse initiale d'une reaction enzymatique
[PDF] latis pro eurosmart
[PDF] latis pro analyse fourier
[PDF] calcul debit verin pneumatique
[PDF] calcul force d'un verin pneumatique
[PDF] tableau effort verin pneumatique
[PDF] calcul vitesse verin hydraulique
[PDF] tableau pourcentage vma temps distance
[PDF] vo2 max
[PDF] physiologie de l'effort pdf
[PDF] interpretation epreuve d'effort respiratoire
[PDF] epreuve d'effort vo2 max
[PDF] protocole de bruce tapis roulant
