 TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction
Biologie – TP B13-14. Correction. TP B13-14. Enzymologie – Correction. I. Etude de la vitesse d'une enzyme en fonction du temps. 1. Loi de Beer-Lambert et la
 Enzymologie TP 1
Enzymologie TP 1
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Etude cinétique de la Béta galactosidase. Les objectifs de cette séance : - Savoir réaliser
 manuel des travaux pratiques enzymologie et biochimie
manuel des travaux pratiques enzymologie et biochimie
ENZYMOLOGIE ET BIOCHIMIE METABOLIQUE. (M21/SVI4). RESPONSABLE : Pr. Khalil HAMMANI - Connaître le contenu du cours et travaux dirigés en relation avec les TP.
 Corrig TP catalase de radis
Corrig TP catalase de radis
Corrigé TP catalase de radis. La catalase est une enzyme (hémoprotéine contenant 4 groupements hème). Dans les cellules elle se trouve dans les.
 Untitled
Untitled
Récapitulez les objectifs de ce TP: Séance du : 2/10/09. Etudier la cynétique de la B-galactosidase (enzyme) qui catalyse naturellement la reaction lactose
 TP Sciences de la Vie
TP Sciences de la Vie
› TP réalisables : Enzymologie loi de Beer-Lambert Compact
 TP 8 Détermination de lactivité spécifique dune enzyme.
TP 8 Détermination de lactivité spécifique dune enzyme.
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Détermination de l'activité spécifique d'une enzyme. Les objectifs de cette séance
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
Mise en situation et recherche à mener. Nous consommons différents glucides tels que l'amidon
 TP 2 : La spécificité des enzymes digestives. Mise en situation et
TP 2 : La spécificité des enzymes digestives. Mise en situation et
Mise en situation et recherche à mener. Nous consommons différents glucides tels que l'amidon
 TP B14. Enzymologie III. Etude de linfluence du pH sur la cinétique
TP B14. Enzymologie III. Etude de linfluence du pH sur la cinétique
Biologie – TP B13-14. Enzymologie - Correction. TP B14. Enzymologie. Eléments de correction. III. Etude de l'influence du pH sur la cinétique enzymatique. 1
 TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction
TP B13-14. Enzymologie – Correction. I. Etude de la vitesse d'une enzyme en fonction du temps. 1. Loi de Beer-Lambert et la mesure de l'absorbance.
 Enzymologie TP 1
Enzymologie TP 1
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8. Etude cinétique de la Béta galactosidase. Les objectifs de cette séance :.
 Extraction et Eude cinétique de linvertase
Extraction et Eude cinétique de linvertase
Module : ENZYMOLOGIE ET METABOLISME. Travaux Pratiques T. P.. 3.2. Préparation de la gamme étalon pour le dosage des sucres réducteurs.
 Corrigé TD Biologie Nutrition-alimentation Technologies et
Corrigé TD Biologie Nutrition-alimentation Technologies et
Corrigé. TD. Biologie. Nutrition-alimentation. Technologies et techniques professionnelles. CAP Petite enfance BTSE. 2 e édition. Jacqueline Gassier.
 TP 8 Détermination de lactivité spécifique dune enzyme.
TP 8 Détermination de lactivité spécifique dune enzyme.
Enzymologie module M55. Ph.A biotechnologies.education page 1. TP 8 Adapter les manipulations de chimie en TP de biologie.
 Corrigé type de lExamen denzymologie appliquée - Exercices 1
Corrigé type de lExamen denzymologie appliquée - Exercices 1
Corrigé type de l'Examen d'enzymologie appliquée. Exercices 1. Répondez brièvement aux questions suivantes. 1. Pour quelles raisons le sulfate d'ammonium
 TP n°8 : Enzymologie 1 - BioDj
TP n°8 : Enzymologie 1 - BioDj
24 avr. 2015 Depuis 1812 on savait que certaines substances étaient capables d'accélérer des réactions chimiques sans être elles-mêmes modifiées par la ...
 TP B13-14. Enzymologie
TP B13-14. Enzymologie
Enzymologie. But du TP : – Etudier la vitesse d'une réaction enzymatique en fonction du temps. – Caractériser la vitesse initiale d'une enzyme selon le
 Enzymologie Appliquée
Enzymologie Appliquée
Le contenu de cette matière d'enzymologie appliquée destinée aux étudiants de. Master 1 spécialité biochimie appliquée
 Corrig TP catalase de radis
Corrig TP catalase de radis
Corrigé TP catalase de radis. La catalase est une enzyme (hémoprotéine contenant 4 groupements hème). Dans les cellules elle se trouve dans les.
 [PDF] TP B13-14 Enzymologie – Correction - Joseph Nicolas – SVT
[PDF] TP B13-14 Enzymologie – Correction - Joseph Nicolas – SVT
TP B13-14 Enzymologie – Correction I Etude de la vitesse d'une enzyme en fonction du temps 1 Loi de Beer-Lambert et la mesure de l'absorbance
 [PDF] CORRECTION TD ENZYMOLOGIE - F2School
[PDF] CORRECTION TD ENZYMOLOGIE - F2School
CORRECTION TD ENZYMOLOGIE SÉANCE 1 : 1 Définissez « enzyme » Une enzyme est un catalyseur biologique de nature protidique C'est-à-dire une protéine qui
 [PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
[PDF] Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1
Correction TD Série 2 (Enzymologie Partie 1) Correction Exercice 1: Calcul des Activités enzymatiques a) Ecrivons la réaction catalysée par la lactase ou
 [PDF] manuel des travaux pratiques enzymologie et biochimie
[PDF] manuel des travaux pratiques enzymologie et biochimie
- Connaître le contenu du cours et travaux dirigés en relation avec les TP Manipulations: - Il faut prévoir une répartition du temps de travail de façon à
 [PDF] Extraction et Eude cinétique de linvertase - takweencom
[PDF] Extraction et Eude cinétique de linvertase - takweencom
Module : ENZYMOLOGIE ET METABOLISME Travaux Pratiques T P 3 2 Préparation de la gamme étalon pour le dosage des sucres réducteurs
 [PDF] TP 8 Etude cinétique de la Béta galactosidase
[PDF] TP 8 Etude cinétique de la Béta galactosidase
BTSA 1 Enzymologie module M55 Ph A biotechnologies education page 1 TP 8 Etude cinétique de la Béta galactosidase Les objectifs de cette séance :
 Examen corrige Corrigé denzymologie
Examen corrige Corrigé denzymologie
Corrige-type-Enzymologie-approfondie pdf Module: Enzymologie Approfondie Corrigé type ???? ???? Exercice 1 (8 pts) Une enzyme catalyse la réaction
 TP B13-14 Enzymologie ? Correction - Joseph Nicolas ? SVT
TP B13-14 Enzymologie ? Correction - Joseph Nicolas ? SVT
Exercice 1 : a Le site de fixation établie des liaisons covalentes avec le substrat Faux EXERCICES D'ENZYMOLOGIE - livres ebooks gratuits au format pdf
 [PDF] TD1 ENZYMOLOGIEpdf
[PDF] TD1 ENZYMOLOGIEpdf
TD1 D'ENZYMOLOGIE APPROFONDIE GENERALITES CLASSIFICATION STRUCTURE ET DOSAGE DES ENZYMES 3éme ANNEE LICENCE BIOCHIMIE ANNEE 2020-2021 Exercice N° 1
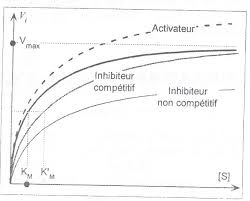
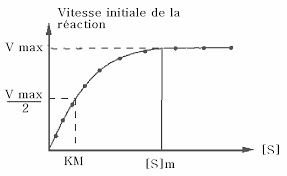
Comment déterminer kM et Vmax ?
Le coefficient Km doit être défini ainsi : c'est la concentration en substrat qui conduit à vi=Vmax/2 (sachant que Vmax est une valeur asymptotique). Que l'on peut énoncer aussi ainsi : c'est la concentration en substrat qui conduit à un taux de saturation de 50% de l'enzyme.Comment calculer l'activité d'une enzyme ?
AM = Vmax / nombre de mole d' enzyme. L'enzyme catalyse la transformation de 3 x 10-5 mol de P/min pour 1 litre de milieu réactionnel. Or la concentration de l'enzyme est de 150 mg/ml donc dans 1 litre on a : 150 x 10-6 x 1000 = 0,15 g d'enzyme.Comment calculer vitesse initiale enzymologie ?
La vitesse de réaction (caractérisée par la vitesse d'apparition du produit, soit v=d[P]dt) varie avec le temps (voir graphique 1). La vitesse de la réaction à un instant t s'obtient en mesurant la pente de la tangente à la courbe à cet instant t.- L'enzymologie est la partie de la biochimie qui étudie les propriétés structurales et fonctionnelles des enzymes (la relation structure - fonction). En particulier, elle s'applique à décrire la vitesse des réactions catalysées par les enzymes.
 1
1 Corrigé type de
Exercices 1. Répondez brièvement aux questions suivantes1. Pour quelles raisons le sulfate d'ammonium est le sel le plus couramment utilisé pour
précipiter les protéines, par rapport à autres sels ? (3 points) -Faible cout et disponibilité -Inerte vis-à-vis lenzyme (altère et ne dénature pas lenzyme). - Lexothermie (ne dégage pas de chaleur thermique). Dautres réponses correctes et proches du sens ont été prises en considération2. Quelle ? et pourquoi ? (1point)
Il nexiste pas de meilleure méthode, car chaque technique dimmobilisation présente ses propres avantages et inconvénients.3. Quel est la différence entre un isozyme et un allozyme ?
Les isoenzymes sont des enzymes catalysant la même réaction chimique, reconnait le même substrat, mais ayant des structures différentes, ces enzymes sont codés par le même gène mais ont subits des mutations avec le temps (1.5 point)Les alloenzymes sont des enzymes codées par différents allèles d'un même gène, mais qui
présente les mêmes caractéristiques que les isozymes (1.5 point)4. On veut immobiliser une enzyme protéique par liaison ionique, cette enzyme est sous
forme liquide à pH= 3, -Proposer un support adéquat : Carboxyméthylcellulose (support CMC) (1point) -Pourquoi : à pH acide (pH=3), lenzyme est chargée positivement, (1point) donc le support doit être un échangeur cationique (un support chargé négativement) pour former la liaison ionique (1point) -Si on change le pH à 10, est ce que le support proposé sera toujours utilisable ?? justifier. Dans le cas contraire proposé un autre support adéquat pour ces conditions.Non, car à pH=10, la solution est basique est par conséquent lenzyme sera chargé
négativement, le support dans se cas la doit être un échangeur anionique (support chargé positivement) pour permettre la formation dune liaison ionique. (1point)Le support proposé : DEAE-cellulose (1point)
Université El-hadj Lakhdar - Batna-
Faculté des Sciences Année universitaire : 2020/2021
Département des Sciences de la nature et de la vie : 24/06/2020
Filière : : 01h30h
Master 1 Microbiologie appliquée Chargé du module : BENAMMAR L.
Nomrénom
Note 2 Exercices 2 : Entourez la/les lettre (s) qui correspond (s) à la /les bonne (s) réponse (s)1. La destruction de la paroi chez les bactéries Gram négatif se fait par (1point)
A. Extraction chimique
B. Extraction enzymatique
C. Extraction chimique et enzymatique
D. Toutes les réponses sont correctes
2. Concernant les classes d'enzymes (1point)
A. Les ligases permettent la liaison entre deux molécules avec synthèse d'ATP B. Les transférases permettent un transfert du groupement fonctionnel intramoléculaire C. Les isomérases permettent un transfert du groupement fonctionnel intermoléculaireD. Aucune réponse n'est correcte
3. Concernant l'extraction d'enzyme (1point)
A. Elle est appliquée sur les enzymes intracellulaires B. Elle est appliquée sur les enzymes extracellulaires C. Elle est appliquée sur les enzymes intracellulaires et extracellulairesD. Dépend du siège de l'enzyme
4. Concernant le choque osmotique (1point)
A. La rupture cellulaire aura lieu quand la concentration de la solution est supérieure à celle du milieu intérieur B. La rupture cellulaire aura lieu quand la concentration de la solution est inférieure à celle du milieu intérieur C. L'eau pénètre à l'intérieure quand la solution est hypotonique D. L'eau pénètre à l'intérieure quand la solution est hypertonique5. La lyophilisation est (1point)
A. C'est une
B.C. Elle permet le passage de l'état solide à l'état gazeux directement sans passer par l'état
liquide).D. Aucune réponse n'est correcte
6. Dans le cas de la co-réticulation des enzymes (1point)
A. La protéine active de type BSA ajouter permet d'améliorer la réticulation B. La diminution de l'activité enzymatique est due à l'encombrement stérique C. L'augmentation de l'activité enzymatique est due à l'encombrement stérique D.7. L'immobilisation d'enzyme permet de (2 points)
A. Epargner le cout de la purification
B. Améliore la séparation de l'enzyme et du produit finalC. Préserver la stéréotypie de l'enzyme
D. Toutes les réponses sont fausses
quotesdbs_dbs28.pdfusesText_34[PDF] comment calculer la vitesse initiale
[PDF] tp determination de la vitesse initiale d'une reaction enzymatique
[PDF] latis pro eurosmart
[PDF] latis pro analyse fourier
[PDF] calcul debit verin pneumatique
[PDF] calcul force d'un verin pneumatique
[PDF] tableau effort verin pneumatique
[PDF] calcul vitesse verin hydraulique
[PDF] tableau pourcentage vma temps distance
[PDF] vo2 max
[PDF] physiologie de l'effort pdf
[PDF] interpretation epreuve d'effort respiratoire
[PDF] epreuve d'effort vo2 max
[PDF] protocole de bruce tapis roulant
