 CHAPITRE 1 LA MATIÈRE
CHAPITRE 1 LA MATIÈRE
d) Montrer que la masse est concentrée dans le noyau. Composition atomique a) D'après la classification périodique. Le numéro atomique de l'atome de soufre est
 Reproduire et compléter le tableau suivant : Symbole Nombre de
Reproduire et compléter le tableau suivant : Symbole Nombre de
Enfin le soufre est un oligo-élément clé de la beauté
 Les molécules de lair (modèles moléculaires)
Les molécules de lair (modèles moléculaires)
Les atomes sont l'une des trois particules qui constituent la matière. L'atome de soufre a pour symbole S et est modélisé par une sphère jaune.
 Untitled
Untitled
Masse atomique et masse moleculaire. soufre et 12 atomes d'oxygène ... Calculer les masses des atomes de soufre et de plomb
 Calculs sur les quantités de matière : la mole datomes
Calculs sur les quantités de matière : la mole datomes
3) Où trouve-t-on la masse molaire atomique du soufre ? Et des autres éléments chimiques ? 4) Que représentent 53 mol d'atomes de nickel ? 5) Que vaut et
 Quest ce que la quantité de matière ? Fiche 1
Quest ce que la quantité de matière ? Fiche 1
atomes de soufre. 8. Une pièce d'un centime d'euro pèse 11 g. Calculer la masse d'un atome de cuivre
 1DF ExoCorr 1 Matière.odt
1DF ExoCorr 1 Matière.odt
Pourquoi peut-on dire que la masse d'un atome correspond à la somme des b) Complétez le dessin ci-à côté pour l'atome de soufre.
 N 602×1023
N 602×1023
Chaque atome a une masse égale au nombre de nucléons ? 167×10?27 kg ( mn ) Si cette proportion 54g d'aluminium pour 96g de soufre n'est pas respectée ...
 Chapitre 4 : le modèle de latome
Chapitre 4 : le modèle de latome
II) masse et dimension de l'atome la masse approchée de l'atome est égale à la masse de son noyau: ... Exemple : l'atome de soufre a pour symbole.
 Définitions 1) Quest-ce quune mole datomes de soufre ? Une mole
Définitions 1) Quest-ce quune mole datomes de soufre ? Une mole
Calculer la masse de 30 mol d'atomes de soufre. m(3 moles de S) = 3 × 6
 [PDF] CHAPITRE 1 LA MATIÈRE
[PDF] CHAPITRE 1 LA MATIÈRE
c) Calculer la masse de l'ensemble du nuage électronique de l'atome de soufre 32 d) Montrer que la masse est concentrée dans le noyau Composition atomique a)
 [PDF] Définitions 1) Quest-ce quune mole datomes de soufre ? 2) Que
[PDF] Définitions 1) Quest-ce quune mole datomes de soufre ? 2) Que
Exercice Corrigé Enoncé I- Définitions 1) Qu'est-ce qu'une mole d'atomes de soufre ? 2) Que représente la masse molaire atomique du soufre ?
 [PDF] Définitions 1) Quest-ce quune mole datomes de soufre ? Une mole
[PDF] Définitions 1) Quest-ce quune mole datomes de soufre ? Une mole
Une mole d'atome de soufre correspond à 602 10 23 atomes de soufre 4) Calculer la masse d'un atome de soufre (Z = 16 ; A = 32) mS = 32 × 167 10
 Soufre - Wikipédia
Soufre - Wikipédia
Le soufre possède 25 isotopes et un isomère nucléaire connus de nombre de masse allant de 26 à 49 dont quatre sont stables : 32S (9502 ) 33S (075 )
 [PDF] Éléments chimiques - Masses molaires atomiques ( - Nicole Cortial
[PDF] Éléments chimiques - Masses molaires atomiques ( - Nicole Cortial
Éléments chimiques - Numéros atomiques - Masses molaires atomiques ( ) mol g( 1 ? ) Nom Symbole Z Masse molaire Nom Symbole Z Masse molaire
 [PDF] Laurent Descôtes - OSTIGOV
[PDF] Laurent Descôtes - OSTIGOV
= 90 intermédiaire entre la masse d'un atome de soufre Ms = 32 et celle d'une molécule Sg Ms8 = 256 (voir figure (3 4)) Dans le sous-chapitre suivant nous
 [PDF] Mole masse atomique masse molaire
[PDF] Mole masse atomique masse molaire
2 Calculer la masse ( en g ) d'un atome de fluor 3 Déterminer la masse d'une mole d'atomes de soufre 4 Calculer le nombre d'atomes de brome dans 1 g
 [PDF] Cours de Chimie Structure de la matière - univ-ustodz
[PDF] Cours de Chimie Structure de la matière - univ-ustodz
2 Atomes et leur Masses atomiques [7] Il existe deux types d'atomes : les atomes non isotopiques et les isotopes III 2 a Masses atomiques (Isotopes) Ce sont
 [PDF] 1- La masse dune molécule est égale à
[PDF] 1- La masse dune molécule est égale à
Une molécule est composée d'atomes Chaque atome a une masse égale au nombre de nucléons ? 167×10?27 kg ( mn ) A : nombre total de nucléons pour un seul
Comment calculer la masse d'un atome de soufre ?
Et nous savons que la masse molaire du soufre est de 32,06 grammes par mole.
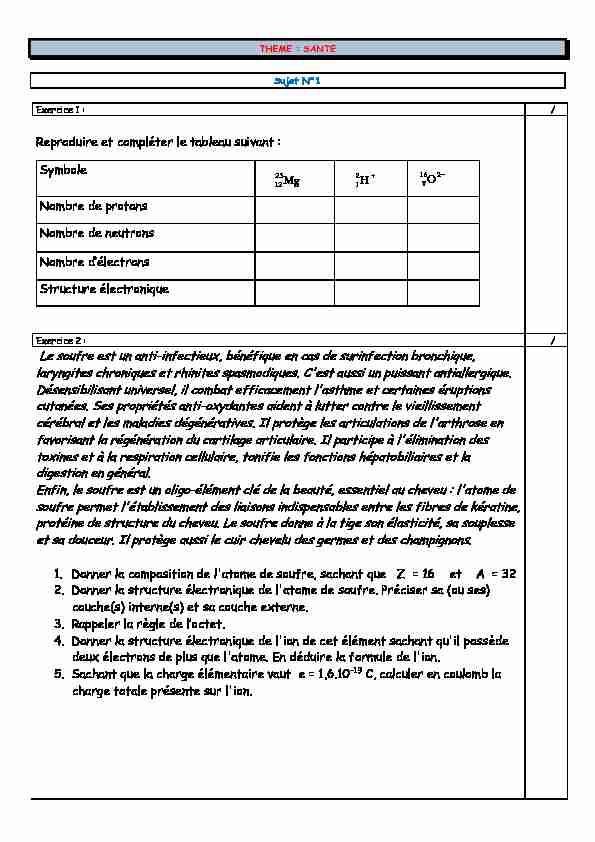
THEME : SANTE
Sujet N°1
Exercice 1 : /
Reproduire et compléter le tableau suivant :
Symbole
Nombre de protons
Nombre de neutrons
1RPNUH G·pOHŃPURQV
Structure électronique
Exercice 2 : /
Le soufre est un anti-infectieux, bénéfique en cas de surinfection bronchique, laryngites chroniques et rhinites spasmodiques. C'est aussi un puissant antiallergique. Désensibilisant universel, il combat efficacement l'asthme et certaines éruptions cutanées. Ses propriétés anti-oxydantes aident à lutter contre le vieillissementcérébral et les maladies dégénératives. Il protège les articulations de l'arthrose en
favorisant la régénération du cartilage articulaire. Il participe à l'élimination des toxines et à la respiration cellulaire, tonifie les fonctions hépatobiliaires et la digestion en général. Enfin, le soufre est un oligo-élément clé de la beauté, essentiel au cheveu : l'atome de soufre permet l'établissement des liaisons indispensables entre les fibres de kératine, protéine de structure du cheveu. Le soufre donne à la tige son élasticité, sa souplesse et sa douceur. Il protège aussi le cuir chevelu des germes et des champignons.1. Donner la composition de l'atome de soufre, sachant que Z = 16 et A = 32
2. Donner la structure électronique de l'atome de soufre. Préciser sa (ou ses)
couche(s) interne(s) et sa couche externe.3. Rappeler la règle GH O·RŃPHPB
4. Donner la structure électronique de l'ion de cet élément sachant qu'il possède
deux électrons de plus que l'atome. En déduire la formule de l'ion.5. Sachant que la charge élémentaire vaut e = 1,6.10-19 C, calculer en coulomb la
charge totale présente sur l'ion. H2 1Mg25 12 2168O Exercice3 : IH UMGRQ XQ JM] UMGLRMŃPLI G·RULJLQH naturelle Le radon est un élément chimique du tableau périodique de symbole Rn et de numéro atomique 86. F·HVP XQ JM] UMGLRMŃPLI G·RULJLQH QMPXUHOOH provenant de la désintégration du radium, lui-PrPH LVVX GH OM GpVLQPpJUMPLRQ GH O·XUMQLXP ŃRQPHQX GMQV Oa croûte terrestre. Il est inodore et incolore. Il est présent partout à la surface de la Terre mais plus particulièrement dans les sous-sols granitiques et volcaniques. En France, les régions riches en radon sont la Bretagne, le Massif central, les Vosges et la Corse. Il existe 34 isotopes de radon connus jusqu'à ce jour. Seuls 3 de ces isotopes se rencontrent dans la nature :
Le radon 222 qui est l'isotope le plus stable.
Le radon 220
Le radon 219
1. GRQQHU OM ŃRPSRVLPLRQ G·XQ QR\MX GH UMGRQ 222 HP G·Xn noyau de radon 220.
2. Quand dit-on que deux noyaux sont isotopes ?
3. (ŃULUH OM UHSUpVHQPMPLRQ V\PNROLTXH GH O·LVRPRSH OH SOXV VPMNOHB
Correction
Exercice 1 :
Exercice2 : soufre
1) Cet atome contient 16 protons (car Z =16), 16 neutrons (car A Z = 32 16 = 16) et autant d'électrons que de protons
(c'est-à-dire 16) pour assurer l'électroneutralité de l'atome.2) Cet atome possède 16 électrons. Sa structure électronique est donc : (K)2(L)8(M)6.
3 5qJOH GH O·RŃPHP : Pour accéder à la stabilité des gaz inertes, certains atomes ont tendance à gagner ou perdre des
électrons pour avoir une structure électronique en octet ( 8 électrons sur la couche externe ).
4) L'ion possède 16 + 2 = 18 électrons. Sa structure électronique est donc : (K)2(L)8(M)8
L'ion possède deux charges élémentaires négatives et se note 3216 S2².5) La charge de l'ion vaut : q(ion S2²) = q(protons) + q(électrons) = 16 e + 18 ( e) = 2 e = 2 1,6.10-19 = 3,2.10-19 C.
Exercice 3 : Radon
1) Représentation symbolique du noyau : 86 protons et 222 86 = 136 neutrons
2) neutrons sont
différents.3) Isotope le plus stable : 22286Rn
Symbole
Nombre de protons 12 1 8
Nombre de neutrons 13 1 8
1RPNUH G·pOHŃProns 12 0 10
Structure électronique K2L8M2 K0 K2L8
H2 1Mg25 12 2168Oquotesdbs_dbs28.pdfusesText_34
[PDF] ion sulfure composition
[PDF] formule sulfure de sodium
[PDF] nombre de charges positives dans le fer
[PDF] ion soufre formule
[PDF] ion lithium formule
[PDF] formule de l'ion iodure
[PDF] diametre primitif pignon chaine
[PDF] datedif ne fonctionne pas
[PDF] datedif excel 2010
[PDF] masse d'une mole de glucose
[PDF] lors d'un effort physique une partie du glucose stocké
[PDF] comment compter les mots en anglais
[PDF] compter les mots dans une phrase cp
[PDF] compter les lettres
