 Première S Nom : Prénom : TP : extraction et identification de la
Première S Nom : Prénom : TP : extraction et identification de la
Comment extraire la caféine des feuilles de thé ? • molécule de caféine. Eau. Ethanol. C2H6O. Cyclohexane. C6H12. Acétate d'
 1S - TP extraction de la caféine du thé
1S - TP extraction de la caféine du thé
1S - TP extraction de la caféine du thé. 1 Objectif. Le thé contient de la caféine que nous allons extraire en utilisant deux solvants : l'eau et le
 TP:Extraction de la caféine du thé
TP:Extraction de la caféine du thé
Lors de l'extraction liquide-liquide les anions provenant des acides restent dans la solution aqueuse basique
 TP 02 : EXTRACTION DE LA CAFEINE DES FEUILLES DE THE
TP 02 : EXTRACTION DE LA CAFEINE DES FEUILLES DE THE
TP 02 : EXTRACTION DE LA CAFEINE DES FEUILLES DE THE. 1.INTRODUCTION. * Origine du café. Selon la légende le café fut remarqué pour la première fois 850 ans
 Extraction de la caféine du Red Bull®
Extraction de la caféine du Red Bull®
Lors de ce TP nous allons extraire la caféine et mettre en évidence sa présence à l'aide de différentes techniques de caractérisation. Précautions (à lire
 ECE : Extraction de la caféine
ECE : Extraction de la caféine
Choisir le solvant permettant d'extraire la caféine contenue dans l'eau du verre de Nicolas en détaillant les raisons qui ont déterminé ce choix. Préciser
 Extraire la caféine du café
Extraire la caféine du café
TP Chimie 5 TS 2012-2013. Extraire la caféine du café. La caféine (13
 TP CONTROLE 1 : EXTRACTION ET CCM DE LA CAFEINE
TP CONTROLE 1 : EXTRACTION ET CCM DE LA CAFEINE
TP Contrôle 1. Page 1 sur 2. TP CONTROLE 1 : EXTRACTION ET CCM DE LA CAFEINE EXTRAITE DU REDBULL. I. PRESENTATION DU SUJET PAR QUELQUES DOCUMENTS. Document 1
 THEME : La pratique du sport Les matériaux et les molécules du
THEME : La pratique du sport Les matériaux et les molécules du
9 juin 2011 TP évalué : autour de la caféine (version N. Marion). Page 3/10. TP évalué (1h). Extraction et identification par chromatographie de la caféine.
 TP CONTROLE 1 : EXTRACTION ET CCM DE LA CAFEINE
TP CONTROLE 1 : EXTRACTION ET CCM DE LA CAFEINE
TP Contrôle 1. Page 1 sur 2. TP CONTROLE 1 : EXTRACTION ET CCM DE LA CAFEINE EXTRAITE DU REDBULL. I. PRESENTATION DU SUJET PAR QUELQUES DOCUMENTS. Document 1
 [PDF] TP : extraction et identification de la caféine des feuilles de thé
[PDF] TP : extraction et identification de la caféine des feuilles de thé
Prénom : TP : extraction et identification de la caféine des feuilles de thé Objectifs : • Choisir un solvant et mettre en œuvre un protocole d'extraction
 [PDF] TP sur lextraction de la caféine - Physique Chimie Caen
[PDF] TP sur lextraction de la caféine - Physique Chimie Caen
Argumenter à propos d'une extraction en utilisant des données physico-chimiques et de sécurité Objectifs • Mettre en œuvre un raisonnement scientifique •
 [PDF] TP n°5 : Thé ou café ? - Physique Chimie Caen
[PDF] TP n°5 : Thé ou café ? - Physique Chimie Caen
Il faut extraire la caféine contenue dans une quantité définie de feuilles de thé ? Il faut la récupérer sous forme d'un solide blanc
 [PDF] Extraction de la caféine du Red Bull®
[PDF] Extraction de la caféine du Red Bull®
Lors de ce TP nous allons extraire la caféine et mettre en évidence sa présence à l'aide de différentes techniques de caractérisation Précautions (à lire
 [PDF] Extraire la caféine du café - Jallufr
[PDF] Extraire la caféine du café - Jallufr
TP Chimie 5 TS 2012-2013 Extraire Extraction solide-liquide par décoction le cas présent l'extraction est basée sur une propriété de la caféine
 [PDF] Extraction de la caféine du thé par percolation
[PDF] Extraction de la caféine du thé par percolation
- Procéder à deux extractions sur la solution aqueuse avec chaque fois 10 mL du solvant organique choisi - Sécher la phase organique obtenue - Evaporer le
 [PDF] tp controle 1 : extraction et ccm de la cafeine extraite du redbull
[PDF] tp controle 1 : extraction et ccm de la cafeine extraite du redbull
TP CONTROLE 1 : EXTRACTION ET CCM DE LA CAFEINE EXTRAITE DU REDBULL doigt à cause entre autre de leur teneur en caféine
 [PDF] TP : extraction et identification de la caféine des feuilles de thé
[PDF] TP : extraction et identification de la caféine des feuilles de thé
Prénom : TP : extraction et identification de la caféine des feuilles de thé Objectifs : • Choisir un solvant et mettre en œuvre un protocole d'extraction
 [PDF] 1S - TP extraction de la caféine du thé - Physicus
[PDF] 1S - TP extraction de la caféine du thé - Physicus
1 Objectif Le thé contient de la caféine que nous allons extraire en utilisant deux solvants : l'eau et le dichlorométhane Nous allons utiliser le fait
 [PDF] TP sur lextraction de la caféine - Physique-Chimie
[PDF] TP sur lextraction de la caféine - Physique-Chimie
Argumenter à propos d'une extraction en utilisant des données physico-chimiques et de sécurité Objectifs • Mettre en œuvre un raisonnement scientifique •
 [PDF] ECE : Extraction de la caféine - Académie dOrléans-Tours
[PDF] ECE : Extraction de la caféine - Académie dOrléans-Tours
1 Choisir le solvant permettant d'extraire la caféine contenue dans l'eau du verre de Nicolas en détaillant les raisons qui ont déterminé ce choix
 TP Extraction de La Cafeine Des Feuilles PDF Caféine - Scribd
TP Extraction de La Cafeine Des Feuilles PDF Caféine - Scribd
En industrie ce procédé est utilisé notamment pour extraire la caféine du café Le procédé utilisé fonctionne en continu ce qui implique un rendement plus
 [PDF] TP : Extraction de la caféine du thé
[PDF] TP : Extraction de la caféine du thé
TP : Extraction de la caféine du thé Nom et prénom : Nom et prénom : Présentation La caféine est un stimulant doux Elle est peu soluble dans l'eau (22
 [PDF] Extraire la caféine du café - Jallufr
[PDF] Extraire la caféine du café - Jallufr
Dans le cas présent l'extraction est basée sur une propriété de la caféine rencontrée chez de nombreuses molécules qui est la suivante : la caféine est peu
 [PDF] Extraction de la caféine du Red Bull®
[PDF] Extraction de la caféine du Red Bull®
Lors de ce TP nous allons extraire la caféine et mettre en évidence sa présence à l'aide de différentes techniques de caractérisation Précautions (à lire
 [PDF] Extraction de la caféine du thé
[PDF] Extraction de la caféine du thé
Dans cette expérience on se propose d'extraire la caféine des feuilles de thé On procède à une extraction liquide-solide (eau chaude - feuilles de thé) suivie
Comment extraire de la caféine ?
Dans cette méthode de décaféination, on utilise un mélange d'eau et d'acétate d'éthyle. Dans la cuve d'extraction, l'acétate d'éthyle est versé sur les grains gorgés d'eau pour en extraire la caféine. Le mélange d'eau, d'acétate d'éthyle et de caféine est ensuite évacué de la cuve.Quel solvant pour extraire la caféine ?
Il devra donc indiquer que : - le solvant utilisé est l'éthanoate de butyle car la caféine y est très soluble, il est non miscible à l'eau et assure un maximum de sécurité comparativement aux autres solvants proposés ; - la densité de l'eau étant supérieure à celle de l'éthanoate de butyle, la phase aqueuse (à tester)Comment purifier la caféine ?
Deux méthodes permettent de purifier cette caféine : par recristallisation ou par sublimation.
14.1 Par recristallisation. Dissoudre la caféine brute dans quelques mL d'acétone. 24.2 Par sublimation. Introduire la caféine brute dans un bécher en Pyrex®, qui sera fermé en déposant une plaque de verre ou de métal à sa surface.- Principe
L'extraction solide-liquide consiste à faire passer une substance d'un solide vers un solvant dans lequel elle est soluble et dont elle sera facilement isolable. Le processus nécessite un long contact du solvant avec le solide préalablement broyé avant extraction.
Page 1 sur 3
TP Chimie 5 TS 2012-2013
Extraire la caféine du
café La caféine (1,3,7-triméthylxanthine) C8H10N4O2. La caféine pure est dangereuse car elle a un effet important sur lorganisme : insomnie, palpitations cardiaques, nausées, anxiété, polyurie. La dose létaleestimée (quantité moyenne mortelle) est entre 5 et 10 g pour un adulte. Ne pas goûter la caféine pure !
Pris à forte dose, on peut considérer le café (et la caféine) comme une drogue. Le dichlorométhane est un solvant suspecté de provoquer le cancer à long terme. Afin demanipuler en toute sécurité, il est donc impératif de travailler sous hotte, avec léquipement
de protection habituel.1. Extraction solide-liquide par décoction
Verser 25 g de café réduit en poudre dans le ballon de 250 mL. Ajouter 100 mL deau et 12,5 g de
carbonate de calcium CaCO3. Lidéal est dobtenir un pH de 9 (Lacide gallique présent dans le café
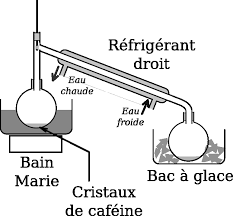
sera sous une forme peu soluble dans le dichlorométhane lors de létape suivante).Munir le ballon du réfrigérant à boules, de façon à pouvoir chauffer sans perte de matière. Maintenir le
mélange à ébullition douce durant deux heures.1.1. Schéma, Légende.
1.2. Rôle du réfrigèrent, de la pierre ponce
Document 1 : " Toutes les extractions consistent à utiliser habilement les différences de solubilité
selon les molécules, la température ou les solvants, afin de sélectionner les espèces à extraire. Dans
le cas présent, l'extraction est basée sur une propriété de la caféine, rencontrée chez de nombreuses
molécules, qui est la suivante : la caféine est peu soluble dans l'eau froide (22 g/L à 25°C), mais
l'est considérablement dans l'eau chaude (455 g/L à 65°C). De plus, cette molécule est très soluble
dans plusieurs solvants organiques, dont le dichlorométhane utilisé ici (142 g/L à 25°C). Grâce à
cette différence de solubilité selon la température, on réalise tout d'abord une décoction de la
matière première solide, le café, dans l'eau bouillante. La caféine, alors très soluble, passe donc en
solution aqueuse. Mais, la température diminuant, la caféine voit sa solubilité décroître. L'ajout de
dichlorométhane dans la phase aqueuse refroidie permet donc à la caféine de s'y dissoudre
efficacement, celle-ci y étant bien plus soluble que dans l'eau froide. De cette façon, il a été possible
de sélectionner une molécule et de l'extraire. Mais d'autres espèces chimiques du café pourraient
présenter la même propriété : c'est justement le cas des colorants végétaux contenus dans cette
plante. Afin d'éviter le passage de ces colorants dans le solvant organique, une seconde parade est
utilisée. En effet, la solubilité dépend également d'un autre paramètre : le pH, c'est à dire le
caractère acide ou basique de la solution. En modifiant le pH, par l'ajout de carbonate de sodium,
la solution est rendue légèrement basique (pH = 9). Les colorants réagissent alors, devenant bien
plus solubles en phase aqueuse que dans la phase organique, et l'on évite ainsi de les extraire en
même temps que la caféine, qui ne réagit pas de cette façon en milieu basique. »Page 2 sur 3
1.3. À partir du document 1 précédent et 3 en fin de protocole, préciser en quelques mots, le rôle
du carbonate de calcium. Au terme de cette décoction, filtrer sur büchner et recueillir le jus marron. Laisser refroidir la solution. Attention, il est nécessaire dutiliser un papier filtre léger tant la décoction est " épaisse » et laspiration dair rendue difficile.1.4. Schéma, Légende.
2. Extraction liquide-liquide
Introduire 150 mL du jus marron dans lampoule à décanter et ajouter 50 mL de dichlorométhane CH2Cl2. Agiter très lentement, en retournant et en dégazant régulièrement, car une agitation trop vigoureuse risque de provoquer une émulsion. Si une émulsion se produit ajouter quelques mL dune solution saturée de NaCl afin de la casser. Attention à ne jamais diriger lampoule vers le voisin ! La caféine change alors de phase et passe dans le dichlorométhane. Laisser décanter (sans bouchon) et récupérer la phase o avec 50 mL de dichlorométhane, de façon à extraire le maximum de caféine. Répéter la décantation et une nouvelle extraction des 150 mL de phase aqueuse avec 50 mL de dichlorométhane. Une fois ces extractions réalisées, regrouper les phases organiques dans un Erlenmeyer.2.1. En tenant compte du document 2 en
fin de protocole, e déterminer si la caféine se trouve dans le dichlorométhane ou dans u. Justifier.2.2. Faire un schéma légendé du mélange après agitation et décantation
en précisant les places et contenus des deux phases. Afin de sécher la phase organique (éliminer les traces deau), ajouter, spatule par spatule dans lrlenmeyer, du chlorure de calcium anhydre ou vrlenmeyer maieau sont captées par le sel anhydre.Filtrer .
Récupérer la phase organique dans un ballon sec rodé.3. Évaporation du dichlorométhane
Au moyen dun
évaporateur rotatif ou
par distillation du solvant dans un montage de distillation simple (ballon + réfrigérant descendant) en surveillant la température (si celle-ci était trop élevée la caféine serait détruite). Une fois que tout le solvant est évaporé, il reste au fond du ballon une poudre jaune pâle : il sagit de caféine brute.3.1. Quel est le but de cette opération ?
(exploiter le document 2)On utilise la
décoction préalablement préparée de façonà obtenir 150 mL
de filtrat.Page 3 sur 3
4. Purification
Deux méthodes permettent de purifier cette caféine : par recristallisation ou par sublimation. Recristallisation : Dissoudre la caféine brute dans quelq, dans le cristallisoir. Laisser évaporer (sous hotte !), ce qui provoque la cristallisation de la caféine en petites aiguilles blanches.Sublimation : Introduire la caféine brute dans un bécher qui sera fermé avec un verre de montre.
Chauffer doucement le bécher : la cabondantes vapeurs blanches àlintérieur du bécher. Une fois que tout la caféine brute sest sublimée, stopper le chauffage. La
caféine se dépose alors sur les parois du bécher et de la plaque sous formes daiguilles.5. Identification
Document 2 : Tableau de données
Eau Eau (en milieu
basique) dichlorométhaneSolubilité de la caféine 22g/L à 25°C
455 g/L à 65°C 22 g/L à 25°C 142 g/L à 25°C
Solubilité des colorants
végétaux du café moyenne bonne moyenne100°C 100°C 40°C
Densité
1,00 1,00 1,33
Document 3 : Léquilibre de la caféine
L forme " protonée » Différents sites de " protonation » s grâce à leurdoublet non liant). Sous forme " protonée », la caféine est une espèce ionique : elle est donc beaucoup
au que sous forme " non-protonée ». Rendre le milieu basique permet de diminuer la solubilité de la caféine da son extraction ultérieurement.Le carbonate de calcium, une base est ajoutée pour enlever ces acides tanniques (phénols) en tant que
sels de calcium solubles dans leau.CaCO3 + 2 H+ ---> Ca+2 + CO2 + H2O
quotesdbs_dbs12.pdfusesText_18[PDF] chromatographie carotte svt
[PDF] phloroglucine
[PDF] tp carotte ts corrigé
[PDF] extraction et dosage de la chlorophylle
[PDF] dosage de chlorophylle par spectrophotométrie
[PDF] tp de dosage de chlorophylle
[PDF] chlorophylle a et b spectre d'absorption
[PDF] chromatographie sur couche mince polarité
[PDF] chromatographie sur couche mince protocole
[PDF] chromatographie sur couche mince définition
[PDF] chromatographie sur couche mince cours pdf
[PDF] chromatographie hplc
[PDF] chromatographie sur papier
[PDF] chromatographie seconde
