 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ▻ Exercice n°1. 1) Ecrire l'équation de la réaction de 1) Ecrire l'équation de la réaction de saponification d'un triglycéride par la soude.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
2.2- Ecrire l'équation de la saponification de l'oléine. 2.3- Donner le nom Corrigé. Note. 1.1. Comme l'acide chlorhydrique est en excès les termes qui ...
 Untitled
Untitled
La saponification est une réaction entre une base forte et un triglycéride; elle permet d'obtenir du savon et du glycérol. EXERCICE 3. 3.1. 3.2. (05 points).
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
Exercice 6: L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras
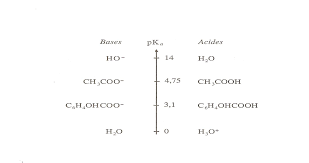 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Indiquer les et corriger. II-Dosage du lait. À l'aide de la solution La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Corrigés TD lipides
Corrigés TD lipides
Exercice 6 : Les indices d'acide et de saponification d'un corps gras ont été déterminés en dosant avec un acide (Ve ml normalité
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) ... e- indice de saponification du lipide (Is) est défini comme étant la masse de KOH (en mg) nécessaire à ...
 Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Exercice 1 : les savons. Question s. Réponses attendues. 1.1. La réaction se nomme saponification. 1.2. La réaction est totale ( c'est un hydrolyse en milieu
 TD N°2: Structure des lipides
TD N°2: Structure des lipides
Exercice 4: Une huile est formée d'un triglycéride homogène dont l'indice de saponification est égal à 570. Quel est l'acide gras présent dans cette huile
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ? Exercice n°1 1) Ecrire l'équation de saponification de la palmitine et donner les caractéristiques intéressantes de cette réaction.
 EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Indice de saponification et masse molaire d'un triacylglycérol (difficile à ... X = I x M? mg de KOH pour saponifier 1mole de lipide.
 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Cette épreuve est constituée de trois exercices. La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Untitled
Untitled
La saponification est une réaction utilisée pour préparer les savons à partir des CORRIGE. Epreuve du 1er groupe cissdoro.e-monsite.com. EXERCICE 1.
 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction exercices. 1. O O. Correction des exercices du chapitre 13. Exercice n°8 p 298 : Réaction de saponification de l'oléine : CH2-O-CO-R.
 Synthèse dun savon – Réaction de saponification Thème Santé
Synthèse dun savon – Réaction de saponification Thème Santé
Sous l'action de la soude concentrée à chaud
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
L'ordre décroissant d'indice de saponification est : Tributyrine- Dioléobutyrine-Tripalmitine – Dioléopalmitine-trilinolénine- trioléine. Exercice 2:.
 TP6 – Cinétique dune saponification
TP6 – Cinétique dune saponification
TP6 – Cinétique d'une saponification. Réalisation préalable d'un bilan de matière. • Une réaction pour modéliser la transformation de l'ester…
 Chapitre chimie N°8: Les savons
Chapitre chimie N°8: Les savons
La réaction qui permet de fabriquer un savon est une réaction de saponification. 1) Rappel: Réaction d'hydrolyse d'un ester.
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) a- Le nom de l'oligoside est ... nécessaire à la saponification de 1g de corps gras ou de lipide.
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
Saponification des esters - correction Correction Ex1 et Ex2 EX1: réactions de saponification 2-Nommer A B C D et E Corrigé: 1-a/ Rappel: soit la formule générale d’un ester Cet ester provient de la réaction d’estérification en milieu acide entre l’acide carboxylique R-COOH et un alcool R’-OH
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59 L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique Déterminer la masse molaire du triglycéride et sa structure Reponse6 Is (mg) 1g
 UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
Exercice 7 : Relation entre indice de saponification et masse molaire d’un triacylglycérol Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535 Quel est le triglycéride présent dans l’huile ? PM KOH = 56 Solution exercice 7 : TG + 3 KOH ----- glycérol + 3 savons
 Chapitre C7 Transformation en chimie organique Programme
Chapitre C7 Transformation en chimie organique Programme
Mécanisme réactionnel de la saponification : Il se décompose en trois étapes 3ème étape : réaction acido-basique entre l’anion alcoolate et l’acide carboxylique Correction 1 Extrait du sujet de Bac S Métropole 2013 Septembre Exercice 2 http://labolycee org/menugeo php?s=1&annee=2013&pays=Metropole&rattrap=1 2 3
 TP Chimie 11 Saponification TS I Principe du TP 1
TP Chimie 11 Saponification TS I Principe du TP 1
1 Écrire l’équation de la réaction de saponification en considérant que l’huile utilisée est un triester de l'acide oléique de formule brute C 18 H34 O2 Donner le nom et les formules semi-développées des réactifs et des produits
 Solution du TD 1 - F2School
Solution du TD 1 - F2School
saponification) Absorbent la lumière dans l’ultraviolet: Pas les acides gras saturés Pas les acides gras monoinsaturés Uniquement les acides gras polyinsaturés et qui ont en plus des doubles liaisons conjuguées S’oxydent spontanément au contact de l’oxygène de l’air: Uniquement les acides gras insaturés
 EX1: Exemples de réactions de saponification
EX1: Exemples de réactions de saponification
2/Ecrire l’équation-bilan de la réaction de saponification et déterminer la quantité de chacun des réactifs introduits dans le ballon (masse volumique de l’ester: mester=105g mL -1 ) 3/Ecrire l’équation bilan de la réaction qui se produit lors de l’ajout de la solution acide
 Synthèse d’un savon – Réaction de saponification Thème Santé
Synthèse d’un savon – Réaction de saponification Thème Santé
T P 17 : Synthèse d’un savon –Réaction de saponification Thème Santé Les objectifs de ce TP sont de : suivre un protocole de synthèse en respectant les consignes de sécurité réaliser un montage de chauffage à reflux réaliser un montage de filtration sous vide
 Exercices sur le thème II : Les savons - DGEM
Exercices sur le thème II : Les savons - DGEM
a) Ecrire l’équation-bilan de saponification de l’oléine par la soude b) Calculer la masse d’oléine saponifiée c) En déduire la masse d’oléate de sodium que l’on peut obtenir Données : acide palmitique : C15H31COOH acide oléique : C17H33COOH glycérol : HOCH2 - CHOH - CH2OH Masses molaires atomiques en g mol-1: M
 Feuille d’exercices n°7 : Cinétique chimique
Feuille d’exercices n°7 : Cinétique chimique
Exercice 5 : Saponification de l’éthanoate d’éthyle : La saponification de l’éthanoate d’éthyle est d’ordre 1 par rapport à chacun des réactifs Dans un mélange stœchiométrique où les réactifs ont chacun une concentration initiale égale à 20 10-3 mol L1 on suit le
 Cette épreuve est constituée de trois exercices Elle
Cette épreuve est constituée de trois exercices Elle
2 2- Ecrire l’équation de la saponification de l’oléine 2 3- Donner le nom systématique du composé (G) 2 4- Déterminer la masse du savon obtenu sachant que le rendement de la réaction est 95 2 5- L’ion oléate présente deux parties : une hydrophile et l’autre lipophile Indiquer ces deux parties sur la formule de cet ion
Comment calculer la saponification ?
- La saponification est la réaction inverse (hydrolyse) mais en milieu basique. Au lieu de l’acideéthanoïque, on obtient sa base conjuguée c'est-à-dire l’ion éthanoate (CH3COO-). L’équation complète est : a) CH3-COO(CH2)3CH3 +HO-? CH3COO- + CH3-CH2-CH2-CH2-OH.
Quel est l'indice de saponification d'un triglycéride pur ?
- L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique. Déterminer la masse molaire du triglycéride et sa structure. Reponse6
Quel est l’indice de saponification d’une huile?
- Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535. Quel est le triglycéride présent dans l’huile ?
Quel est le mécanisme de formation de l’ion ammonium ?
- Extrait du sujet du Bac des Centres étrangers, 2013 Exercice 3 2.3. (0,5 pt) Mécanisme de formation de l’ion ammonium : L’atome d’azote est un site donneur de doublet d’électrons. Le proton H+ avec sa charge positive est un site accepteur de doublet d’électrons.
Classe de TS Partie C-Chap 13
Chimie Correction exercices
1 O OCorrection des exercices du chapitre 13
Exercice n°8 p 298 :
1. Premier procédé :
a. L"équation de la réaction s"écrit : C2H5-COOH + CH3-CH2-OH = C2H5-COO-C2H5 + H2O
Cette réaction est lente et limitée.
b. Masse de propanoate d"éthyle formé : On calcul tout d"abord les quantités de matières des réactifs mis en présence : molMmn acac ac20.01*616*212*38.14=++==
molMmn alal al20.061612*22.9=++==
Les deux réactifs ont été introduit en proportions stoechiométriques. Vu l"équation dela réaction, le nombre de mole d"ester formé correspond au nombre de moles d"acides ou d"alcool ayant réagit : On peut évaluer le nombre de mole d"acide ayant réagit : molnnnntresacacréagitacforméester13.007.020.0616*212*32.520.0
tan=-=++-=-==Pour calculer la masse d"ester formée :
mester = nester formé × Mester = 0.13 × (5*12 + 2*16 + 10*1) = 13.3 g2. Premier procédé :
a. L"équation de la réaction s"écrit alors : C2H5-C-O-C-C2H5 + CH3-CH2-OH ® C2H5-COO-C2H5 + C2H5-COOH
Cette réaction est rapide et totale : en effet, la réaction ne produisant pas d"eau mais un acide
carboxylique, l"hydrolyse de l"ester formé n"est pas possible, on évite la réaction inverse. b. Nous devons calculer la quantité de matière d"anhydride introduite : molMmn anhanh anh19.01*1016*312*625=++==
La réaction étant totale, il se forme 0.19 mole d"ester. Ce qui donne : mester = nester formé × Mester = 0.19 × (5*12 + 2*16 + 10*1) = 19.4 gExercice n°18 p 300/301 :
a. Généralement lorsque l"on chauffe les réactifs d"une réaction chimique, c"est pour augmenter la
vitesse de la réaction dans laquelle ils interviennent.Le chauffage à reflux permet de
ne pas perdre de matière lors du chauffage. b.Le relargage est l"étape qui permet de faire précipiter le savon, en effet, celui-ci est très peu soluble
dans de l"eau salée saturée en chlorure de sodium. c.Dans les données, on nous indique que l"oléine est un triester du propan-1,2,3-triol (glycérol) et de
l"acide oléique :Donc on forme l"oléine par la réaction :
Classe de TS Partie C-Chap 13
Chimie Correction exercices
2 Savon O O CH2-OH + 3 C17H33-COOH = CH2-O-CO-C17H33 + 3 H2O
CH-OH CH-O-CO-C
17H33 CH2-OH CH2-O-CO-C17H33
d.Réaction de saponification de l"oléine :
CH2-O-CO-R + 3 (Na+ + OH-) ® 3 (Na+ + R-COO-) + CH2-OH
CH-O-CO-R CH-OH
CH2-O-CO-R CH2-OH
e.Masse maximal de savon que l"on peut obtenir :
Quantité de matière d"ions hydroxyde introduite : molVcn16.010*200.831=´=´=-
Quantité de matière d"oléine introduite : molMVn oléineoléineoléine011.08841190.02=´=´=r
On sait qu"une mole d"oléine réagit avec trois moles de soude :053.03
1=n alors que 011.01
2=n donc l"oléine est le réactif limitant.
Ainsi, quand une mole d"oléine réagit, elle donne naissance à trois moles de savons : m savon = 3×noléine×Msavon = 3×0.011×(23 + 17*12 + 33*1 + 1*12 + 2*16) = 10 gExercice n°21 p 302 :
1. Etude du protocole :
a. Montage expérimental utilisé pour la fabrication de l"aspirine : b. Mesure d"un volume précis d"un réactif dangereux : On peut mesurer précisément le volume d"anhydride : ✔ Soit avec deux pipettes jaugées de 10mL puis 2mL enS"aidant de la propipette.
✔ Soit on utilise l"éprouvette graduée de 25 mL. ✔ Au cours de la manipulation, l"expérimentateur veilleraA porter des
gants en latex et des lunettes de protection en plus de la blouse indispensable pour toute manipulation de chimie. c.Lorsque l"on ajoute de l"eau en fin de réaction, on effectue l"hydrolyse de l"excès d"anhydride
éthanoïque, selon la réaction :
CH3-C-O-C-CH3 + H2O = 2 CH3COOH
Les vapeurs acides sont des vapeurs d"acide éthanoïque. d. En recristallisant plusieurs fois un produit, on le purifie.Oléine
Eau froide
6g d"acide salicylique
12mL d"anhydride éthanoïque
10 gouttes d"acide sulfurique concentré
3 grains de pierre ponce
Classe de TS Partie C-Chap 13
Chimie Correction exercices
3 O O O2. Identification du produit fabriqué :
a.Calculs de rapports frontaux :
42.065.2
1.11==Rf 42.065.2
1.12==Rf 57.065.2
5.1 3==Rf b.On peut en déduire :
De la compraison de S
1 et S2 que le produit que 'on a synthétisé est bien de l"aspirine et de la
comparaison de S1 et S3 que notre poduit synthétisé ne contient plus d"acide salicylique.
3. Détermination du rendement de la synthèse :
a. CH3-C-O-C-CH3 + ® O C CH3 + CH3COOH
b. Quantité de matière des réactifs utilisées :Pour l"anhydride :
molM Vn anh13.01021208.1=´=´=r
Pour l"acide salicylique :
molM mn ac043.01380.6===
c.Comme ces réactifs réagissent mole à mole, le réactif limitant est l"acide salicylique, l"anhydride
est en excès. On peut donc fabriquer théoriquement 0.043 mol d"aspirine avec ces quantités de départ.
d. Rendement de la synthèse : La quantité en masse d"aspirine obtenue correspond à une quantité de matière de : n obtenue = mol029.0180 2.5=Le rendement est donc :
%67043.0029.0=== théoriqueobtenuennh O OH C OH O C OHquotesdbs_dbs11.pdfusesText_17[PDF] exercices corrigés sciences industrielles pcsi pdf
[PDF] exercices corrigés servlets java
[PDF] exercices corrigés soncas
[PDF] exercices corrigés spectroscopie d'absorption atomique
[PDF] exercices corrigés spectroscopie infrarouge
[PDF] exercices corrigés spectroscopie rmn
[PDF] exercices corrigés spectroscopie uv visible pdf
[PDF] exercices corrigés spss
[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
