 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction des exercices du chapitre 13. Exercice n°8 p 298 : 1. Premier Réaction de saponification de l'oléine : CH2-O-CO-R. + 3 (Na. +. + OH. -. ) → 3 ...
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ▻ Exercice n°1. 1) Ecrire l'équation de la réaction de 1) Ecrire l'équation de la réaction de saponification d'un triglycéride par la soude.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
2.2- Ecrire l'équation de la saponification de l'oléine. 2.3- Donner le nom Corrigé. Note. 1.1. Comme l'acide chlorhydrique est en excès les termes qui ...
 Untitled
Untitled
La saponification est une réaction entre une base forte et un triglycéride; elle permet d'obtenir du savon et du glycérol. EXERCICE 3. 3.1. 3.2. (05 points).
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
Exercice 6: L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras
 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Indiquer les et corriger. II-Dosage du lait. À l'aide de la solution La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Corrigés TD lipides
Corrigés TD lipides
Exercice 6 : Les indices d'acide et de saponification d'un corps gras ont été déterminés en dosant avec un acide (Ve ml normalité
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) ... e- indice de saponification du lipide (Is) est défini comme étant la masse de KOH (en mg) nécessaire à ...
 Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Exercice 1 : les savons. Question s. Réponses attendues. 1.1. La réaction se nomme saponification. 1.2. La réaction est totale ( c'est un hydrolyse en milieu
 TD N°2: Structure des lipides
TD N°2: Structure des lipides
Exercice 4: Une huile est formée d'un triglycéride homogène dont l'indice de saponification est égal à 570. Quel est l'acide gras présent dans cette huile
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ? Exercice n°1 1) Ecrire l'équation de saponification de la palmitine et donner les caractéristiques intéressantes de cette réaction.
 EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Indice de saponification et masse molaire d'un triacylglycérol (difficile à ... X = I x M? mg de KOH pour saponifier 1mole de lipide.
 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Cette épreuve est constituée de trois exercices. La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Untitled
Untitled
La saponification est une réaction utilisée pour préparer les savons à partir des CORRIGE. Epreuve du 1er groupe cissdoro.e-monsite.com. EXERCICE 1.
 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction exercices. 1. O O. Correction des exercices du chapitre 13. Exercice n°8 p 298 : Réaction de saponification de l'oléine : CH2-O-CO-R.
 Synthèse dun savon – Réaction de saponification Thème Santé
Synthèse dun savon – Réaction de saponification Thème Santé
Sous l'action de la soude concentrée à chaud
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
L'ordre décroissant d'indice de saponification est : Tributyrine- Dioléobutyrine-Tripalmitine – Dioléopalmitine-trilinolénine- trioléine. Exercice 2:.
 TP6 – Cinétique dune saponification
TP6 – Cinétique dune saponification
TP6 – Cinétique d'une saponification. Réalisation préalable d'un bilan de matière. • Une réaction pour modéliser la transformation de l'ester…
 Chapitre chimie N°8: Les savons
Chapitre chimie N°8: Les savons
La réaction qui permet de fabriquer un savon est une réaction de saponification. 1) Rappel: Réaction d'hydrolyse d'un ester.
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) a- Le nom de l'oligoside est ... nécessaire à la saponification de 1g de corps gras ou de lipide.
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
Saponification des esters - correction Correction Ex1 et Ex2 EX1: réactions de saponification 2-Nommer A B C D et E Corrigé: 1-a/ Rappel: soit la formule générale d’un ester Cet ester provient de la réaction d’estérification en milieu acide entre l’acide carboxylique R-COOH et un alcool R’-OH
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59 L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique Déterminer la masse molaire du triglycéride et sa structure Reponse6 Is (mg) 1g
 UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
Exercice 7 : Relation entre indice de saponification et masse molaire d’un triacylglycérol Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535 Quel est le triglycéride présent dans l’huile ? PM KOH = 56 Solution exercice 7 : TG + 3 KOH ----- glycérol + 3 savons
 Chapitre C7 Transformation en chimie organique Programme
Chapitre C7 Transformation en chimie organique Programme
Mécanisme réactionnel de la saponification : Il se décompose en trois étapes 3ème étape : réaction acido-basique entre l’anion alcoolate et l’acide carboxylique Correction 1 Extrait du sujet de Bac S Métropole 2013 Septembre Exercice 2 http://labolycee org/menugeo php?s=1&annee=2013&pays=Metropole&rattrap=1 2 3
 TP Chimie 11 Saponification TS I Principe du TP 1
TP Chimie 11 Saponification TS I Principe du TP 1
1 Écrire l’équation de la réaction de saponification en considérant que l’huile utilisée est un triester de l'acide oléique de formule brute C 18 H34 O2 Donner le nom et les formules semi-développées des réactifs et des produits
 Solution du TD 1 - F2School
Solution du TD 1 - F2School
saponification) Absorbent la lumière dans l’ultraviolet: Pas les acides gras saturés Pas les acides gras monoinsaturés Uniquement les acides gras polyinsaturés et qui ont en plus des doubles liaisons conjuguées S’oxydent spontanément au contact de l’oxygène de l’air: Uniquement les acides gras insaturés
 EX1: Exemples de réactions de saponification
EX1: Exemples de réactions de saponification
2/Ecrire l’équation-bilan de la réaction de saponification et déterminer la quantité de chacun des réactifs introduits dans le ballon (masse volumique de l’ester: mester=105g mL -1 ) 3/Ecrire l’équation bilan de la réaction qui se produit lors de l’ajout de la solution acide
 Synthèse d’un savon – Réaction de saponification Thème Santé
Synthèse d’un savon – Réaction de saponification Thème Santé
T P 17 : Synthèse d’un savon –Réaction de saponification Thème Santé Les objectifs de ce TP sont de : suivre un protocole de synthèse en respectant les consignes de sécurité réaliser un montage de chauffage à reflux réaliser un montage de filtration sous vide
 Exercices sur le thème II : Les savons - DGEM
Exercices sur le thème II : Les savons - DGEM
a) Ecrire l’équation-bilan de saponification de l’oléine par la soude b) Calculer la masse d’oléine saponifiée c) En déduire la masse d’oléate de sodium que l’on peut obtenir Données : acide palmitique : C15H31COOH acide oléique : C17H33COOH glycérol : HOCH2 - CHOH - CH2OH Masses molaires atomiques en g mol-1: M
 Feuille d’exercices n°7 : Cinétique chimique
Feuille d’exercices n°7 : Cinétique chimique
Exercice 5 : Saponification de l’éthanoate d’éthyle : La saponification de l’éthanoate d’éthyle est d’ordre 1 par rapport à chacun des réactifs Dans un mélange stœchiométrique où les réactifs ont chacun une concentration initiale égale à 20 10-3 mol L1 on suit le
 Cette épreuve est constituée de trois exercices Elle
Cette épreuve est constituée de trois exercices Elle
2 2- Ecrire l’équation de la saponification de l’oléine 2 3- Donner le nom systématique du composé (G) 2 4- Déterminer la masse du savon obtenu sachant que le rendement de la réaction est 95 2 5- L’ion oléate présente deux parties : une hydrophile et l’autre lipophile Indiquer ces deux parties sur la formule de cet ion
Comment calculer la saponification ?
- La saponification est la réaction inverse (hydrolyse) mais en milieu basique. Au lieu de l’acideéthanoïque, on obtient sa base conjuguée c'est-à-dire l’ion éthanoate (CH3COO-). L’équation complète est : a) CH3-COO(CH2)3CH3 +HO-? CH3COO- + CH3-CH2-CH2-CH2-OH.
Quel est l'indice de saponification d'un triglycéride pur ?
- L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique. Déterminer la masse molaire du triglycéride et sa structure. Reponse6
Quel est l’indice de saponification d’une huile?
- Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535. Quel est le triglycéride présent dans l’huile ?
Quel est le mécanisme de formation de l’ion ammonium ?
- Extrait du sujet du Bac des Centres étrangers, 2013 Exercice 3 2.3. (0,5 pt) Mécanisme de formation de l’ion ammonium : L’atome d’azote est un site donneur de doublet d’électrons. Le proton H+ avec sa charge positive est un site accepteur de doublet d’électrons.
Classes : SV
Cette épreuve est constituée de trois exercices. Elle comporte quatre pages numérotées de 1 à 4.
Exercice I: Préparation du savon (6 points)
A) oléine qui est le triester du glycérol et de oléique. a- Écrire la formule semi-développée du glycérol (propan -1, 2,3-triol) b- Loléique a pour formule C17H33COOH. Sa chaine carbonée est linéaire et présente une double liaison entre les atomes de carbone 9 et 10, qui adopte la configuration Z. donner sa formule développée en faisant apparaitre la stéréochimie. B) On a préparé oléate de sodium, en faisant réagir dans ses conditions appropriées, oléine avec la quantité suffisante de soude. a- Comment appelle-t-on la réaction réalisée ? b- Écrire son équation bilan. Quel oléate de sodium. ?c- La réaction a été réalisée en chauffant pendant un certain temps a ébullition.que peut-on dire de
cette réaction ? d- Loléate est qua En se référant a la structure de cet anion, expliquer le sens de ce terme et les particularités e- Les caractéristiques oléate importante -il ? C) après avoir laissé oléate de sodium sécher, on a recueilli 9.5 g de ce produit. a- C.b- Calculer le rendement de la réaction. Quelle autre caractéristique peut-on attribuer à la réaction
M (oléate de sodium) = 304g. mol-1 M (oléine) = 884 g.mol-1Exercice II : Acide lactique ( 7 points )
Le lactose est le sucre présent dans le lait. Ce lactique ou acide 2-hydroxypropanoique.A) 1-a- Écrire la formule développée
b- Entourer et nommer les groupes fonctionnels présents.2- a- Cette molécule est-elle chirale ?justifier la réponse ?
b-Donner la représentation spatiale conventionnelle de deux énantiomères.B) Le but de ce problème état
Si la teneur de cet acide dépasse 5g.L-1, le lait caille.I- Préparation
On veut préparer une solution 0.5mol/L de NaOH de volume 200 mL. Pour cela, on pèse 4,2 g de sodium. On met cette masse dans un bécher de 200 mL. Onjusqu'à 200 mL et on dissout les pastilles totalement .on laisse le flacon contenant cette solution
éprouvette graduée
dilue jusqu'à 200 mL. atmosphère contient du gaz carbonique qui peut réagir lentement avec hydroxyde de sodium. Cette expérience comporte 4 fautes ou imprécisionsIndiquer les et corriger.
II-Dosage du lait
À diluée (0.05 mol/L).on dose par pH-mètre, 20 mL du lait. On obtient les valeurs suivantes :V de la
soude en mL0 2 4 6 8 10 11
pH 2.6 3.2 3.6 3.9 4.2 4.6 5.2V de la
soude en mL11.5 12 12.5 13 14 16
pH 6.3 8 10.5 11 11.3 11.61- Tracer le graphe pH= f(Vb)
2- Écrire équation du dosage
3- Téquivalence et le point demi-équivalent
4- Déduire :
a- l b- le pKa du couple acide lactique / ion lactate. c- la constante de la réaction du dosage d- e- indiqétat du lait.5- Justifier qualitativement le pH à équivalence en étudiant la composition du mélange a
Donnes : masses en g/mol :
M(C) =12. M(O)=16 M(H)=1Exercice III : dosage
Objectif : On se propose de vérifier, par un dosage,a 500 mg. Donnes :
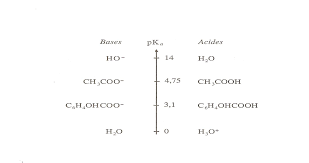
acétylsalicylique, de formule brute C9H8O4 a pour formule développée : - : M(C9H8O4) = 180 g/molH2O/HO- :14 H3O-/H2O :0 CH3CO2H/CH3CO-
2 : 4.75 (couples acide acétiques / ion acétate) C6H4OHCO2H/C6H4OHCO2- :3.1 (couple
acide salicylique / ion salicylate ) - À acétylsalicylique réagit avec les ions hydroxyde HO- équation- bilan (1) : Réaction que écrire de façon plus simple sous la forme : C8H7O2CO2H + 2HO- ĺ6H4OHCO-2 + CH3CO2- + H2O ( 1) aspirine ion salicylateA) la molécule
1- Reproduire sur la copie la formule moléculaire développée Identifier et
nommer deux fonctions oxygénées présentes dans la molécule et les encadrer sur le dessin.
2- Lion des ions HO- équation-bilan (1)) met en jeu deux types de réactions
chimiques : lesquels ?Préciser pour chacun la fonction concernée.3- Que peut-on dire de chacune de ces réactions au niveau cinétique ?
B) dosprincipe :
Pour la raison évoquée précédemment, on effectue un dosage indirect, c.-à-d. réagir
quantité - connue, mais en excès excès des ions hydroxyde qui est ensuite dosé par une solution titréeProtocole :
- Un comprimé broyé est mélangé1.0 mol/L. le tout est chauffe a reflux pendant une quinzaine de minutes puis refroidi.
- Après refroidissement, on verse le milieu réactionnel précédent dans une fiole jaugée de 200 mL,
et on complète distillée, on agite, on a ainsi obtenu une solution (S). - Pour déterminer excès -Exploitation :
1- Placer sur une échelle de pKa les couples acide/base correspondant aux espèces chimiques
présentés dans la solution (S).2- Calculer la quantité - initialement mélangée aspirine broyé.
3- Écrire équation bilan support du dosage, désignée par réaction (2).calculer la quantité
HO- dosée
4- en déduire la quantité - qui restait en excès dans la solution (S), après réaction avec
5- en déduire la quantité - consommée par la réaction (1) et en vous
équation bilan de cette réaction calculer la quantité acétylsalicylique présente dans le comprime .conclure. Année scolaire : 10/11 Matière : ChimieClasses : SV
Barème
Exercice I:
1-A) a- CH2OH - CHOH-CH2OH
b- CH3 - (CH2)7 -C=C-(CH2)7 - COOH H HB) a) saponification
b) C17H33-COO-CH2 CH2OH
C17H33-COO-CH + 3(Na+ + HO-) ї 3 (C17H33-COO- ; Na+ ) + CHOHC17H33-COO-CH2 CH2OH
Le glycérol ou propan - 1,2,3-triol
c)la réaction est lente a la température ambiante. Le chauffage a ébullition est utilisé pour
l'accĠlérer.d) la réaction C17H33 - de l'anion olĠate est hydrophobe et lipophile, c'est ă dire elle n'a pas
d'affinitĠ pour l'eau et a de l'affinitĠ pour les lipides.La partie -COO- est hydrophile et lipophobe, c'est-à-dire elle a de l'affinitĠ pour l'eau et n[
amphiphilee) l'anion olĠate est utilisĠ comme saǀon pour son action dĠtergente, cΖest-à-dire son
action de nettoyer des salissures, la peau, différents objets, surfaces, tissus m= 304.3.10/884 = 10,32 g. b) rendement : R = 9,5 . 100/ 10,32 = 92,1 % La valeur du rendement montre que la réaction de saponification est totale, aux erreurs expérimentales près.Exercice II :
A)1-a-b-
H , OH , CH3 , COOH
Il y a un seul atome de carbone asymétrique et la molécule est chirale.b- les deux énantiomères sont schématisées l'un de l'autre par rapport à un plan (ou
image l'un de l'autre dans un miroir). les deux énantiomères de l'acide sont représentés ci-
dessous avec la représentation selon Cram:B) Preparation de la solution
masse nécessaire : on doit utiliser une fiole jaugée de 200 mL et pas un bécher. on ne doit pas laisser le flacon ouvert pour ne pas réagir avec le CO2 de l'air. pour doser 20 mL on doit utiliser une pipette jaugée et non pas une éprouvette.II- dosage du lait.
Par NaOH : ( 0,05 mol/L).
On dose 20 mL de lait par NaOH
1- pH = f ( Vb)
2- équation du dosage : soit l'acide lactique HA: HA + HO- ї A- + H2O
demi-équivalent est trouve par le point ouVNaOH = Veq (NaOH) /2
Point équivalent ( 12 mL ; 8 )
Point ½ équivalent ( 6 mL ; 3,9 )
= n (base) donc CaVa =CbVbE ;Ca = 0,05.10-3 .12/20 .10-3 = 0,03 mol/L
b- le pKa du couple acide lactique / ion lactate. VbE/2 = Veq /2 = 12/2 = 6 mL, correspond graphiquement à pH ½ équivalent = 3,9 = pKa c-la constante de la réaction du dosage. KR = [A-] / [HA][OH-] = [A-]/[HA][OH-] . [H3O+]/[H3O+] = Ka/ Ke = 10-3,9/10-14 = 1010,1KR = 1,26 . 1010 ޓ
d- Cс nͬV , n с mͬM , d'ou C с mͬMVDonc M = 90 g/mol
m = C.M.V = 0,03 . 90 . 1 = 2,7 g e-état du lait.Donc la concentration sera 2,7 g/L < 5 g/L
Donc le lait ne caille pas.
5 - pH équivalent :
Le pH eq = 8
La base conjuguée A-
L'ion spectateur Na+ de l'eau
neutres.Exercice III :
les deux fonctions demandées ou les groupes fonctionnels correspondants sont encadrés et nommés ci-dessous L'aspirine par sa fonction acide donne avec HO- une réaction acide-base de type:RCOOH + HO- ї RCOO- + H2O
Par sa fonction ester l'aspirine donne aussi aǀec HO- une réaction de saponification de type :RCOOR' + HO- ї RCOO- + R'OH
* dosage : exploitation 1-2- n (OH-) = C (NaOH) . V (NaOH) = 10-3.10.1 = 10-2 mol = 10 mmol car NaOH est une base
forte se dissocie totalement dans l'eau.NaOH) = [HO-]3- équation bilan : H3O+ + OH- ї 2 H2O
n (HO- ) réagit = CaVaE = 2.10-3 .10,9.10-3 =2,18 .104 = 0,218 mmol.4 - n(HO-) restant : Durant la dilution n est conservé
n (reagi) = Crestant . V restant n(HO-) restant = nS . Vf/ VS = 0,218 .200 .10-3/ 10-3 .10 = 4,36 mmol.5 - n (HO- ) restant = n(HO-)intial - n (HO-) reagi = 10 -4,36 = 5,64 mmol.
n (aspirine) = n(HO-)/ 2 = 5,64 /2 = 2,82 mmol =2,82 .10-3 mol. (R.S) Conclusion ѐ m = m impure - m pure/ m impure =( 508 -500 / 500 ) .100 = 1,5 %.quotesdbs_dbs11.pdfusesText_17[PDF] exercices corrigés sciences industrielles pcsi pdf
[PDF] exercices corrigés servlets java
[PDF] exercices corrigés soncas
[PDF] exercices corrigés spectroscopie d'absorption atomique
[PDF] exercices corrigés spectroscopie infrarouge
[PDF] exercices corrigés spectroscopie rmn
[PDF] exercices corrigés spectroscopie uv visible pdf
[PDF] exercices corrigés spss
[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
