 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction des exercices du chapitre 13. Exercice n°8 p 298 : 1. Premier Réaction de saponification de l'oléine : CH2-O-CO-R. + 3 (Na. +. + OH. -. ) → 3 ...
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ▻ Exercice n°1. 1) Ecrire l'équation de la réaction de 1) Ecrire l'équation de la réaction de saponification d'un triglycéride par la soude.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
2.2- Ecrire l'équation de la saponification de l'oléine. 2.3- Donner le nom Corrigé. Note. 1.1. Comme l'acide chlorhydrique est en excès les termes qui ...
 Untitled
Untitled
La saponification est une réaction entre une base forte et un triglycéride; elle permet d'obtenir du savon et du glycérol. EXERCICE 3. 3.1. 3.2. (05 points).
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
Exercice 6: L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras
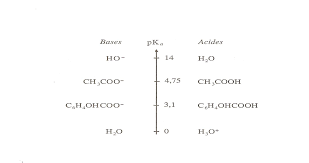 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Indiquer les et corriger. II-Dosage du lait. À l'aide de la solution La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Corrigés TD lipides
Corrigés TD lipides
Exercice 6 : Les indices d'acide et de saponification d'un corps gras ont été déterminés en dosant avec un acide (Ve ml normalité
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) ... e- indice de saponification du lipide (Is) est défini comme étant la masse de KOH (en mg) nécessaire à ...
 Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Exercice 1 : les savons. Question s. Réponses attendues. 1.1. La réaction se nomme saponification. 1.2. La réaction est totale ( c'est un hydrolyse en milieu
 TD N°2: Structure des lipides
TD N°2: Structure des lipides
Exercice 4: Une huile est formée d'un triglycéride homogène dont l'indice de saponification est égal à 570. Quel est l'acide gras présent dans cette huile
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ? Exercice n°1 1) Ecrire l'équation de saponification de la palmitine et donner les caractéristiques intéressantes de cette réaction.
 EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Indice de saponification et masse molaire d'un triacylglycérol (difficile à ... X = I x M? mg de KOH pour saponifier 1mole de lipide.
 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Cette épreuve est constituée de trois exercices. La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Untitled
Untitled
La saponification est une réaction utilisée pour préparer les savons à partir des CORRIGE. Epreuve du 1er groupe cissdoro.e-monsite.com. EXERCICE 1.
 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction exercices. 1. O O. Correction des exercices du chapitre 13. Exercice n°8 p 298 : Réaction de saponification de l'oléine : CH2-O-CO-R.
 Synthèse dun savon – Réaction de saponification Thème Santé
Synthèse dun savon – Réaction de saponification Thème Santé
Sous l'action de la soude concentrée à chaud
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
L'ordre décroissant d'indice de saponification est : Tributyrine- Dioléobutyrine-Tripalmitine – Dioléopalmitine-trilinolénine- trioléine. Exercice 2:.
 TP6 – Cinétique dune saponification
TP6 – Cinétique dune saponification
TP6 – Cinétique d'une saponification. Réalisation préalable d'un bilan de matière. • Une réaction pour modéliser la transformation de l'ester…
 Chapitre chimie N°8: Les savons
Chapitre chimie N°8: Les savons
La réaction qui permet de fabriquer un savon est une réaction de saponification. 1) Rappel: Réaction d'hydrolyse d'un ester.
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) a- Le nom de l'oligoside est ... nécessaire à la saponification de 1g de corps gras ou de lipide.
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
Saponification des esters - correction Correction Ex1 et Ex2 EX1: réactions de saponification 2-Nommer A B C D et E Corrigé: 1-a/ Rappel: soit la formule générale d’un ester Cet ester provient de la réaction d’estérification en milieu acide entre l’acide carboxylique R-COOH et un alcool R’-OH
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59 L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique Déterminer la masse molaire du triglycéride et sa structure Reponse6 Is (mg) 1g
 UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
Exercice 7 : Relation entre indice de saponification et masse molaire d’un triacylglycérol Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535 Quel est le triglycéride présent dans l’huile ? PM KOH = 56 Solution exercice 7 : TG + 3 KOH ----- glycérol + 3 savons
 Chapitre C7 Transformation en chimie organique Programme
Chapitre C7 Transformation en chimie organique Programme
Mécanisme réactionnel de la saponification : Il se décompose en trois étapes 3ème étape : réaction acido-basique entre l’anion alcoolate et l’acide carboxylique Correction 1 Extrait du sujet de Bac S Métropole 2013 Septembre Exercice 2 http://labolycee org/menugeo php?s=1&annee=2013&pays=Metropole&rattrap=1 2 3
 TP Chimie 11 Saponification TS I Principe du TP 1
TP Chimie 11 Saponification TS I Principe du TP 1
1 Écrire l’équation de la réaction de saponification en considérant que l’huile utilisée est un triester de l'acide oléique de formule brute C 18 H34 O2 Donner le nom et les formules semi-développées des réactifs et des produits
 Solution du TD 1 - F2School
Solution du TD 1 - F2School
saponification) Absorbent la lumière dans l’ultraviolet: Pas les acides gras saturés Pas les acides gras monoinsaturés Uniquement les acides gras polyinsaturés et qui ont en plus des doubles liaisons conjuguées S’oxydent spontanément au contact de l’oxygène de l’air: Uniquement les acides gras insaturés
 EX1: Exemples de réactions de saponification
EX1: Exemples de réactions de saponification
2/Ecrire l’équation-bilan de la réaction de saponification et déterminer la quantité de chacun des réactifs introduits dans le ballon (masse volumique de l’ester: mester=105g mL -1 ) 3/Ecrire l’équation bilan de la réaction qui se produit lors de l’ajout de la solution acide
 Synthèse d’un savon – Réaction de saponification Thème Santé
Synthèse d’un savon – Réaction de saponification Thème Santé
T P 17 : Synthèse d’un savon –Réaction de saponification Thème Santé Les objectifs de ce TP sont de : suivre un protocole de synthèse en respectant les consignes de sécurité réaliser un montage de chauffage à reflux réaliser un montage de filtration sous vide
 Exercices sur le thème II : Les savons - DGEM
Exercices sur le thème II : Les savons - DGEM
a) Ecrire l’équation-bilan de saponification de l’oléine par la soude b) Calculer la masse d’oléine saponifiée c) En déduire la masse d’oléate de sodium que l’on peut obtenir Données : acide palmitique : C15H31COOH acide oléique : C17H33COOH glycérol : HOCH2 - CHOH - CH2OH Masses molaires atomiques en g mol-1: M
 Feuille d’exercices n°7 : Cinétique chimique
Feuille d’exercices n°7 : Cinétique chimique
Exercice 5 : Saponification de l’éthanoate d’éthyle : La saponification de l’éthanoate d’éthyle est d’ordre 1 par rapport à chacun des réactifs Dans un mélange stœchiométrique où les réactifs ont chacun une concentration initiale égale à 20 10-3 mol L1 on suit le
 Cette épreuve est constituée de trois exercices Elle
Cette épreuve est constituée de trois exercices Elle
2 2- Ecrire l’équation de la saponification de l’oléine 2 3- Donner le nom systématique du composé (G) 2 4- Déterminer la masse du savon obtenu sachant que le rendement de la réaction est 95 2 5- L’ion oléate présente deux parties : une hydrophile et l’autre lipophile Indiquer ces deux parties sur la formule de cet ion
Comment calculer la saponification ?
- La saponification est la réaction inverse (hydrolyse) mais en milieu basique. Au lieu de l’acideéthanoïque, on obtient sa base conjuguée c'est-à-dire l’ion éthanoate (CH3COO-). L’équation complète est : a) CH3-COO(CH2)3CH3 +HO-? CH3COO- + CH3-CH2-CH2-CH2-OH.
Quel est l'indice de saponification d'un triglycéride pur ?
- L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique. Déterminer la masse molaire du triglycéride et sa structure. Reponse6
Quel est l’indice de saponification d’une huile?
- Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535. Quel est le triglycéride présent dans l’huile ?
Quel est le mécanisme de formation de l’ion ammonium ?
- Extrait du sujet du Bac des Centres étrangers, 2013 Exercice 3 2.3. (0,5 pt) Mécanisme de formation de l’ion ammonium : L’atome d’azote est un site donneur de doublet d’électrons. Le proton H+ avec sa charge positive est un site accepteur de doublet d’électrons.
Révisions 1BCPST
Partie VIII - Cinétique
TP6 ʹ Cinétique d'une saponification
Réalisation préalable d'un bilan de matièreLe protocole met en jeu une solution d'ester (l'acétate d'éthyle) et une solution d'hydroxyde de sodium. D'après le cours,
l'hydrolyse basique d'un ester est modélisée par la réaction dont l'équation s'écrit :
L'outil du bilan de matière est le tableau d'avancement, ici dressé en concentration (mol.L-1) :
Introduit ܥ ܥ Ͳ Ͳ ܥ
En cours ܥȂݔ ܥȂݔ ݔ ݔ ܥ Mélange 50 mL d'une solution aqueuse à la concentration " 2C0 » en ester avec 50 mL d'une solution aqueuse à la concentration " 2C0 » en hydroxyde de sodium revient à opérer une dilution par 2. La concentration initiale dans le mélange pour l'ester comme pour l'hydroxyde de sodium est C0. En particulier, on remarque qu'à un instant t quelconque, Rappel sur la détermination d'ordres cinétiques par la méthode intégraleLa méthode la plus utilisée pour déterminer l'ordre d'une réaction est la méthode intégrale.
1. Formuler une hypothèse sur la valeur de cet ordre,
2. Intégrer la loi de vitesse dans cette hypothèse pour obtenir une loi modèle d'évolution de la concentration en réactif,
3. Mesurer au cours du temps la valeur de cette concentration par une méthode physique (fréquent) ou chimique (rare
car fastidieux),4. Confronter, au moyen d'une construction graphique, les prévisions du modèle et les mesures réalisées pour valider ou
infirmer l'hypothèse sur l'ordre de la réaction.5. Si l'hypothèse d'ordre s'avère non valide, il convient soit de questionner le protocole d'acquisition et la précision des
mesures effectuées, soit de formuler une nouvelle hypothèse sur l'ordre recherché.Choix de conditions opératoires
La loi cinétique proposée pour l'hydrolyse basique des esters est de la forme :Premier point d'attention : la dépendance de la " constante » de vitesse avec la température oblige à opérer à température fixée
afin de traiter k(T) comme une constante, et ainsi diminuer le nombre de variables à prendre en compte.
-2-En pratique, le réacteur est immergé dans un grand volume d'eau afin de limiter les variations de sa température : plus
le volume d'eau est important, plus le transfert thermique entraînant une variation de sa température devra être
Second point d'attention : lorsque la loi de vitesse imaginée s'écrit au moyen de plusieurs concentrations, il convient de réaliser
un mélange des réactifs qui permette de simplifier l'écriture de la loi de vitesse. Deux méthodes expérimentales sont possibles :
Dégénérescence de l'ordre : consiste à introduire en grand excès l'un des réactifs afin de considérer sa concentration
comme constante au cours de la transformation. En pratique, sa concentration dans le mélange doit être au minimum
10 fois supérieure à celle des autres réactifs intervenant dans la loi de vitesse),
Dans l'activité proposée, l'ester et l'ion hydroxyde sont introduits en même concentration afin de travailler dans les
déterminer l'ordre global de la réaction.Élaboration du modèle cinétique
Dans l'activité proposée, il est proposé d'envisager un ordre global égal à 2 : Expression issue de la définition de la vitesse Loi modèle postuléeIntégration
La validation de la loi cinétique passe par une construction graphique. Si l'évolution temporelle de l'hydrolyse basique de l'ester
peut être modélisée par une réaction d'ordre global 2, alors le tracé de ଵCoefficient directeur positif dont la valeur est celle de la constante de vitesse k à la température de l'expérience,
Ordonnée à l'origine positive ଵ
Choix d'une méthode de suivi
stopper l'évolution du système par trempe, puis à déterminer la concentration par titrage. La méthode s'avère lourde si l'on
souhaite obtenir au moins une dizaine de valeurs de concentrations.Il est préférable d'opter pour une méthode physique consistant en la détermination d'une grandeur physique (absorbance,
conductivité, pH, pression, etc.) dont la valeur renseigne, directement ou indirectement, sur la concentration recherchée.
-3-Sur le plan de la composition ionique du système, l'hydrolyse basique de l'ester revient à consommer un ion hydroxyde HO- et à
créer un ion acétate. La conductivité de la solution varie donc à mesure que la transformation avance. La conductimétrie s'avère
ici une méthode intéressante. Dans le cas d'un suivi de l'évolution du système chimique par une méthode physique, il convient d'exprimer la grandeur physique en fonction de l'avancement de la réaction au moyen des lois modèles disponibles :Kollrausch pour la conductivité,
Beer-Lambert pour l'absorbance,
Relation d'état des gaz parfaits pour la pression totale.Les valeurs des conductivités ioniques ߣ
réalisation de l'expérience, il faut trouver un moyen de les déterminer. A cet effet, il est utile d'exprimer la grandeur physique aux limites temporelles de l'évolution du système (instant initial et au bout d'un temps infini en faisant l'hypothèse d'une transformation totale). Ce conseil s'applique aux suivis par spectrophotométrie et par mesure de pression.Au bout d'un temps infini
(en faisant l'hypothèse d'une transformation totale)C(t) = Cь = 0
condition de disposer de valeurs pour les conductivités aux limites, ߪ et ߪ -4-Mesure des conductivités aux limites
Conductivité initiale :
Le tableau d'avancement permet de retrouver la composition de l'instant initial. Les seuls ions présents y sont les ions sodium et hydroxyde, tous deux à la concentration " mère » d'hydroxyde de sodium de concentration 2C0 et de mesurer sa conductivité. Il est également possible de mesurer la conductivité de la solution mère et de la diviser par 2 puisque celle-ci est proportionnelle aux concentrations. Conductivité au bout d'un temps infini dans l'hypothèse d'une transformation totale :Cette détermination est facile, mais l'hypothèse de transformation totale peut être non vérifiée. L'hydrolyse basique des
esters est réputée lente mais quasi-totale. En laissant le mélange des réactifs évoluer pendant plusieurs jours, on peut
espérer obtenir une valeur approchée de ߪ Validation du modèle à partir des mesures réaliséesLes points du tracé de ଵ
Regressi fournit les résultats suivants pour la régression linéaire :Validation :
Les résidus ne font pas apparaître une répartition aléatoire des points expérimentaux de part et d'autre de la droite de
régression : ils sont d'abord touts en-dessous, puis tous au-dessus, puis tous en-dessous : il est donc raisonnable de ne
pas conclure à une adaptation parfaite du modèle pour rendre compte des résultats expérimentaux.
-5- Pourquoi le coefficient de corrélation n'est-il pas un argument robuste pour la validation d'un modèle affine ? Le coefficient de corrélation est un indicateur de l'éloignement des points expérimentaux à la droite de régression obtenue par la méthode des moindres carrés. A ce titre, le coefficient ne permet pas de dire que des points expérimentaux peuventêtre considérés comme alignés.
En effet, deux répartitions très différentes peuvent conduire à des coefficients de corrélation identiques : Il est donc important, avant de réaliser une régression linéaire sur la calculatrice, de s'assurer visuellement du caractère raisonnablement affine de la distribution.Regressi fournit un critère de validation plus robuste : les résidus, c'est-à-dire les écarts
en ordonnée entre un point expérimental et la droite de régression. En complément d'une pré-validation visuelle, si le signe des résidus est aléatoire, alors le modèle affine peut être validé, s'il existe des tendances dans les signes des résidus, alors le modèle ne peutêtre raisonnablement accepté.
En admettant que le modèle d'une cinétique d'ordre 2 soit accepté, alors le coefficient directeur de la droite est
évaluation de l'énergie d'activation.
quotesdbs_dbs11.pdfusesText_17[PDF] exercices corrigés sciences industrielles pcsi pdf
[PDF] exercices corrigés servlets java
[PDF] exercices corrigés soncas
[PDF] exercices corrigés spectroscopie d'absorption atomique
[PDF] exercices corrigés spectroscopie infrarouge
[PDF] exercices corrigés spectroscopie rmn
[PDF] exercices corrigés spectroscopie uv visible pdf
[PDF] exercices corrigés spss
[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
