 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction des exercices du chapitre 13. Exercice n°8 p 298 : 1. Premier Réaction de saponification de l'oléine : CH2-O-CO-R. + 3 (Na. +. + OH. -. ) → 3 ...
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ▻ Exercice n°1. 1) Ecrire l'équation de la réaction de 1) Ecrire l'équation de la réaction de saponification d'un triglycéride par la soude.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
2.2- Ecrire l'équation de la saponification de l'oléine. 2.3- Donner le nom Corrigé. Note. 1.1. Comme l'acide chlorhydrique est en excès les termes qui ...
 Untitled
Untitled
La saponification est une réaction entre une base forte et un triglycéride; elle permet d'obtenir du savon et du glycérol. EXERCICE 3. 3.1. 3.2. (05 points).
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
Exercice 6: L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras
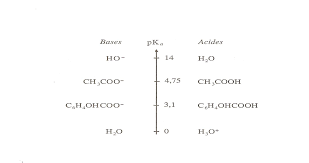 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Indiquer les et corriger. II-Dosage du lait. À l'aide de la solution La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Corrigés TD lipides
Corrigés TD lipides
Exercice 6 : Les indices d'acide et de saponification d'un corps gras ont été déterminés en dosant avec un acide (Ve ml normalité
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) ... e- indice de saponification du lipide (Is) est défini comme étant la masse de KOH (en mg) nécessaire à ...
 Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Exercice 1 : les savons. Question s. Réponses attendues. 1.1. La réaction se nomme saponification. 1.2. La réaction est totale ( c'est un hydrolyse en milieu
 TD N°2: Structure des lipides
TD N°2: Structure des lipides
Exercice 4: Une huile est formée d'un triglycéride homogène dont l'indice de saponification est égal à 570. Quel est l'acide gras présent dans cette huile
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ? Exercice n°1 1) Ecrire l'équation de saponification de la palmitine et donner les caractéristiques intéressantes de cette réaction.
 EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Indice de saponification et masse molaire d'un triacylglycérol (difficile à ... X = I x M? mg de KOH pour saponifier 1mole de lipide.
 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Cette épreuve est constituée de trois exercices. La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Untitled
Untitled
La saponification est une réaction utilisée pour préparer les savons à partir des CORRIGE. Epreuve du 1er groupe cissdoro.e-monsite.com. EXERCICE 1.
 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction exercices. 1. O O. Correction des exercices du chapitre 13. Exercice n°8 p 298 : Réaction de saponification de l'oléine : CH2-O-CO-R.
 Synthèse dun savon – Réaction de saponification Thème Santé
Synthèse dun savon – Réaction de saponification Thème Santé
Sous l'action de la soude concentrée à chaud
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
L'ordre décroissant d'indice de saponification est : Tributyrine- Dioléobutyrine-Tripalmitine – Dioléopalmitine-trilinolénine- trioléine. Exercice 2:.
 TP6 – Cinétique dune saponification
TP6 – Cinétique dune saponification
TP6 – Cinétique d'une saponification. Réalisation préalable d'un bilan de matière. • Une réaction pour modéliser la transformation de l'ester…
 Chapitre chimie N°8: Les savons
Chapitre chimie N°8: Les savons
La réaction qui permet de fabriquer un savon est une réaction de saponification. 1) Rappel: Réaction d'hydrolyse d'un ester.
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) a- Le nom de l'oligoside est ... nécessaire à la saponification de 1g de corps gras ou de lipide.
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
Saponification des esters - correction Correction Ex1 et Ex2 EX1: réactions de saponification 2-Nommer A B C D et E Corrigé: 1-a/ Rappel: soit la formule générale d’un ester Cet ester provient de la réaction d’estérification en milieu acide entre l’acide carboxylique R-COOH et un alcool R’-OH
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59 L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique Déterminer la masse molaire du triglycéride et sa structure Reponse6 Is (mg) 1g
 UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
Exercice 7 : Relation entre indice de saponification et masse molaire d’un triacylglycérol Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535 Quel est le triglycéride présent dans l’huile ? PM KOH = 56 Solution exercice 7 : TG + 3 KOH ----- glycérol + 3 savons
 Chapitre C7 Transformation en chimie organique Programme
Chapitre C7 Transformation en chimie organique Programme
Mécanisme réactionnel de la saponification : Il se décompose en trois étapes 3ème étape : réaction acido-basique entre l’anion alcoolate et l’acide carboxylique Correction 1 Extrait du sujet de Bac S Métropole 2013 Septembre Exercice 2 http://labolycee org/menugeo php?s=1&annee=2013&pays=Metropole&rattrap=1 2 3
 TP Chimie 11 Saponification TS I Principe du TP 1
TP Chimie 11 Saponification TS I Principe du TP 1
1 Écrire l’équation de la réaction de saponification en considérant que l’huile utilisée est un triester de l'acide oléique de formule brute C 18 H34 O2 Donner le nom et les formules semi-développées des réactifs et des produits
 Solution du TD 1 - F2School
Solution du TD 1 - F2School
saponification) Absorbent la lumière dans l’ultraviolet: Pas les acides gras saturés Pas les acides gras monoinsaturés Uniquement les acides gras polyinsaturés et qui ont en plus des doubles liaisons conjuguées S’oxydent spontanément au contact de l’oxygène de l’air: Uniquement les acides gras insaturés
 EX1: Exemples de réactions de saponification
EX1: Exemples de réactions de saponification
2/Ecrire l’équation-bilan de la réaction de saponification et déterminer la quantité de chacun des réactifs introduits dans le ballon (masse volumique de l’ester: mester=105g mL -1 ) 3/Ecrire l’équation bilan de la réaction qui se produit lors de l’ajout de la solution acide
 Synthèse d’un savon – Réaction de saponification Thème Santé
Synthèse d’un savon – Réaction de saponification Thème Santé
T P 17 : Synthèse d’un savon –Réaction de saponification Thème Santé Les objectifs de ce TP sont de : suivre un protocole de synthèse en respectant les consignes de sécurité réaliser un montage de chauffage à reflux réaliser un montage de filtration sous vide
 Exercices sur le thème II : Les savons - DGEM
Exercices sur le thème II : Les savons - DGEM
a) Ecrire l’équation-bilan de saponification de l’oléine par la soude b) Calculer la masse d’oléine saponifiée c) En déduire la masse d’oléate de sodium que l’on peut obtenir Données : acide palmitique : C15H31COOH acide oléique : C17H33COOH glycérol : HOCH2 - CHOH - CH2OH Masses molaires atomiques en g mol-1: M
 Feuille d’exercices n°7 : Cinétique chimique
Feuille d’exercices n°7 : Cinétique chimique
Exercice 5 : Saponification de l’éthanoate d’éthyle : La saponification de l’éthanoate d’éthyle est d’ordre 1 par rapport à chacun des réactifs Dans un mélange stœchiométrique où les réactifs ont chacun une concentration initiale égale à 20 10-3 mol L1 on suit le
 Cette épreuve est constituée de trois exercices Elle
Cette épreuve est constituée de trois exercices Elle
2 2- Ecrire l’équation de la saponification de l’oléine 2 3- Donner le nom systématique du composé (G) 2 4- Déterminer la masse du savon obtenu sachant que le rendement de la réaction est 95 2 5- L’ion oléate présente deux parties : une hydrophile et l’autre lipophile Indiquer ces deux parties sur la formule de cet ion
Comment calculer la saponification ?
- La saponification est la réaction inverse (hydrolyse) mais en milieu basique. Au lieu de l’acideéthanoïque, on obtient sa base conjuguée c'est-à-dire l’ion éthanoate (CH3COO-). L’équation complète est : a) CH3-COO(CH2)3CH3 +HO-? CH3COO- + CH3-CH2-CH2-CH2-OH.
Quel est l'indice de saponification d'un triglycéride pur ?
- L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique. Déterminer la masse molaire du triglycéride et sa structure. Reponse6
Quel est l’indice de saponification d’une huile?
- Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535. Quel est le triglycéride présent dans l’huile ?
Quel est le mécanisme de formation de l’ion ammonium ?
- Extrait du sujet du Bac des Centres étrangers, 2013 Exercice 3 2.3. (0,5 pt) Mécanisme de formation de l’ion ammonium : L’atome d’azote est un site donneur de doublet d’électrons. Le proton H+ avec sa charge positive est un site accepteur de doublet d’électrons.
Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l'Académie de Toulouse
Fiche d'exercices "Elève" pour la classe de Terminale SMS page 1CTSMEX02.DOC T.SMS ~ Chimie 02 ~
1/6 Antenne de TARBES 01/05/00
Exercices sur le thème II : Les savons
EXERCICE 1.
1. L'oléine, composé le plus important de l'huile d'olive, est le triglycéride de l'acide oléique.
L'oléine s'obtient à partir de l'acide oléique de formule semi-développée plane par la réaction chimique d'équation-bilan ci-après : acide oléique + A + B (équation (1)). oléine a) Préciser les noms et les formules semi-développées des composés A et B .b) Réécrire, en utilisant les formules semi-développées des corps intervenant, l'équation-bilan
équilibrée de formation de l'oléine (équation (1)).2. Peut-on hydrogéner l'oléine ? Justifier.
Si oui, écrire l'équation-bilan d'hydrogénation de l'oléine.3. On chauffe longuement un mélange d'oléine et de lessive de soude (Na+
+ OH a) Quel est le nom d'une telle réaction entre l'oléine et la lessive de soude ? b) L'équation-bilan de cette réaction s'écrit : oléine + soude oléate de sodium + glycérol (équation (2)). L'oléate de sodium a pour formule semi-développée plane : C 17 H 33-COO + Na * Quelle est l'utilisation pratique de l'oléate de sodium ? * Réécrire, en utilisant les formules semi-développées planes des corps intervenant, l'équation-bilan équilibrée de formation de l'oléate de sodium (équation (2)).
4. On veut fabriquer 1 kg d'oléate de sodium. Quelle masse d'oléine faut-il utiliser pour ce faire,
sachant que la réaction (2) est totale ?Données : Masses molaires moléculaires :
M(oléine) = 884 g.mol-1
M(oléate de sodium) = 304 g.mol
-1 . O IIC 17 H 33-C-OH II OC 17 H 33
- C - O - CH 2 II OC17 H 33
- C - O - CH 2 II OC 17 H 33
- C - O - CH
Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l'Académie de Toulouse
Fiche d'exercices "Elève" pour la classe de Terminale SMS page 2 CTSMEX02.DOC T.SMS ~ Chimie 02 ~ 2/6 Antenne de TARBES 01/05/00EXERCICE 2.
Données :
M C = 12 g.mol -1 ; M N = 14 g.mol -1 ; M H = 1 g.mol -1 ; M O = 16 g.mol -1 M Na = 23 g.mol -1 ; MOleine
= 884 g.mol -1 Formule semi-développée plane de l'oléine1. Quel groupe fonctionnel reconnaissez-vous dans la molécule
d'oléine ?2. Quelle est la formule générale d'un savon ?
3. Quel est le nom de la réaction qui permet de fabriquer un
savon à partir d'un corps gras ? Est-elle totale ?4. On souhaite fabriquer du savon à partir d'oléine et d'hydroxyde de sodium encore appelé soude,
de formule (Na + OH ). Ecrire l'équation-bilan de la réaction.5. Quelle est la masse d'oléine nécessaire pour réagir complètement avec d'hydroxyde de
sodium, la réaction étant totale ?EXERCICE 3.
Données : Masses molaires atomiques (en g.mol
-1 ) : H : 1; C : 12; O : 16; Na : 23. M oléine = 884 g.mol -1 Dans une savonnerie, on fabrique des pains de savon à partir de différents corps gras naturels contenant des triglycérides. Parmi ceux-ci se trouve notamment de l'huile d'olive constituée principalement d'oléine.1. Qu'appelle-t-on triglycéride ?
2. L'oléine ou trioléate de glycéryle a pour formule
En déduire la formule de l'acide oléique.
3. Lors de la fabrication du savon, on procède à la saponification de l'oléine. On utilise pour cela
une solution de soude (ou hydroxyde de sodium) très concentrée, appelée lessive de soude, et on
obtient, entre autres, le savon de formule (Na + C 17 H 33CO 2 a) Ecrire l'équation-bilan de la saponification de l'oléine. b) Nommer les produits obtenus. c) A la fin de la préparation du savon, on le verse dans de l'eau très salée (relargage).
A quoi sert cette opération ?
d) Calculer la masse de savon obtenu à partir de 3,54 kg d'oléine. II O C 17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH
Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l'Académie de Toulouse
Fiche d'exercices "Elève" pour la classe de Terminale SMS page 3 CTSMEX02.DOC T.SMS ~ Chimie 02 ~ 3/6 Antenne de TARBES 01/05/00EXERCICE 4.
Données
: Volume d'une mole de gaz dans les conditions de l'expérience V 0 = 22,4 L.mol -1La molécule d'oléine, de masse molaire
moléculaire M = 884 g.mol -1 , a pour formule semi-développée plane : La molécule de stéarine a pour formule semi- développée plane :1. Définir un triglycéride.
2. En vous servant des données indiquer si l'oléine est un triglycéride saturé ou insaturé. Justifier
votre réponse.3. On transforme l'oléine en stéarine par hydrogénation.
Ecrire l'équation-bilan de cette réaction chimique.4. Une huile A contient de l'oléine et de la stéarine. On transforme un échantillon de d'huile
A en stéarine pure en lui faisant absorber 11,2 litres de dihydrogène gazeux. Calculer le nombre de moles de dihydrogène utilisé.5. En déduire le nombre de moles d'oléine dans l'échantillon.
6. Calculer la masse de cette oléine.
7. Calculer le pourcentage d'oléine dans l'huile A.
EXERCICE 5.
1. Un savon est un composé chimique qui contient l'ion carboxylate. Ecrire la formule de cet ion.
2. Ecrire la formule semi-développée du savon dérivé de l'acide oléique, sachant que ce savon
comporte l'ion sodium. Quel est le nom chimique de ce savon ?Donnée :
acide oléique : C 17 H 33COOH .
3. a) Définir les termes : hydrophobe et hydrophile.
b) Le stéarate de sodium a pour formule : CH 3 -(CH 2 16 -COO + Na Entourer les parties hydrophobe et hydrophile de ce savon. c) Expliquer succinctement, en vous aidant éventuellement de schémas, l'attaque d'une salissure grasse à la surface d'un tissu par une solution savonneuse. II O C 17 H 35- C - O - CH 2
II O C
17 H 35- C - O - CH 2
II O C
17 H 35- C - O - CH
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH
Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l'Académie de Toulouse
Fiche d'exercices "Elève" pour la classe de Terminale SMS page 4 CTSMEX02.DOC T.SMS ~ Chimie 02 ~ 4/6 Antenne de TARBES 01/05/00EXERCICE 6.
1. Un savon est un composé comportant l'ion carboxylate Indiquer le pôle hydrophile et
le pôle hydrophobe.2. L'huile de palme est un mélange de triglycérides : la palmitine (tripalmitate de glycéryle) et
l'oléine (trioléate de glycéryle). a) Qu'appelle-t-on triglycéride ? b) Ecrire la formule semi-développée de la palmitine.3. On saponifie 500 kg d'huile de palme, contenant en masse 30 % d'oléine, par une solution
aqueuse de soude (hydroxyde de sodium). Sachant que la formule semi-développée de l'oléine est a) Ecrire l'équation-bilan de saponification de l'oléine par la soude. b) Calculer la masse d'oléine saponifiée. c) En déduire la masse d'oléate de sodium que l'on peut obtenir.Données :
acide palmitique : C 15 H 31COOH acide oléique : C 17 H 33
COOH glycérol : HOCH 2 - CHOH - CH 2 OH
Masses molaires atomiques en g.mol
-1 : M (H) = 1; M (C) = 12; M (O) = 16; M (Na) = 23Masse molaire de l'oléine : M
(oléine) = 884 g.mol -1EXERCICE 7.
L'oléate de sodium est un savon de formule (C
17 H 33COO + Na
1. Reproduire la formule et encadrer l'ion carboxylate de ce savon.
2. Préciser, sur la formule, les pôles hydrophobe et hydrophile de ce savon.
3. L'oléate de sodium a été obtenu en saponifiant par
l'hydroxyde de sodium (ou soude) le trioléate de glycéryle de formule semi-développée a) Ecrire l'équation-bilan de la réaction de saponification. b) Quelle masse, m (s) , de savon peut-on obtenir en saponifiant 1 tonne d'huile contenant 90 % en masse de trioléate de glycéryle ou oléine ?Données :
Masses molaires atomiques (en g.mol
-1 ) : C : 12; H : 1; O : 16; Na : 23Masse molaire de l'oléine : 884 g.mol
-1Formule de l'acide oléique : C
17 H 33-COOH. R -C-O O
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH 2
II O C
17 H 33- C - O - CH
Document pédagogique mis à la libre disposition de tous par le groupe Sciences Physiques de l'Académie de Toulouse
Fiche d'exercices "Elève" pour la classe de Terminale SMS page 5 CTSMEX02.DOC T.SMS ~ Chimie 02 ~ 5/6 Antenne de TARBES 01/05/00EXERCICE 8.
L'oléine est un triglycéride de formule semi- développée plane1. Entourer, dans la formule de l'oléine que
vous aurez reproduite sur la copie, les groupes fonctionnels esters.2. L'oléine est obtenue à partir de l'acide oléique et du glycérol.
2.1. La formule semi-développée plane du glycérol est :
Encadrer dans la formule du glycérol que vous aurez recopiée sur votre copie les groupes fonctionnels représentant la fonction alcool.2.2. A partir de la formule semi-développée plane de l'oléine, retrouver et écrire la formule
semi-développée plane de l'acide oléique. Cet acide gras est-il saturé ou insaturé ? Justifier la réponse.3. L'hydrogénation de l'oléine, d'après l'équation-bilan ci-après, conduit à la stéarine.
3.1. Quel est le volume de dihydrogène nécessaire à l'hydrogénation de d'oléine dans
des conditions où le volume molaire vaut V m = 22,4 L.mol -1La masse molaire de l'oléine est M = 884 g.mol
-1 et la réaction est supposée totale.3.2. Calculer la masse de stéarine, de masse molaire 890 g.mol
-1 , produite au cours de la réaction d'hydrogénation précédente effectuée avec un rendement de 100 %. CH 3 -(CH 2 7 -CH=CH-(CH 2 7 - C - O - CH 2 CH 3 -(CH 2 7 -CH=CH-(CH 2 7 - C - O - CH 2 II OII O II O CH
3 -(CH 2 7 -CH=CH-(CH 2 7 - C - O - CH + 3 H 2II O C
17 H 35- C - O - CH 2
II O C
17 H 35- C - O - CH 2
II O C
17 H 35- C - O - CH CH 3 -(CH 2 7 -CH=CH-(CH 2 7 - C - O - CH 2 CHquotesdbs_dbs7.pdfusesText_13
[PDF] exercices corrigés sciences industrielles pcsi pdf
[PDF] exercices corrigés servlets java
[PDF] exercices corrigés soncas
[PDF] exercices corrigés spectroscopie d'absorption atomique
[PDF] exercices corrigés spectroscopie infrarouge
[PDF] exercices corrigés spectroscopie rmn
[PDF] exercices corrigés spectroscopie uv visible pdf
[PDF] exercices corrigés spss
[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
