 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction des exercices du chapitre 13. Exercice n°8 p 298 : 1. Premier Réaction de saponification de l'oléine : CH2-O-CO-R. + 3 (Na. +. + OH. -. ) → 3 ...
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ▻ Exercice n°1. 1) Ecrire l'équation de la réaction de 1) Ecrire l'équation de la réaction de saponification d'un triglycéride par la soude.
 Cette épreuve est constituée de trois exercices. Elle comporte
Cette épreuve est constituée de trois exercices. Elle comporte
2.2- Ecrire l'équation de la saponification de l'oléine. 2.3- Donner le nom Corrigé. Note. 1.1. Comme l'acide chlorhydrique est en excès les termes qui ...
 Untitled
Untitled
La saponification est une réaction entre une base forte et un triglycéride; elle permet d'obtenir du savon et du glycérol. EXERCICE 3. 3.1. 3.2. (05 points).
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
Exercice 6: L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras
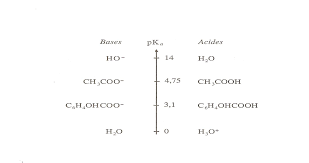 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Indiquer les et corriger. II-Dosage du lait. À l'aide de la solution La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Corrigés TD lipides
Corrigés TD lipides
Exercice 6 : Les indices d'acide et de saponification d'un corps gras ont été déterminés en dosant avec un acide (Ve ml normalité
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) ... e- indice de saponification du lipide (Is) est défini comme étant la masse de KOH (en mg) nécessaire à ...
 Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Correction du devoir n°8 Exercice 1 : les savons Exercice 2
Exercice 1 : les savons. Question s. Réponses attendues. 1.1. La réaction se nomme saponification. 1.2. La réaction est totale ( c'est un hydrolyse en milieu
 TD N°2: Structure des lipides
TD N°2: Structure des lipides
Exercice 4: Une huile est formée d'un triglycéride homogène dont l'indice de saponification est égal à 570. Quel est l'acide gras présent dans cette huile
 Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Thème : Chimie organique et industrielle Fiche 8 : Contrôle de
Fiche Exercices. ? Exercice n°1 1) Ecrire l'équation de saponification de la palmitine et donner les caractéristiques intéressantes de cette réaction.
 EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Point de fusion (facile: cours) - Ecrire les formules
EXERCICE 1. Indice de saponification et masse molaire d'un triacylglycérol (difficile à ... X = I x M? mg de KOH pour saponifier 1mole de lipide.
 10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
10/11 Matière : Chimie Classes : SV Exercice I: Préparation du
Cette épreuve est constituée de trois exercices. La valeur du rendement montre que la réaction de saponification est totale aux erreurs.
 Untitled
Untitled
La saponification est une réaction utilisée pour préparer les savons à partir des CORRIGE. Epreuve du 1er groupe cissdoro.e-monsite.com. EXERCICE 1.
 Correction des exercices du chapitre 13
Correction des exercices du chapitre 13
Correction exercices. 1. O O. Correction des exercices du chapitre 13. Exercice n°8 p 298 : Réaction de saponification de l'oléine : CH2-O-CO-R.
 Synthèse dun savon – Réaction de saponification Thème Santé
Synthèse dun savon – Réaction de saponification Thème Santé
Sous l'action de la soude concentrée à chaud
 TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
TD. LIPIDES - 1ere année chirurgie dentaire Exercice 1: A-Classer
L'ordre décroissant d'indice de saponification est : Tributyrine- Dioléobutyrine-Tripalmitine – Dioléopalmitine-trilinolénine- trioléine. Exercice 2:.
 TP6 – Cinétique dune saponification
TP6 – Cinétique dune saponification
TP6 – Cinétique d'une saponification. Réalisation préalable d'un bilan de matière. • Une réaction pour modéliser la transformation de l'ester…
 Chapitre chimie N°8: Les savons
Chapitre chimie N°8: Les savons
La réaction qui permet de fabriquer un savon est une réaction de saponification. 1) Rappel: Réaction d'hydrolyse d'un ester.
 Corrigé de lexamen de Biochimie (2017)
Corrigé de lexamen de Biochimie (2017)
4 févr. 2017 Exercice N° 1 : LES GLUCIDES (35 pts) a- Le nom de l'oligoside est ... nécessaire à la saponification de 1g de corps gras ou de lipide.
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
Saponification des esters - correction Correction Ex1 et Ex2 EX1: réactions de saponification 2-Nommer A B C D et E Corrigé: 1-a/ Rappel: soit la formule générale d’un ester Cet ester provient de la réaction d’estérification en milieu acide entre l’acide carboxylique R-COOH et un alcool R’-OH
 Saponification des esters - correction - ACCESMAD
Saponification des esters - correction - ACCESMAD
L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59 L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique Déterminer la masse molaire du triglycéride et sa structure Reponse6 Is (mg) 1g
 UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
UNIVERSITE CADI AYYAD FACULTE DES SCIENCES - F2School
Exercice 7 : Relation entre indice de saponification et masse molaire d’un triacylglycérol Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535 Quel est le triglycéride présent dans l’huile ? PM KOH = 56 Solution exercice 7 : TG + 3 KOH ----- glycérol + 3 savons
 Chapitre C7 Transformation en chimie organique Programme
Chapitre C7 Transformation en chimie organique Programme
Mécanisme réactionnel de la saponification : Il se décompose en trois étapes 3ème étape : réaction acido-basique entre l’anion alcoolate et l’acide carboxylique Correction 1 Extrait du sujet de Bac S Métropole 2013 Septembre Exercice 2 http://labolycee org/menugeo php?s=1&annee=2013&pays=Metropole&rattrap=1 2 3
 TP Chimie 11 Saponification TS I Principe du TP 1
TP Chimie 11 Saponification TS I Principe du TP 1
1 Écrire l’équation de la réaction de saponification en considérant que l’huile utilisée est un triester de l'acide oléique de formule brute C 18 H34 O2 Donner le nom et les formules semi-développées des réactifs et des produits
 Solution du TD 1 - F2School
Solution du TD 1 - F2School
saponification) Absorbent la lumière dans l’ultraviolet: Pas les acides gras saturés Pas les acides gras monoinsaturés Uniquement les acides gras polyinsaturés et qui ont en plus des doubles liaisons conjuguées S’oxydent spontanément au contact de l’oxygène de l’air: Uniquement les acides gras insaturés
 EX1: Exemples de réactions de saponification
EX1: Exemples de réactions de saponification
2/Ecrire l’équation-bilan de la réaction de saponification et déterminer la quantité de chacun des réactifs introduits dans le ballon (masse volumique de l’ester: mester=105g mL -1 ) 3/Ecrire l’équation bilan de la réaction qui se produit lors de l’ajout de la solution acide
 Synthèse d’un savon – Réaction de saponification Thème Santé
Synthèse d’un savon – Réaction de saponification Thème Santé
T P 17 : Synthèse d’un savon –Réaction de saponification Thème Santé Les objectifs de ce TP sont de : suivre un protocole de synthèse en respectant les consignes de sécurité réaliser un montage de chauffage à reflux réaliser un montage de filtration sous vide
 Exercices sur le thème II : Les savons - DGEM
Exercices sur le thème II : Les savons - DGEM
a) Ecrire l’équation-bilan de saponification de l’oléine par la soude b) Calculer la masse d’oléine saponifiée c) En déduire la masse d’oléate de sodium que l’on peut obtenir Données : acide palmitique : C15H31COOH acide oléique : C17H33COOH glycérol : HOCH2 - CHOH - CH2OH Masses molaires atomiques en g mol-1: M
 Feuille d’exercices n°7 : Cinétique chimique
Feuille d’exercices n°7 : Cinétique chimique
Exercice 5 : Saponification de l’éthanoate d’éthyle : La saponification de l’éthanoate d’éthyle est d’ordre 1 par rapport à chacun des réactifs Dans un mélange stœchiométrique où les réactifs ont chacun une concentration initiale égale à 20 10-3 mol L1 on suit le
 Cette épreuve est constituée de trois exercices Elle
Cette épreuve est constituée de trois exercices Elle
2 2- Ecrire l’équation de la saponification de l’oléine 2 3- Donner le nom systématique du composé (G) 2 4- Déterminer la masse du savon obtenu sachant que le rendement de la réaction est 95 2 5- L’ion oléate présente deux parties : une hydrophile et l’autre lipophile Indiquer ces deux parties sur la formule de cet ion
Comment calculer la saponification ?
- La saponification est la réaction inverse (hydrolyse) mais en milieu basique. Au lieu de l’acideéthanoïque, on obtient sa base conjuguée c'est-à-dire l’ion éthanoate (CH3COO-). L’équation complète est : a) CH3-COO(CH2)3CH3 +HO-? CH3COO- + CH3-CH2-CH2-CH2-OH.
Quel est l'indice de saponification d'un triglycéride pur ?
- L'indice de saponification d'un triglycéride pur est égal à 196 et son indice d'iode à 59. L'analyse chromatographique de ses acides gras constitutifs révèle qu'il s'agit d'acide palmitique et d'acide oléique. Déterminer la masse molaire du triglycéride et sa structure. Reponse6
Quel est l’indice de saponification d’une huile?
- Une huile est formée d’un triglycéride homogène saturé dont l’indice de saponification est égal à 535. Quel est le triglycéride présent dans l’huile ?
Quel est le mécanisme de formation de l’ion ammonium ?
- Extrait du sujet du Bac des Centres étrangers, 2013 Exercice 3 2.3. (0,5 pt) Mécanisme de formation de l’ion ammonium : L’atome d’azote est un site donneur de doublet d’électrons. Le proton H+ avec sa charge positive est un site accepteur de doublet d’électrons.
Solution du TD Lipides
Exercice 1:
La lécithine est le nom usuel de la phosphatidylcholine.La réaction de saponification de la lécithine est la suivante. L'hydrolyse alcaline coupe les liaisons
esters (indiquées par la double flèche )ņF2F&+2
ņņņ O LécithineŇOE
CH2 ņņņņ2 ņ2 ņ+ ņ3)3
OH + 5 KOH2 ņ-K+ + ņ2 + K3PO4 + ņ2 ņ2 ņ+ ņ
(CH3)3 Savon ņ Phosphate de potassium CholineņCH2
Glycérol
Distribution des différents composés entre la phase aqueuse et la phase chloroformique: Tous les composés obtenus sont solubles dans l'eau.Savons
Phosphate de potassium
Glycérol
Choline
Phase supérieure:
Chloroforme
Phase inférieure:
eau 2Après acidification:
- ņ-K+ ņ Les acides gras sont insolubles dans l'eau, ils passent dans la phase chloroformique - Le phosphate de potassium se transforme en acide phosphorique (H3PO4), soluble dans l'eau - La choline et le glycérol ne vont pas changer. Ils restent dans la phase aqueuse.Acides gras
Phosphate de potassium
Glycérol
Choline
Intérêt de l'expérience:
On peut séparer les deux phases, évaporer le chloroforme et obtenir les acides gras libres qui estérifiaient la lécithine pour pouvoir les analyser.Exercice 2:
La chromatographie de partage est une technique de séparation des molécules d'un mélange. Elle utilise une phase stationnaire (fixe) et une phase mobile. Les molécules ou solutés vontse séparer selon leur affinité pour la phase mobile ou pour la phase stationnaire. Ceux qui ont
une affinité pour la phase stationnaire vont être retenus, retardés par contre ceux qui ont une
affinité pour la phase mobile seront entrainés.La trioléine est un triglycéride homogène (le même acide gras, l'acide oléique C18:1 estérifie les
trois fonctions alcool du glycérol). Elle est apolaire et non chargée.La phosphatidylcholine est polaire et chargée.
Si à pH=7 la phosphatidylcholine n'est pas chargée et la trioléine n'étant pas chargée aussi,
l'électrophorèse ne peut pas séparer ces deux molécules. Même si c'était le cas, les deux molécules
étant d'une part de petite taille, d'autre part la trioléine est insoluble dans l'eau, l'électrophorèse est
difficilement applicable car il faut un milieu aqueux pour le champ électrique. Par contre, la Chromatographie sur Couche Mince (CCM) va très bien les séparer. En effet, laphosphatidylcholine est très polaire et insoluble dans l'éther donc elle ne va pas migrer du tout.
Elle va rester au dépôt car elle va être adsorbée par la silice (phase stationnaire). La trioléine étant
apolaire et soluble dans l'éther elle va migrer avec celui-ci (phase mobile).Phase supérieure:
Chloroforme
Phase inférieure:
eau 3Exercice 3:
Les différents lipides vont migrer selon leur polarité et leur solubilité dans la phase mobile.
La polarité est l'existence dans la molécule d'au moins deux régions différentes dans l'espace.
Exemple: une chaîne hydrocarbonée, une fonction alcool, une fonction acide carboxylique, une cétone, un groupement phosphate PO4, un groupement azoté NH2Ainsi ceux qui sont polaires vont s'adsorber sur la silice qui est polaire. Les très polaires ne vont pas
bouger ou peu. Ceux qui sont apolaires vont se solubiliser dan la phase mobile et migrer avec elle. front de solvantLigne de dépôt
CE TG AG DG CL MG PL Mélange
Témoins
CE et TG: très apolaires: très longues chaînes hydrocarbonées masquant les oxygènes avec absence
de fonctions libres AG : légèrement apolaire: Une chaîne hydrocarbonées et une fonction COOH libreDG et CL: légèrement polaires: Longues chaînes hydrocarbonées et présence d'une seule fonction
OH libre
MG : moyennement polaires: Deux chaînes hydrocarbonées et deux fonctions OH libresPL : très polaires: Deux chaînes hydrocarbonées, un groupement phosphate (PO4) et un
groupement azoté N+(CH3)3.Exercice 4:
Graines oléagineuses: contiennent de l'huile (tournesol, colLes huiles sont constituées de presque 100% de triglycérides. Elles peuvent contenir de très faibles
quantités d'autres lipides (phospholipides, stérols libres et estérifiés, acides gras libres, diglycérides,
monoglycérideCholestérol estérifié (CE)
Triglycérides (TG)
Acides gras libres (AG)
Diglycérides (DG)
Cholestérol libre (CL)
Monoglycérides (MG)
Phospholipides (PL)
restent au dépôtPlaque CCM
41. Extraction des lipides totaux:
On peut extraire l'huile par pression des graines (en utilisant des presses appropriées). Mais, la
pression ne permet pas l'extraction de la totalité des lipides. Elle laisse entre 4 à 12% dans les
tourteaux (graines déshuilées).Donc pour extraire la totalité des lipides, il faut d'abord broyer les graines pour détruire les
membranes cellulaires et réduire les distances pour accélérer la diffusion de l'huile.Ensuite, il faut utiliser un solvant qui permettra l'extraction de tous les lipides (polaires et apolaires).
Si on utilise l'hexane (solvant apolaire), les lipides polaires ne seront pas extraits (exemple: les phospholipides). On utilisera donc le mélange de Folch composé de chloroforme et de méthanol dans les proportions 2:1.Ensuite, il faut filtrer pour se débarrasser des tourteaux. L'évaporation des solvants par chauffage
permettra enfin de récupérer les lipides totaux.Cette méthode peut être utilisée au laboratoire pour n'importe quel tissu animal ou végétal contenant
des lipides. On peut remplacer le mélange de Folch par des solvants apparentés (éthanol-2. Séparation des phospholipides des triglycérides
L'extrait lipidique ainsi obtenu contient des triglycérides et des phospholipides. Pour séparer ces deux composés, on peut utiliser deux méthodes: - Méthode 1: ajouter à l'extrait lipidique 2 à 3% d'eau, mélanger vigoureusement pendant10 à 15 minutes à froid puis centrifuger. Les phospholipides hydratables vont précipiter
et se retrouver dans la phase aqueuse. Le rendement de cette séparation n'est pas toujours très élevé (on isole 50 à 80% des phospholipides)- Méthode 2: Solubiliser l'extrait lipidique dans l'acétone à froid (4°C) pendant au moins 8
heures. Les phospholipides (et les sphingolipides s'ils sont présents) vont précipiter. Les triglycérides (et les autres lipides) vont rester en solution dans l'acétone. En filtrant, les phospholipides vont être retenus et les triglycérides vont se retrouver dans le filtrat.Exercice 5:
: Uniquement les acides gras insaturés grâce à leurs doubles liaisons : Les deux Donnent avec la soude un composé amphiphatique (càd pôle hydrophobe et pôle : Les deux: formations de savons (réaction de saponification) : Pas les acides gras saturés. Pas les acides gras monoinsaturés. Uniquement les acides gras polyinsaturés et qui ont en plus des doubles liaisons conjuguées : Uniquement les acides gras insaturés 5Exercice 6:
- Relation de l'indice d'acide Ia: Le dosage des acides gras libres peut se faire directement (KOH dan la burette, l'huile solubilisée dan l'alcool plus l'indicateur dans le becher). KOH versée va neutraliser directement les acides gras libres. La quantité de KOH contenue dans le volume versé donne directement l'indice d'acide. Avantage: méthode précise. Inconvénient: consomme trop d'alcool. Le dosage en retour (méthode indirecte réalisé en TP): L'acide (HCL ou H2SO4 de normalité Na) dans la burette. Dans l'Erlen, L'huile (masse m) est additionnée de potasse alcoolique en excès (normalité Nb) plus l'indicateur. Une certaine quantité de KOH va réagir avec les acides gras libres. L'excédent de KOH va être dosé par un volume Ve d'H2SO4. Il est nécessaire dans le dosage en retour d'effectuer un dosage supplémentaire (letémoin). Le volume de KOH additionnée à l'huile est dosé séparément par un volume Vt
d'H2SO4Ve d'H2SO4 Vt d'H2SO4
m d'huile + indicateur + indicateurV KOH V KOH
Vt neutralise la quantité totale de KOH utilisé Ve neutralise la quantité de KOH excédentaire qui n'a pas réagi avec les acides grasVt Ve est le volume de H2SO4 nécessaire pour neutraliser la quantité de KOH qui a réagi avec les
acides gras libres. (Vt Ve) en ml est égale à (Vt-Ve) 10-3 litrePuisque Va . Na = Vb . Nb
(Vt-Ve) 10-3 x Na = nombre de moles d'H2SO4 = nombre de moles de KOH qui ont réagi avec les acides gras. pèse1 mole de KOH 56.103 mg de KOH
(Vt-Ve) 10-3 X Na x mg de KOH x = 56 103 x (Vt-Ve) 10-3 x Na x = quantité de KOH en mg consommée par les acides gras libres contenu dans m grammes d'huile L'indice d'acide lui correspond à 1 gramme d'huile. 6Règle de trois:
correspond à x = 56 103 x (Vt-Ve) 10-3 x Na m grammes d'huileIa 1 gramme d'huile
D'où la relation:
56 (Vt-Ve) Na
Ia = mLa même relation est obtenue pour Is car c'est exactement le même protocole. La seule différence
c'est que pour Is on chauffe l'huile après addition de KOH. IL en résulte la libération de tous les
acides gras qui estérifiaient le glycérol. On aura donc une consommation de KOH plus importante.
Exercice 7:
ņņņ2 ņ2
ņ ņņņ + ņ-K+
ņņņ2 ņ2
Triglycéride (TG) Glycérol Savons
1 mole de TG 3 moles de KOH
PMTG 3 x 56 gramme de KOH
D'où la règle de trois:
Correspond à
3 X 56 103 mg de KOH PMTG en gramme
Is 1 gramme de TG
3 x 56 103
Donc: Is = Is = 535 d'où PMTG = 314 PMTGPMTG = PM glycérol + 3 x PM acide gras - 3 x PMH20 (3 x PMH20 = 54)
(puisqu'on a un triglycéride homogène càd qui est estérifié par le même acide gras sur les trois
positions du glycérol)On enlève 3 x PMH20 car chaque liaison ester entre un acide gras et un alcool du glycérol enlève
H20 avec PM glycérol = 92 et PM acide gras = 12n + 2n + 32 car formule brute d'un acide gras saturé est CnH2nO2D'où PMTG = 92 + 3 X (14n + 36) 54 d'où le nombre de carbone de l'acide gras saturé est n
= 4 L'acide gras est l'acide butyrique, le triglycéride est la tributyrine. 7 Exercice 8: I CH3 (C H2-CH=CH)x COOH + x I2 CH3 (C H2-CH=CH)x COOHAcide gras avec x double liaison iode I
1 mole + x mole de I2
PM ag x . PM I2 PM I2 = 254 Ii = quantité de I2 en gramme fixée par 100 grammes de corps grasD'où la règle de trois:
Ii 100 grammes d'acides gras x . 254 PM de l'acide gras x . 254 . 100D'où: Ii =
PMag La formule brute d'un acide gras insaturé est Cn H2n-2x O2 avec n = nombre de carbone et x = nombre de doubles liaisons. x . 254 . 100D'où: Ii =
12n + 2n 2x + 32
Application numérique : avec n = 18 et Ii = 270, on trouve le nombre de doubles liaisons x = 3Il s'agit de l'acide linolénique C18:3
Exercice 9:
Recherche du poids moléculaire du Triglycéride:3 . 56 103
Is = = 196 d'où PMTG = 857 PMTG Recherche du nombre total de double liaison dans le triglycéride: x . 254 . 100 Ii = = 59 d'où x = 2 PMTGLe triglycéride contient deux acides gras : l'acide palmitique C16:0 saturé et l'acide oléique C18:1
monoinsaturé. Puisque le triglycéride renferme deux doubles liaisons donc c'est l'acide oléique qui
doublé dans le triglycéride. Il s'agit de la dioléopalmitine.quotesdbs_dbs21.pdfusesText_27[PDF] exercices corrigés sciences industrielles pcsi pdf
[PDF] exercices corrigés servlets java
[PDF] exercices corrigés soncas
[PDF] exercices corrigés spectroscopie d'absorption atomique
[PDF] exercices corrigés spectroscopie infrarouge
[PDF] exercices corrigés spectroscopie rmn
[PDF] exercices corrigés spectroscopie uv visible pdf
[PDF] exercices corrigés spss
[PDF] exercices corrigés stabilité des systèmes asservis
[PDF] exercices corrigés statique du solide
[PDF] exercices corrigés structure des molécules 1ere s
[PDF] exercices corrigés structures de données langage c
[PDF] exercices corrigés suites 1ere es
[PDF] exercices corrigés suites 1ere s
