 Chapitre CHIMIE – Le pH I – Les solutions acides neutres et
Chapitre CHIMIE – Le pH I – Les solutions acides neutres et
□ Ions hydroxyde □ Ions hydrogène □ Ions phosphate □ Ions citrate □ Ions acétate Document n°3 : Tableau récapitulant les réactifs permettant d'identifier ...
 Cours - Atomes - Ions - Molecules.pdf
Cours - Atomes - Ions - Molecules.pdf
24 janv. 2020 Un ion monoatomique est une entité chimique stable dont la couche de valence est saturée. La position de l'élément dans le tableau périodique ...
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Une solution ionique s'écrit : (ion+ + ions -). Exemples : sulfate de cuivre (Le tableau suivant n'est pas à apprendre). Ion. Chlorure. Cl-. Cuivre. Cu2+. Fer ...
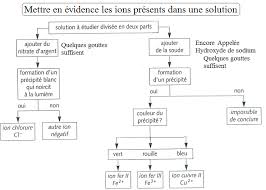 Chapitre CHIMIE – Comment identifier les IONS présents dans une
Chapitre CHIMIE – Comment identifier les IONS présents dans une
NEGATIFS....... 2) Par exemple dans une solution Ionique de Chlorure de Sodium (eau salée) il y a des Ions .CHLORURES...
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Initialement le système chimique contient 30 mol de diiode et 5
 Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
24 Titrage des ions bromure. 1. On a le tableau d'avancement : Équation de la réaction. 6 Br– (aq) + Cr2 7. 2− (aq) + 14 H+ (aq) → 3 Br2 (aq) + 2. Cr3+ (aq)
 QUELQUES TESTS DIDENTIFICATION DES IONS
QUELQUES TESTS DIDENTIFICATION DES IONS
TABLEAU RECAPITULATIF DES TESTS D'IDENTIFICATION DES IONS. Réactif utilisé Si des ions chlorures sont présents alors il se forme un précipité blanc qui ...
 Physique Chimie
Physique Chimie
Document 3 -. Tableau d'identification des ions. Un précipité est un solide formé par la réaction entre deux ions dissous. Ion à identifier. Réactif test.
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -.
 LES IONS CATIONS ANIONS
LES IONS CATIONS ANIONS
LES IONS. CATIONS. FORMULES. ANIONS. FORMULES ion oxonium. H3O + ion hydroxyde. HO - ion cuivre II. Cu 2+ ion nitrate. NO3. - ion sodium. Na + ion iodure. I -.
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Exercice n°2 : Quantité de matière et tableau d'avancement Calculer la concentration finale en ions I?-?(aq) dans le mélange si le volume total à.
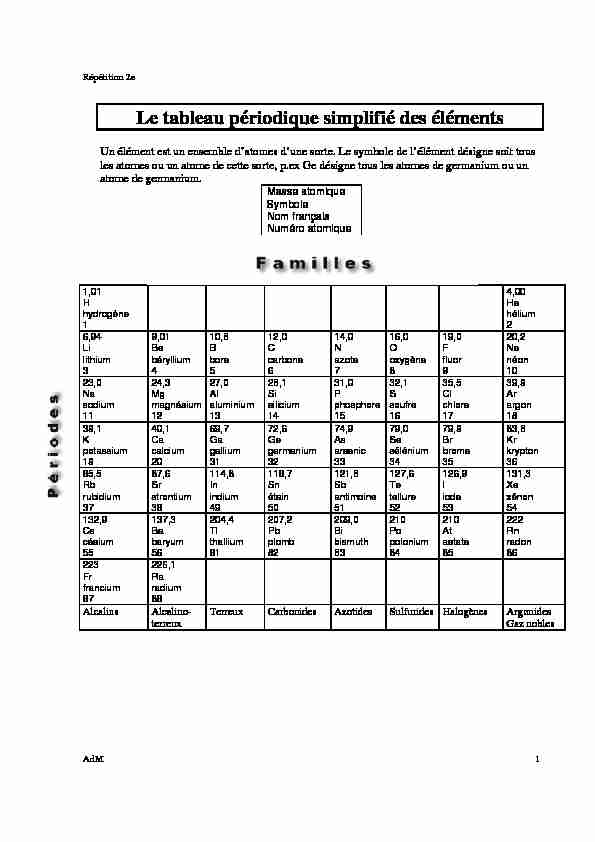
 Le tableau périodique simplifié des éléments
Le tableau périodique simplifié des éléments
d'ions hydroxyde que d'ions calcium car la charge totale doit être égale à 0. Page 7. Répétition 2e. AdM. 7. Les substances chimiques.
 Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
24 Titrage des ions bromure. 1. On a le tableau d'avancement : Équation de la réaction. 6 Br– (aq) + Cr2 7. 2? (aq) + 14 H+ (aq) ? 3 Br2 (aq) + 2.
 tableau davancement
tableau davancement
Quelle est la concentration finale en ions HO— s'il n'y a pas de variation du volume ? On commence par calculer les quantités de matière des espèces introduites
 Tableau récapitulatif des principaux ions de la chimie. CATIONS
Tableau récapitulatif des principaux ions de la chimie. CATIONS
On peut alors savoir les ions présents lors de la dissolution d'un composé ionique dans l'eau : Sulfate de cuivre : CuSO4 qui donne dans l'eau les ions Cu2+.
 ELECTROPHYSIOLOGIE: PRINCIPES ET TECHNIQUES
ELECTROPHYSIOLOGIE: PRINCIPES ET TECHNIQUES
Tableau 1: Concentrations [Ion]
 Chapitre VI: Lévolution des réactions chimiques
Chapitre VI: Lévolution des réactions chimiques
exemple: les ions iodure I - avec les ions peroxodisulfate S2O8 espèce n°1: ions iodure ... 4/ Le tableau d'évolution (ou tableau d'avancement).
 QUELQUES TESTS DIDENTIFICATION DES IONS
QUELQUES TESTS DIDENTIFICATION DES IONS
QUELQUES TESTS D'IDENTIFICATION DES IONS. TABLEAU RECAPITULATIF DES TESTS D'IDENTIFICATION DES IONS. Réactif utilisé. Hydroxyde de sodium ou soude. Nitrate.
 LES IONS CATIONS ANIONS
LES IONS CATIONS ANIONS
LES IONS. CATIONS. FORMULES. ANIONS. FORMULES ion oxonium. H3O + ion hydroxyde. HO - ion cuivre II. Cu 2+ ion nitrate. NO3. - ion sodium. Na + ion iodure.
 [PDF] Tableau de certains ions polyatomiques Formules Constantes et
[PDF] Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et conversions Solubilité des composés ioniques dans l'eau à 25 °C Ions - 1 Ions - 2 Ions
 [PDF] LES IONS CATIONS ANIONS
[PDF] LES IONS CATIONS ANIONS
LES IONS CATIONS FORMULES ANIONS FORMULES ion oxonium H3O + ion hydroxyde HO - ion cuivre II Cu 2+ ion nitrate NO3 - ion sodium Na + ion iodure
 Nomenclature inorganique : liste des principaux ions
Nomenclature inorganique : liste des principaux ions
Ion Al3+ aluminium Ag+ argent Ba2+ baryum Ca 2+ calcium Cd 2+ cadmium Co 2+ cobalt (II) Cr 3+ chrome (III) Cu+ cuivre (I)
 [PDF] ionspdf
[PDF] ionspdf
Structure électronique de l'ion Demi équation électronique Struct elec Gain ou perte d'e Formule ion Compléter les tableaux suivants atome Na (Z=11)
 [PDF] Tableau récapitulatif des principaux ions de la chimie
[PDF] Tableau récapitulatif des principaux ions de la chimie
Tableau récapitulatif des principaux ions de la chimie CATIONS ANIONS ions portant une seule charge H + proton H3O + ion hydronium NH4 + ion
 [PDF] Le tableau périodique simplifié des éléments
[PDF] Le tableau périodique simplifié des éléments
d'ions hydroxyde que d'ions calcium car la charge totale doit être égale à 0 Page 7 Répétition 2e AdM 7 Les substances chimiques
 [PDF] les atomes molécules et ions - La chimie
[PDF] les atomes molécules et ions - La chimie
Atomes molécules et ions tableau dans lequel sont regroupés les un ion est un atome ou une molécule qui a gagné ou perdu des électrons
 [PDF] Leçon 2 : atomes et ions Physique chimie
[PDF] Leçon 2 : atomes et ions Physique chimie
Ion hydrogène 0 Exercice n°5 : Charge et formule de quelques ions Complétez le tableau (correction à la fin du diaporama)
 [PDF] QUELQUES TESTS DIDENTIFICATION DES IONS
[PDF] QUELQUES TESTS DIDENTIFICATION DES IONS
TABLEAU RECAPITULATIF DES TESTS D'IDENTIFICATION DES IONS Si des ions chlorures sont présents alors il se forme un précipité blanc qui noircit à la
Répétition 2e
AdM 1
Le tableau périodique simplifié des élémentsUn élément est un ensemble d'atomes d'une sorte. Le symbole de l'élément désigne soit tous
les atomes ou un atome de cette sorte, p.ex Ge désigne tous les atomes de germanium ou un atome de germanium.Masse atomique
Symbole
Nom français
Numéro atomique
1,01 H hydrogène1 4,00
He hélium2 6,94
Li lithium3 9,01
Be béryllium4 10,8
B bore5 12,0
C carbone6 14,0
N azote7 16,0
O oxygène8 19,0
F fluor9 20,2
Ne néon10 23,0 Na
sodium11 24,3
Mg magnésium12 27,0
Al aluminium13 28,1
Si silicium14 31,0
P phosphore15 32,1
S soufre16 35,5
Cl chlore17 39,9
Ar argon18 39,1
K potassium19 40,1
Ca calcium20 69,7
Ga gallium31 72,6
Ge germanium32 74,9
As arsenic33 79,0
Se sélénium34 79,9
Br brome35 83,8
Kr krypton36 85,5 Rb
rubidium37 87,6
Sr strontium38 114,8
In indium49 118,7
Snétain
50 121,8
Sb antimoine51 127,6
Te tellure52 126,9
I iode53 131,3
Xe xénon54 132,9
Cs césium55 137,3
Ba baryum56 204,4
Tl thallium81 207,2
Pb plomb82 209,0
Bi bismuth83 210
Po polonium 84210
At astate
85 222
Rn radon86 223 Fr
francium87 226,1
Ra radium88 Alcalins Alcalino-
terreux Terreux Carbonides Azotides Sulfurides Halogènes ArgonidesGaz nobles
Répétition 2e
AdM 2
Les structures de Lewis
Un trait = 2 électrons extérieurs
Un point = 1 électron extérieur
La structure de Lewis montre les électrons extérieurs d'un atome complet ( qui possède autant d'électrons que de protons et est donc neutre)Dans les éléments de transition il est difficile de distinguer entre électrons extérieurs et
intérieurs, on n'écrit pas de structure de Lewis pour un tel élément.Répétition 2e
AdM 3
Les ions simples
En cédant ou en prenant des électrons, l'atome cherche souvent à adopter la structureélectronique de l'argonide le plus proche. D'où les ions élémentaires suivants (- est la charge
d'un électron=-1,6.10 -19Coulombs):
Les ions positifs (cations) ont le nom de l'élément, les ions négatifs (anions) simples prennent
la terrminaison -ure p.ex (fluorure, poloniure.. ) mais : oxyde, phosphure, nitrure, sulfure Voici quelques ions importants des éléments de transition: Cr 3+ ion chrome (III) souvent vert Mn 2+ ion manganèse(II) souvent rose Fe 2+ ion fer(II) ou .. ferreux souvent vert clair Fe 3+ ion fer(III) ou .. ferreux souvent brun-ocre Co 2+ ion cobalt(II) souvent rose foncé Ni 2+ ion nickel(II) souvent vert Cu ion cuivre(I) souvent incolore Cu 2+ ion cuivre(II) souvent bleu Zn 2+ ion zinc(II) souvent incolore Ag ion argent souvent incolore Cd 2+ ion cadmium souvent incolore Au 3+ ion or(III) souvent brun Hg 2+ ion mercure (II) souvent incolore H Li Be 2+ N 3- O 2- F Na Mg 2+ Al 3+ P 3- S 2- Cl K Ca 2+ Ga 3+ As 3- Se 2- Br Rb Sr 2+ In 3+ Sb 3- Te 2- I Cs Ba 2+ Tl 3+ Bi 3- Po 2- At Fr Ra 2+Répétition 2e
AdM 4
Les molécules
Assemblages non chargés de plusieurs atomes (différents ou non) liés par liaisons covalentes
ou datives. Chaque atome cherche avec tous les électrons dont il s'est entouré de cette manière à réaliser la structure de l'argonide le plus proche.1) Dans une liaison covalente, les atomes mettent en commun deux électrons, chaque
électron provient d'un des deux atomes.
Exemple :
2) Dans une liaison dative, les atomes mettent en commun deux électrons, les deux électrons
proviennent d'un des deux atomes (qui possédait un doublet sur la dernière couche) et complètent la dernière couche de l'autre (voir plus tard). Molécule du médicament anxiolytique Xanax ( Alprazolam) noir : C, blanc : H, bleu : N, vert : ClRépétition 2e
AdM 5
Les ions polyatomiques
Assemblages de plusieurs atomes (différents ou non) liés par liaisons covalentes ou datives et portant une charge. Cette charge correspond au nombre d'électrons supplémentaires ou déficitaires par rapport aux structures de Lewis.Exemple:
ion hydroxyde: un éléctron de plus par rapport aux structures de Lewis d'où la charge - NH 4+ ammonium incolore OH hydroxyde incolore CO 3 2- carbonate incolore NO 3- nitrate incolore NO 2- nitrite incolore PO 4 3- phosphate incolore SO 4 2- sulfate incolore SO 3 2- sulfite incolore ClO 4- perchlorate incolore ClO 3- chlorate incolore ClO 2- chlorite incolore ClO hypochlorite incolore Cr 2 O 72-bichromate orange CrO 4- chromate jaune MnO 4- permanganate violet
Répétition 2e
AdM 6
Les réseaux ioniques
Assemblages de plusieurs ions (simples ou polyatomiques) par attraction électrostatique( charges + et - s'attirent). La charge totale d'un réseau ionique est en générale nulle, c.à.d.
qu'il y a autant de charges + que -Exemple
Réseau du sel de cuisine, les gros ions sont des ions chlorure Cl , les petits des ions sodiumNa Dans un réseau, le nombre de cations n'est pas toujours égal au nombre d'anions, p. exemple dans le réseau d'hydroxyde de calcium formé par les ions Ca 2+ et OH , il y a deux fois plus d'ions hydroxyde que d'ions calcium, car la charge totale doit être égale à 0.Répétition 2e
AdM 7
Les substances chimiques
Une substance est
-un ensemble de molécules (substance moléculaire) d'une sorte ou -un ensemble d'atomes d'une sorte métaux : réseaux atomiques gaz nobles : atomes isolés ou -un réseaux ionique (substance ionique) Les substances se caractérisent par des températures de fusion constantes.L'iode I
2 est formée d'une sorte de molécules, c'est une substance moléculaire.Répétition 2e
AdM 8
Un corps simple est une substance formée par un élément. Toutes les autres substances (de loin les plus nombreuses) s'appellent corps composés.1) corps simples métalliques. Leurs atomes forment des réseaux atomiques
1 1 Les corps simples soulignés se trouvent à l'état natifRépétition 2e
AdM 9
2) les corps simples moléculaires. Leurs atomes sont associés en molécules.
Répétition 2e
AdM 10
Disposition des atomes dans le graphite et le diamant:Molécules S
8 et P 4Répétition 2e
AdM 11
3) Les corps simples monoatomiques ou gaz nobles : Leurs atomes restent isolés .
-En 1894, le chimiste anglais W. Rayleigh remarque que l'azote obtenu à partir de l'airpossède une densité plus élevée que l'azote pur retiré de composés azotés. Il en déduit que ce
qu'on croyait être de l'azote pur dans l'air est en réalité un mélange contenant d'autres
substances gazeuses: les gaz nobles . - En 1895, le chimiste anglais W. Ramsay isole les gaz néon, argon, krypton et xénon, gaz incolores, inodores et chimiquement inertes.Hélium
Après l'hydrogène, l'hélium est l'élément le plus fréquent de l'univers. Il est utilisé comme gaz
de remplissage des ballons grâce à sa faible masse volumique et son incombustibilité. À cause de sa faible solubilité dans les tissus humains, il remplace avantageusement l'azote dans les mélanges respiratoires spéciaux pour plongeurs. Cela permet d' éviter l'accident dequotesdbs_dbs29.pdfusesText_35[PDF] population france 1945
[PDF] population en france en 2017
[PDF] comment élever des poules pondeuses pdf
[PDF] comment nourrir poules pondeuses
[PDF] elever des poules pour les nuls pdf
[PDF] frequence respiratoire en fonction de l'age
[PDF] fréquence cardiaque adulte
[PDF] fréquence respiratoire personne agée
[PDF] normes paramètres vitaux oms
[PDF] fréquence respiratoire normes
[PDF] norme fréquence cardiaque
[PDF] comment mesurer la fréquence respiratoire
[PDF] frequence respiratoire norme
[PDF] frequence cardiaque en fonction de l'age
