 Chapitre CHIMIE – Le pH I – Les solutions acides neutres et
Chapitre CHIMIE – Le pH I – Les solutions acides neutres et
□ Ions hydroxyde □ Ions hydrogène □ Ions phosphate □ Ions citrate □ Ions acétate Document n°3 : Tableau récapitulant les réactifs permettant d'identifier ...
 Cours - Atomes - Ions - Molecules.pdf
Cours - Atomes - Ions - Molecules.pdf
24 janv. 2020 Un ion monoatomique est une entité chimique stable dont la couche de valence est saturée. La position de l'élément dans le tableau périodique ...
 Fiche de révision de 3eme en physique chimie - DNB
Fiche de révision de 3eme en physique chimie - DNB
Une solution ionique s'écrit : (ion+ + ions -). Exemples : sulfate de cuivre (Le tableau suivant n'est pas à apprendre). Ion. Chlorure. Cl-. Cuivre. Cu2+. Fer ...
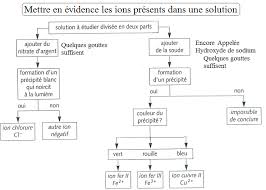 Chapitre CHIMIE – Comment identifier les IONS présents dans une
Chapitre CHIMIE – Comment identifier les IONS présents dans une
NEGATIFS....... 2) Par exemple dans une solution Ionique de Chlorure de Sodium (eau salée) il y a des Ions .CHLORURES...
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Initialement le système chimique contient 30 mol de diiode et 5
 Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
24 Titrage des ions bromure. 1. On a le tableau d'avancement : Équation de la réaction. 6 Br– (aq) + Cr2 7. 2− (aq) + 14 H+ (aq) → 3 Br2 (aq) + 2. Cr3+ (aq)
 QUELQUES TESTS DIDENTIFICATION DES IONS
QUELQUES TESTS DIDENTIFICATION DES IONS
TABLEAU RECAPITULATIF DES TESTS D'IDENTIFICATION DES IONS. Réactif utilisé Si des ions chlorures sont présents alors il se forme un précipité blanc qui ...
 Physique Chimie
Physique Chimie
Document 3 -. Tableau d'identification des ions. Un précipité est un solide formé par la réaction entre deux ions dissous. Ion à identifier. Réactif test.
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions -.
 LES IONS CATIONS ANIONS
LES IONS CATIONS ANIONS
LES IONS. CATIONS. FORMULES. ANIONS. FORMULES ion oxonium. H3O + ion hydroxyde. HO - ion cuivre II. Cu 2+ ion nitrate. NO3. - ion sodium. Na + ion iodure. I -.
 Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques. Formules. Constantes et conversions. Solubilité des composés ioniques dans l'eau à 25 °C. Ions -. 1. Ions -. 2. Ions
 Exercices de révisions : Physique-chimie
Exercices de révisions : Physique-chimie
Exercice n°2 : Quantité de matière et tableau d'avancement Calculer la concentration finale en ions I?-?(aq) dans le mélange si le volume total à.
 Le tableau périodique simplifié des éléments
Le tableau périodique simplifié des éléments
d'ions hydroxyde que d'ions calcium car la charge totale doit être égale à 0. Page 7. Répétition 2e. AdM. 7. Les substances chimiques.
 Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
Chapitre 2 24 Titrage des ions bromure 1. On a le tableau d
24 Titrage des ions bromure. 1. On a le tableau d'avancement : Équation de la réaction. 6 Br– (aq) + Cr2 7. 2? (aq) + 14 H+ (aq) ? 3 Br2 (aq) + 2.
 tableau davancement
tableau davancement
Quelle est la concentration finale en ions HO— s'il n'y a pas de variation du volume ? On commence par calculer les quantités de matière des espèces introduites
 Tableau récapitulatif des principaux ions de la chimie. CATIONS
Tableau récapitulatif des principaux ions de la chimie. CATIONS
On peut alors savoir les ions présents lors de la dissolution d'un composé ionique dans l'eau : Sulfate de cuivre : CuSO4 qui donne dans l'eau les ions Cu2+.
 ELECTROPHYSIOLOGIE: PRINCIPES ET TECHNIQUES
ELECTROPHYSIOLOGIE: PRINCIPES ET TECHNIQUES
Tableau 1: Concentrations [Ion]
 Chapitre VI: Lévolution des réactions chimiques
Chapitre VI: Lévolution des réactions chimiques
exemple: les ions iodure I - avec les ions peroxodisulfate S2O8 espèce n°1: ions iodure ... 4/ Le tableau d'évolution (ou tableau d'avancement).
 QUELQUES TESTS DIDENTIFICATION DES IONS
QUELQUES TESTS DIDENTIFICATION DES IONS
QUELQUES TESTS D'IDENTIFICATION DES IONS. TABLEAU RECAPITULATIF DES TESTS D'IDENTIFICATION DES IONS. Réactif utilisé. Hydroxyde de sodium ou soude. Nitrate.
 LES IONS CATIONS ANIONS
LES IONS CATIONS ANIONS
LES IONS. CATIONS. FORMULES. ANIONS. FORMULES ion oxonium. H3O + ion hydroxyde. HO - ion cuivre II. Cu 2+ ion nitrate. NO3. - ion sodium. Na + ion iodure.
 [PDF] Tableau de certains ions polyatomiques Formules Constantes et
[PDF] Tableau de certains ions polyatomiques Formules Constantes et
Tableau de certains ions polyatomiques Formules Constantes et conversions Solubilité des composés ioniques dans l'eau à 25 °C Ions - 1 Ions - 2 Ions
 [PDF] LES IONS CATIONS ANIONS
[PDF] LES IONS CATIONS ANIONS
LES IONS CATIONS FORMULES ANIONS FORMULES ion oxonium H3O + ion hydroxyde HO - ion cuivre II Cu 2+ ion nitrate NO3 - ion sodium Na + ion iodure
 Nomenclature inorganique : liste des principaux ions
Nomenclature inorganique : liste des principaux ions
Ion Al3+ aluminium Ag+ argent Ba2+ baryum Ca 2+ calcium Cd 2+ cadmium Co 2+ cobalt (II) Cr 3+ chrome (III) Cu+ cuivre (I)
 [PDF] ionspdf
[PDF] ionspdf
Structure électronique de l'ion Demi équation électronique Struct elec Gain ou perte d'e Formule ion Compléter les tableaux suivants atome Na (Z=11)
 [PDF] Tableau récapitulatif des principaux ions de la chimie
[PDF] Tableau récapitulatif des principaux ions de la chimie
Tableau récapitulatif des principaux ions de la chimie CATIONS ANIONS ions portant une seule charge H + proton H3O + ion hydronium NH4 + ion
 [PDF] Le tableau périodique simplifié des éléments
[PDF] Le tableau périodique simplifié des éléments
d'ions hydroxyde que d'ions calcium car la charge totale doit être égale à 0 Page 7 Répétition 2e AdM 7 Les substances chimiques
 [PDF] les atomes molécules et ions - La chimie
[PDF] les atomes molécules et ions - La chimie
Atomes molécules et ions tableau dans lequel sont regroupés les un ion est un atome ou une molécule qui a gagné ou perdu des électrons
 [PDF] Leçon 2 : atomes et ions Physique chimie
[PDF] Leçon 2 : atomes et ions Physique chimie
Ion hydrogène 0 Exercice n°5 : Charge et formule de quelques ions Complétez le tableau (correction à la fin du diaporama)
 [PDF] QUELQUES TESTS DIDENTIFICATION DES IONS
[PDF] QUELQUES TESTS DIDENTIFICATION DES IONS
TABLEAU RECAPITULATIF DES TESTS D'IDENTIFICATION DES IONS Si des ions chlorures sont présents alors il se forme un précipité blanc qui noircit à la
 Exercice 1 : precipitation de l"hydroxyde de cuivre II On mélange 100 mL d"une solution aqueuse de sulfate de cuivre de concentration c
Exercice 1 : precipitation de l"hydroxyde de cuivre II On mélange 100 mL d"une solution aqueuse de sulfate de cuivre de concentration c 1 = 0,5 mol.L-1 et
80 mL d"hydroxyde de sodium (Na
+ + HO-) de concentration c2 = 2 mol.L-1. L"équation de la réaction de précipitation est : Cu2+(aq) + 2 HO-(aq) ® Cu(OH)2 (s)
1.1. Dresser le tableau d"avancement.
1.2. Déterminer le réactif limitant et calculer x
max1.3. Calculer la masse de précipité.
1.4. Quelle est la concentration finale en ions HO
- s"il n"y a pas de variation du volume ? On commence par calculer les quantités de matière des espèces introduites.Pour Cu2+ : n1 = c1 V1 = 0,5 × 0,1 = 0,05 mol
Pour HO- : n2 = c2 V2 = 2 × 0,08 = 0,16 mol
On peut commencer à dresser le tableau d"avancement :Cu2+(aq) + 2 HO-(aq) ® Cu(OH)2(s)
État initial en mol x = 0 0,05 0,16 0
Etat intermédiaire en mol x 0,05 - x 0,16 - 2x xEtat final en mol xmax
Le réactif limitant est celui qui est totalement consommé, c"est-à-dire celui pour lequel la quantité
est nulle dans l"état final. Si Cu2+ est le réactif limitant : 0,05 - xmax = 0 ? xmax = 0,05 mol Si HO- est le limitant : 0,16 - 2xmax = 0 ? xmax = 0,08 mol On retient la plus petite valeur de xmax : le réactif limitant est Cu2+ et xmax = 0,05 mol.Le tableau complet est :
Cu2+(aq) + 2 HO-(aq) ® Cu(OH)2(s)
État initial en mol x = 0 0,05 0,16 0
Etat intermédiaire en mol x 0,05 - x 0,16 - 2x xEtat final en mol xmax = 0,05 0 0,06 0,05
Calcul de la masse de précipité : on peut lire dans le tableau que la quantité de matière de
précipité Cu(OH)2 est n3 = 0,05 mol. m3 = n3 M3 avec M3 = MCu + 2 (MO + MH) = 63,5 + 2 × (16 + 1) = 97,5 g.mol-1. m3 = n3 M3 = 0,05 × 97,5 = 4,88 gConcentration finale en ions HO- : on peut lire dans le tableau que la quantité finale de matière
d"ions hydroxyde est n4 = 0,06 mol avec V = V1 + V2 = 100 + 80 = 180 mL. [HO-]final = 44Vn= 18,0
06,0 = 0,333 mol.L-1
Exercice 2 : combustion de l"essence
Le principal constituant de l"essence est l"octane C8H18. Lors de la combustion de l"essence dans
l"air, l"octane réagit avec le dioxygène de l"air pour produire du dioxyde de carbone et de l"eau.
Quel est le volume d"air, mesuré dans les CHTP, nécessaire pour la combustion de 500 g d"octane ?
On peut calculer la quantité de matière d"octane qui va réagir : n1 = 11M m avec M1 = 8 MC + 18 MH = 8 × 12 + 18 × 1 = 114 g.mol-1 n1 = 11M m = 114500 = 4,39 mol
On peut ensuite écrire l"équation chimique, l"ajuster et commencer à compléter le tableau
d"avancement :2 C8H18 + 25 O2 ® 16 CO2 + 18 H2O
État initial en mol x = 0 4,39 2On 0 0
Etat intermédiaire en mol x 4,39 - 2x 2On- 25x 16x 18xEtat final en mol xmax 0
On souhaite que tout l"octane soit consommé : c"est la raison pour laquelle la quantité de matière
d"octane dans l"état final est nulle. A partir de cette quantité de matière, on peut calculer xmax :
4,39 - 2xmax = 0 ? xmax = 2
39,4 = 2,20 mol
La quantité de dioxygène nécessaire à la combustion est telle qu"à l"état final il n"en reste plus
(proportions stoechiométriques). On en déduit : 2On- 25xmax = 0 ? 2On= 25xmax = 25 × 2,20 = 54,9 mol.Or l"air est constitué environ de 5
1de dioxygène (et de 5
4 de diazote).
D"où nair = 5 2On= 5 × 54,9 = 274 mol.
Nous avons vu que le volume molaire d"un gaz est VM = 24 L.mol-1 dans les conditions habituelles de température et de pression (CHTP) : Vair = nair × VM = 274 × 24 = 6580 L = 6,58 m3quotesdbs_dbs29.pdfusesText_35[PDF] population france 1945
[PDF] population en france en 2017
[PDF] comment élever des poules pondeuses pdf
[PDF] comment nourrir poules pondeuses
[PDF] elever des poules pour les nuls pdf
[PDF] frequence respiratoire en fonction de l'age
[PDF] fréquence cardiaque adulte
[PDF] fréquence respiratoire personne agée
[PDF] normes paramètres vitaux oms
[PDF] fréquence respiratoire normes
[PDF] norme fréquence cardiaque
[PDF] comment mesurer la fréquence respiratoire
[PDF] frequence respiratoire norme
[PDF] frequence cardiaque en fonction de l'age
