 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
Formule de Clapeyron: Considérons un corps pur sous deux phases en équilibre ou encore titre en vapeur. Notation usuelle : il est d'usage d'utilise des ...
 PHYSIQUE 1
PHYSIQUE 1
On rappelle que le titre massique en vapeur x d'un système liquide-vapeur est égal au rapport entre la masse mG d'eau à l'état de vapeur saturante et la masse
 La vapeur deau
La vapeur deau
Entre 5 et 80 bar la formule de Bertin permet d'estimer la masse volumique de la vapeur Parce qu'une vapeur dont le titre est de 0
 1 Titre massique en vapeur.
1 Titre massique en vapeur.
On appelle x le titre en vapeur : x est le rapport de la masse de vapeur d'eau contenue dans le récipient sur la masse totale m. 1/ Le récipient est
 Th3 - Changement de phase dun corps pur I. Quelques définitions
Th3 - Changement de phase dun corps pur I. Quelques définitions
On qualifie généralement les fractions molaires ou massique de "titre". Exemple : titre en vapeur d'un mélange "liquide-vapeur". On caractérise également
 DS n 2
DS n 2
massique indiqué wiT échangé par le fluide dans la turbine. On rappelle que le titre correspond à la fraction massique de la vapeur dans le mélange liquide-
 Titre alcoométrique volumique
Titre alcoométrique volumique
l'entraînement à la vapeur d'eau. Compléter à 200 ml avec de l'eau distillée La formule est valable pour les températures comprises entre –20 °C et +40 ...
 Titre Table des matières
Titre Table des matières
Cette formule s'applique aux fonds ou partie de fonds avec appareils à vapeur aux récipients de vapeur lorsqu'ils sont chauffés par la vapeur fournie par un.
 Thermodynamique Le corps pur sous plusieurs phases
Thermodynamique Le corps pur sous plusieurs phases
La pression de vapeur vaturante dépend de la température. 4 La formule de Le titre molaire en vapeur (resp. en liquide) d'un corps pur représente la ...
 Untitled
Untitled
23 janv. 2015 La formule expérimentale la plus Sample est due à Dupperay : P = 0965 X ... Les meilleures chaudières donnent une vapeur avec un titre de 0
 PHYSIQUE 1
PHYSIQUE 1
On rappelle que le titre massique en vapeur x d'un système liquide-vapeur est égal au rapport entre la masse mG d'eau à l'état de vapeur saturante et la
 La vapeur deau
La vapeur deau
Ainsi à l'aide de la formule de Duperray
 Fiche de Rappel
Fiche de Rappel
enthalpie H (ou à l'énergie interne U). Par exemple pour un système liquide-vapeur à l'équilibre
 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
On applique les formules précédentes pour caractériser le mélange On peut alors évaluer le titre de la vapeur x = (v-vl)/(vp-vl)=0.3 donc.
 1 Titre massique en vapeur.
1 Titre massique en vapeur.
7 juin 2012 On appelle x le titre en vapeur : x est le rapport de la masse de vapeur d'eau contenue dans le récipient sur la masse totale m. 1/ Le récipient ...
 Corps pur sous deux phases
Corps pur sous deux phases
Formule de Clapeyron : L1?2 = T (v2 ? v1). dP. dT avec v1 et v2 les volumes massiques des phases 1 et 2. 2.2 Titre massique en vapeur.
 SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
L'état final. F correspond à une vapeur saturante à la température T2 = 373 K (à la pression P2 = f (T2) = 1 bar ). Calculer le titre en vapeur xV2 dans l'état
 ÉTUDE DU CORPS PUR DIPHASÉ EN ÉQUILIBRE
ÉTUDE DU CORPS PUR DIPHASÉ EN ÉQUILIBRE
On étudiera les phases solide liquide
 DS SCIENCES PHYSIQUES MATHSPÉ
DS SCIENCES PHYSIQUES MATHSPÉ
25 oct. 2008 On rappelle que le titre massique en vapeur x d'un système liquide-vapeur est égal au ... (formule littérale puis application numérique).
 Titre alcoométrique volumique – Méthodes Type I
Titre alcoométrique volumique – Méthodes Type I
Appareil à entraînement par la vapeur d'eau comportant: - un générateur de vapeur d'eau; Formule permettant de calculer les tables alcoométrique.
 1 Titre massique en vapeur - Université Paris-Saclay
1 Titre massique en vapeur - Université Paris-Saclay
On appelle xle titre en vapeur : x est le rapport de la masse de vapeur d’eau contenue dans le r ecipient sur la masse totale m 1/ Le r ecipient est maintenu dans un thermostat a T= 373 K (100 C) (a) Quel est le volume massique v v de la vapeur d’eau a sa limite de saturation a la temp erature T? On supposera que la vapeur d’eau est un
 Changements d'états/Vaporisation et condensation — Wikiversité
Changements d'états/Vaporisation et condensation — Wikiversité
le titre en vapeur est alors x=m"/m Remarque importante : x s’exprimera en fonction des variables extensives utiles pratiquement le volume l’enthapie et l’entropie Raisonnons par exemple avec le volume : V=V’+V" ou les volumes sont totaux En grandeurs massiques V = mv = m’v’+m"v"
Comment calculer le titre de la vapeur ?
Le titre de la vapeur est la quantité de vapeur contenu dans le mélange eau-vapeur lors de la vaporisation. Le titre, noté X, est compris entre 0 et 1 et ne possède pas d'unité. Remarque: Le rapport se calcule pour un kg de mélange eau + vapeur et varie de 0 à 1. 1. Pour que X = 0, il faut que la masse de vapeur soit égale à 0.
Comment calculer le titre de vapeur saturante ?
On appelle xle titre de vapeur saturante défini r comme étant la proportion en masse de vapeur dans le mélange r liquide-vapeur. Pour l’unité de masse de corps, xest la masse de vapeur et 1 - xla masse de liquide. Soit le volume du mélange liquide-vapeur dans l’état A.
Qu'est-ce que le titre de vapeur d'une chaudière à vapeur industrielle ?
Lorsque l'on parle du titre de vapeur des chaudières à vapeur industrielles, on fait référence au pourcentage en masse de vapeur dans le mélange eau liquide-vapeur qui circule dans leurs installations. La valeur de ce pourcentage varie de 0 à 1.
Quelle est la valeur de la vapeur ?
La valeur de ce pourcentage varie de 0 à 1. La valeur 0 correspond à l'eau liquide (il n'y a pas de vapeur), et la valeur 1, à la vapeur saturée (tout est vapeur).
 http ://ptetoile.free.fr/ Corps pur sous deux phases
http ://ptetoile.free.fr/ Corps pur sous deux phases Corps pur sous deux phases
1´Etats du corps pur
1.1 Phases
Un corps pur est un corps constitu´e d"une seule esp`ece chimique.Phase : tout ou partie d"un syst`eme o`u les grandeurs intensives varient de fa¸con continue.`A l"interface entre 2
phases, les grandeurs d"´etat varient rapidement sur des distances de l"ordre de quelques atomes (discontinuit´e).
Les 3 phases les plus connues sont les phases liquide, solide et gazeuse.´echelle macroscopique
´echelle microscopique
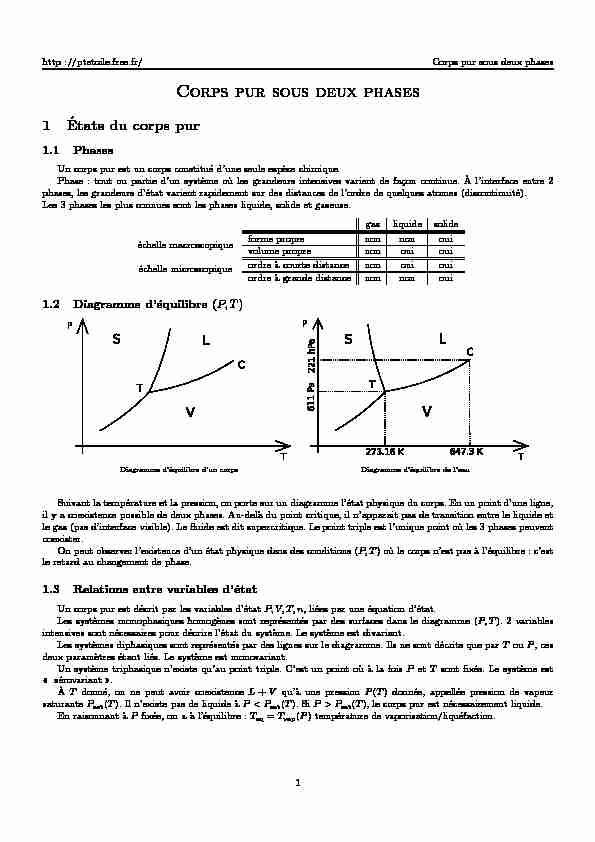
gaz liquide solide forme propre non non oui volume propre non oui oui ordre `a courte distance non oui oui ordre `a grande distance non non oui1.2 Diagramme d"´equilibre(P,T)
Diagramme d"´equilibre d"un corps Diagramme d"´equilibre de l"eauSuivant la temp´erature et la pression, on porte sur un diagramme l"´etat physique du corps. En un point d"une ligne,
il y a coexistence possible de deux phases. Au-del`a du point critique, il n"apparait pas de transition entre le liquide et
le gaz (pas d"interface visible). Le fluide est dit supercritique. Le point triple est l"unique point o`u les 3 phases peuvent
coexister.On peut observer l"existence d"un ´etat physique dans des conditions (P,T) o`u le corps n"est pas `a l"´equilibre : c"est
le retard au changement de phase.1.3 Relations entre variables d"´etat
Un corps pur est d´ecrit par les variables d"´etatP,V,T,n, li´ees par une ´equation d"´etat.
Les syst`emes monophasiques homog`enes sont repr´esent´es par des surfaces dans le diagramme (P,T). 2 variables
intensives sont n´ecessaires pour d´ecrire l"´etat du syst`eme. Le syst`eme est divariant.Les syst`emes diphasiques sont repr´esent´es par des lignes sur le diagramme. Ils ne sont d´ecrits que parTouP, ces
deux param`etres ´etant li´es. Le syst`eme est monovariant.Un syst`eme triphasique n"existe qu"au point triple. C"est un point o`u `a la foisPetTsont fix´es. Le syst`eme est
"z´erovariant».`ATdonn´e, on ne peut avoir coexistenceL+Vqu"`a une pressionP(T) donn´ee, appell´ee pression de vapeur
saturantePsat(T). Il n"existe pas de liquide `aP < Psat(T). SiP > Psat(T), le corps pur est n´ecessairement liquide.
En raisonnant `aPfix´ee, on a `a l"´equilibre :Teq=Tvap(P) temp´erature de vaporisation/liqu´efaction.
1 http ://ptetoile.free.fr/ Corps pur sous deux phases 2´Equilibre d"un m´elange diphasique
2.1 Enthalpie de changement de phase
Soit un corps pur pouvant apparaitre sous deux phases?1,?2. On fait subir au corps une transformation de la
phase?1`a la phase?2. SoitH1l"enthalpie du corps (?1),H2l"enthalpie du corps (?2). ΔH= enthalpie de transformation =H2-H1= enthalpie de changement de phase. L1→2=ΔH1→2
m = Δh1→2=h2-h1= chaleur latente / enthalpie massique de changement de phase. Si le changement de phase est isotherme, on aura Δh1→2=TΔs1→2 Entropie massique de changement de phase : Δs1→2=L1→2 T Pour une transformation isobare, on aura ΔH=Qp?L1→2=q L1→2=-L2→1Δs1→2etL1→2sont de mˆeme signe.
Formule de Clapeyron :L1→2=T(v2-v1)dP
dT avecv1etv2les volumes massiques des phases 1 et 2.2.2 Titre massique en vapeur
On consid`ere un m´elangeL+G`a l"´equilibre. On appelle titre massique en vapeur le rapport : x=mv m totm v= masse de vapeur m tot= masse totaleTitre en liquide du m´elange :mL
m tot= 1-xVolume total :V=xmvV+ (1-x)mvL
Volume massique total :v=V
m =xvV+ (1-x)vL Ces expressions se g´en´eralisent `a n"importe grandeur extensive.3 Diagramme de Clapeyron
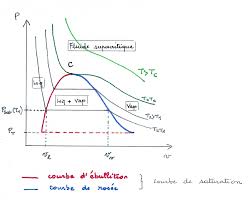
3.1 Isothermes d"Andrews
On consid`ere un syst`eme ferm´e auquel on fait subir une d´etente isotherme d"un ´etat liquide vers un ´etat gazeux.
On trace diff´erentes isothermes dans le diagramme de Clapeyron.SiT > Tc,Pest une fonction d´ecroissante dev.
SiT=Tc, on observe un point d"inflexion avec une tangente horizontale au passage par le point critique.
SiT < Tc, la d´etente se fait en 3 phases. D"abord, d´ecompression d"un liquide peu compressible, jusqu"`a la pression
de vapeur saturante o`u la premi`ere bulle de gaz apparait (point d"´ebulition). Si l"on continue `a fournir de la chaleur
2 http ://ptetoile.free.fr/ Corps pur sous deux phasesau syst`eme, le liquide continue `a de vaporiser jusqu"au point de ros´ee o`u la derni`ere goutte de liquide disparait (la
vapeur est s`eche). Le syst`eme redevient monophasique et est fortement compressible (pente faible). En A, la vapeur
est saturante s`eche. En B, le liquide est saturant.3.2 Paliers de changement de phases
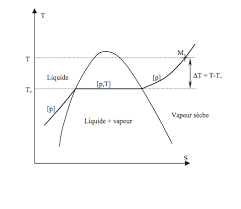
On peut lire directement sur le diagramme les volumes massiques : enA,v=vl(liquide saturant). EnB,v=vg(vapeur saturante). Pour un syst`eme diphasique repr´esent´e par le pointM, le volume massique du m´elangeL+Vse lit directement sur l"axe des abscisses.v=xvv+ (1-x)vlR`egle des moments :x=AM
AB4 Diagramme entropique
On veut tracer le diagramme (T,s) dans la zone o`u le corps pur peut ˆetre diphasique. On posera par convention
s= 0 au point triple (c"est un pointfixe).4.1 Courbe d"´ebulition
On consid`ere le liquide saturant, que l"on fait passer r´eversiblement de (T,s) `a (T+dT,s+ds) en restant sur la
courbe d"´ebulition. Siclest la capacit´e thermique massique du liquide, on aura :T=T0es c l. La courbe d"´ebulition est une exponentielle, mais seulement pas trop pr`es du point critique.4.2 Entropie d"un m´elangeL+V
L"entropie d"un m´elangeL+Vest donn´ee par : s(M) =s(T,x) =xLvap T +cllnµT T4.3 Construction du diagramme
On connait l"´equation de la courbe d"´ebulition, la courbe de ros´ee est d´ecrite parx= 1 dans l"expression de
l"entropie d"un m´elange :sros´ee=Lvap T +cllnµT TConnaissantLvap(T), on peut tra¸cer la courbe.
3 http ://ptetoile.free.fr/ Corps pur sous deux phases Pour les m´elanges diphasiques, les isobares sont des isothermes. Pours→+∞, la vapeur se comporte comme un gaz parfait.Les isothermes sont des isenthalpes.
Les isobares sont des exponentielles. Les liquides ´etant quasiment incompressibles, les isobares pour des liquides sont
tr`es proches de la courbe d"´ebulition.4.4 Utilisations
On peut calculer des aires, et donc des quantit´es de chaleur re¸cues :Z B ATds=qAB(rev).
La r`egle des moments s"applique aussi dans ce diagramme : x=AM ABTables thermodynamiques :ce sont des tables regroupant, pour un corps pur donn´e, les grandeurs n´ecessaires
pour d´eterminer l"entropie d"un m´elangeL+V. TP=Psat(T)
s l(T) s v(T)5 Diagramme de Mollier
C"est un diagramme enthalpique (h,s) dans la zone diphasique. On prendras= 0 eth= 0 au point triple. Au lieu
de faire des calculs d"aire dans le diagramme (T,s), on lit directement Δh=qp.5.1 Construction
- Pour la zone"vapeur», lorsques→ ∞, les isenthalpes sont des isothermes?une isotherme aura une asymptote
horizontale. - Les isobares sont des exponentielles :h=cpT0³ es c p-1´ . De plus, le long d"une isobare,dh=Tds,dh ds =T, les isobares sont des droites de penteT- Courbe de saturation : la courbe d"´ebulition correspond `a une isobare pour le liquide, le point critique ´etant le
point de temp´erature la plus ´elev´ee pour la courbe de saturation, c"est donc le point d"inflexion de la courbe de
saturation. L"enthalpie d"un m´elangeL+Vest :h(M) =h(x,T) =cl(T-T0) +xLvap(T)5.2 Utilisation
Par lecture directe, on d´etermine Δh
Calcul d"un titre massique :x=AM
ABIl existe aussi des tables thermodynamiques regroupant les valeurs n´ecessaies au calcule dehetspour un m´elange :
TP=Psat(T)
s l(T) s v(T) h l(T) h v(T) h(M) =xhl+ (1-x)hvs(M) =xsl+ (1-x)sv 4 http ://ptetoile.free.fr/ Corps pur sous deux phasesPour calculer des enthalpies de points ne figurant pas sur le diagramme, on consid`ere 2 point auxiliairesBetMsur
la mˆeme isotherme, et pour calculerhA, on sait quehM=xhB+ (1-x)hAce qui donne : hA=hM-xhB
1-x 5quotesdbs_dbs31.pdfusesText_37[PDF] variation dentropie dun mélange eau glace
[PDF] surfusion de leau exercice corrigé
[PDF] calculer la température finale dun mélange eau chaude-eau froide
[PDF] exercices corrigés thermodynamique changement détat
[PDF] le lait est il un mélange homogène ou hétérogène
[PDF] mélange homogène et hétérogène 5ème
[PDF] biere melange homogene ou heterogene
[PDF] lors d'une distillation le liquide se transforme en
[PDF] le sang est-il un mélange homogène ou hétérogène
[PDF] questions éthiques personne handicapée
[PDF] ethique et handicap
[PDF] l'intimité des personnes handicapées en institution
[PDF] tableau incompatibilité produits chimiques clp
[PDF] compatibilité stockage produits chimiques nouvel étiquetage
