 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
Formule de Clapeyron: Considérons un corps pur sous deux phases en équilibre ou encore titre en vapeur. Notation usuelle : il est d'usage d'utilise des ...
 PHYSIQUE 1
PHYSIQUE 1
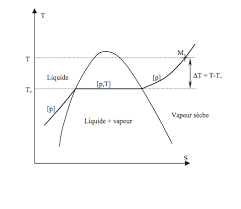
On rappelle que le titre massique en vapeur x d'un système liquide-vapeur est égal au rapport entre la masse mG d'eau à l'état de vapeur saturante et la masse
 La vapeur deau
La vapeur deau
Entre 5 et 80 bar la formule de Bertin permet d'estimer la masse volumique de la vapeur Parce qu'une vapeur dont le titre est de 0
 1 Titre massique en vapeur.
1 Titre massique en vapeur.
On appelle x le titre en vapeur : x est le rapport de la masse de vapeur d'eau contenue dans le récipient sur la masse totale m. 1/ Le récipient est
 Th3 - Changement de phase dun corps pur I. Quelques définitions
Th3 - Changement de phase dun corps pur I. Quelques définitions
On qualifie généralement les fractions molaires ou massique de "titre". Exemple : titre en vapeur d'un mélange "liquide-vapeur". On caractérise également
 DS n 2
DS n 2
massique indiqué wiT échangé par le fluide dans la turbine. On rappelle que le titre correspond à la fraction massique de la vapeur dans le mélange liquide-
 Titre alcoométrique volumique
Titre alcoométrique volumique
l'entraînement à la vapeur d'eau. Compléter à 200 ml avec de l'eau distillée La formule est valable pour les températures comprises entre –20 °C et +40 ...
 Titre Table des matières
Titre Table des matières
Cette formule s'applique aux fonds ou partie de fonds avec appareils à vapeur aux récipients de vapeur lorsqu'ils sont chauffés par la vapeur fournie par un.
 Thermodynamique Le corps pur sous plusieurs phases
Thermodynamique Le corps pur sous plusieurs phases
La pression de vapeur vaturante dépend de la température. 4 La formule de Le titre molaire en vapeur (resp. en liquide) d'un corps pur représente la ...
 Untitled
Untitled
23 janv. 2015 La formule expérimentale la plus Sample est due à Dupperay : P = 0965 X ... Les meilleures chaudières donnent une vapeur avec un titre de 0
 PHYSIQUE 1
PHYSIQUE 1
On rappelle que le titre massique en vapeur x d'un système liquide-vapeur est égal au rapport entre la masse mG d'eau à l'état de vapeur saturante et la
 La vapeur deau
La vapeur deau
Ainsi à l'aide de la formule de Duperray
 Fiche de Rappel
Fiche de Rappel
enthalpie H (ou à l'énergie interne U). Par exemple pour un système liquide-vapeur à l'équilibre
 Chapitre 7-Changement d état des corps purs. Cas particulier de l
Chapitre 7-Changement d état des corps purs. Cas particulier de l
On applique les formules précédentes pour caractériser le mélange On peut alors évaluer le titre de la vapeur x = (v-vl)/(vp-vl)=0.3 donc.
 1 Titre massique en vapeur.
1 Titre massique en vapeur.
7 juin 2012 On appelle x le titre en vapeur : x est le rapport de la masse de vapeur d'eau contenue dans le récipient sur la masse totale m. 1/ Le récipient ...
 Corps pur sous deux phases
Corps pur sous deux phases
Formule de Clapeyron : L1?2 = T (v2 ? v1). dP. dT avec v1 et v2 les volumes massiques des phases 1 et 2. 2.2 Titre massique en vapeur.
 SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
SERIE DEXERCICES N° 27 : THERMODYNAMIQUE : CORPS PUR
L'état final. F correspond à une vapeur saturante à la température T2 = 373 K (à la pression P2 = f (T2) = 1 bar ). Calculer le titre en vapeur xV2 dans l'état
 ÉTUDE DU CORPS PUR DIPHASÉ EN ÉQUILIBRE
ÉTUDE DU CORPS PUR DIPHASÉ EN ÉQUILIBRE
On étudiera les phases solide liquide
 DS SCIENCES PHYSIQUES MATHSPÉ
DS SCIENCES PHYSIQUES MATHSPÉ
25 oct. 2008 On rappelle que le titre massique en vapeur x d'un système liquide-vapeur est égal au ... (formule littérale puis application numérique).
 Titre alcoométrique volumique – Méthodes Type I
Titre alcoométrique volumique – Méthodes Type I
Appareil à entraînement par la vapeur d'eau comportant: - un générateur de vapeur d'eau; Formule permettant de calculer les tables alcoométrique.
 1 Titre massique en vapeur - Université Paris-Saclay
1 Titre massique en vapeur - Université Paris-Saclay
On appelle xle titre en vapeur : x est le rapport de la masse de vapeur d’eau contenue dans le r ecipient sur la masse totale m 1/ Le r ecipient est maintenu dans un thermostat a T= 373 K (100 C) (a) Quel est le volume massique v v de la vapeur d’eau a sa limite de saturation a la temp erature T? On supposera que la vapeur d’eau est un
 Changements d'états/Vaporisation et condensation — Wikiversité
Changements d'états/Vaporisation et condensation — Wikiversité
le titre en vapeur est alors x=m"/m Remarque importante : x s’exprimera en fonction des variables extensives utiles pratiquement le volume l’enthapie et l’entropie Raisonnons par exemple avec le volume : V=V’+V" ou les volumes sont totaux En grandeurs massiques V = mv = m’v’+m"v"
Comment calculer le titre de la vapeur ?
Le titre de la vapeur est la quantité de vapeur contenu dans le mélange eau-vapeur lors de la vaporisation. Le titre, noté X, est compris entre 0 et 1 et ne possède pas d'unité. Remarque: Le rapport se calcule pour un kg de mélange eau + vapeur et varie de 0 à 1. 1. Pour que X = 0, il faut que la masse de vapeur soit égale à 0.
Comment calculer le titre de vapeur saturante ?
On appelle xle titre de vapeur saturante défini r comme étant la proportion en masse de vapeur dans le mélange r liquide-vapeur. Pour l’unité de masse de corps, xest la masse de vapeur et 1 - xla masse de liquide. Soit le volume du mélange liquide-vapeur dans l’état A.
Qu'est-ce que le titre de vapeur d'une chaudière à vapeur industrielle ?
Lorsque l'on parle du titre de vapeur des chaudières à vapeur industrielles, on fait référence au pourcentage en masse de vapeur dans le mélange eau liquide-vapeur qui circule dans leurs installations. La valeur de ce pourcentage varie de 0 à 1.
Quelle est la valeur de la vapeur ?
La valeur de ce pourcentage varie de 0 à 1. La valeur 0 correspond à l'eau liquide (il n'y a pas de vapeur), et la valeur 1, à la vapeur saturée (tout est vapeur).

Étude du corps pur diphasé en équilibre (34-106) Page 1 sur 15 JN Beury solide liquidevapeur [gaz]fusion
vaporisation solidification condensation [liquéfaction] condensation à l'état solideÉTUDE DU CORPS PUR DIPHASÉ EN ÉQUILIBRE
I. DÉFÉNITIONS
Un corps pur peut exister sous différentes phases : solide, liquide, gaz, superfluide (liquide sans aucune viscosité obtenu
par diminution de la température), plasma (ionisation d'un gaz par augmentation de la température), condensat de Bose-
Einstein (solidification par agrégation de bosons, obtenu par refroidissement extrême).On étudiera les phases solide, liquide, vapeur [gaz]. On définira dans ce chapitre le fluide hypercritique. La vapeur est
l'état gazeux d'un corps qui est habituellement liquide ou solide dans les conditions standard (20°C, 1 atm). Exemple : Pour
l'eau à l'état gazeux, on emploie le terme : vapeur d'eau. Par contre, pour le diazote à l'état gazeux, on emploie le terme :
gaz diazote. Les phases liquide et vapeur sont séparées par un ménisque. La phase la plus dense se situe au dessous de la moins dense. On appelle changement d'état (ou transition de phase ou changement de phase) une transformation où tout le système ou une partie du système passe d'une phase à une autre. On emploie également les termes états solide, liquide, vapeur [gaz] au lieu de phases solide, liquide, vapeur [gaz]. On dit que la vapeur d'eau se condense alors que le gaz diazote se liquéfie. L'ébullition (hors programme) est un changement d'état liquide-vapeur en présence d'air.Le terme changement d'état peut prêter à confusion car en thermodynamique, une transformation correspond au passage
d'un état 1 à un état 2. On peut donc parler de changement d'état !L'état solide peut comporter plusieurs variétés allotropiques, qui traduisent les différents arrangements possibles du réseau
cristallin. La surfusion est l'état d'un système qui reste en phase liquide alors que sa température est plus basse que son point
De manière analogue, il y a retard à la vaporisation pour l'eau liquide dans la chambre à bulles et retard à la liquéfaction
pour la vapeur sursaturante dans la chambre de Wilson. On n'a jamais observé de retard à la fusion.
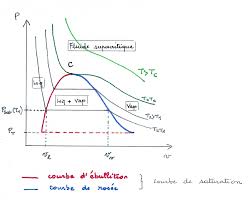
II. DIAGRAMME (P, T) POUR UN CORPS PUR
On considère un corps pur de masse m initialement à l'état solide (point A) qui subit une transformation isobare réversible. Le premier principe de la thermodynamique s'écrit :HQ. La pression p est
imposée par l'expérience. Le système reçoit effectivement un transfert thermique (Q > 0) qui lui permet : d'augmenter la température du solide (AB). La variance vaut 2 puisqu'on peut choisir p et T, de provoquer la fusion du solide. Lors du changement d'état (point B), on constate expérimentalement que la température ne varie pas. La variance vaut 1. Le changement d'état est isobare et isotherme au point B. Qreçu sert à casser les liaisons pour passer de l'état solide à l'état liquide. Une fois que tout le solide s'est transformé en liquide, Q reçu sert à augmenter la température jusqu'au point D. en D, la variance vaut 1. On a une vaporisation qui est aussi isobare et isotherme. une fois que tout le liquide s'est transformé en vapeur, Q reçu sert à augmenter la température jusqu'au point E.Pour de faibles pressions, on peut passer directement de l'état solide à l'état vapeur : c'est la sublimation. p
TVAPEUR
Étude du corps pur diphasé en équilibre (34-106) Page 2 sur 15 JN Beury p TTr ABII.2 Interprétation
a) Courbes de fusion, vaporisation et sublimationOn a trois courbes : fusion, vaporisation, sublimation. Pour chaque courbe, la variance vaut 1. On a donc une
relation caractéristique entre la pression et la température de changement d'état que l'on écrit sous la forme :
pfT.Les courbes de solidification, condensation et condensation à l'état solide sont confondues avec les courbes de
fusion, vaporisation et sublimation. b) Point tripleOn a coexistence des trois phases à T, P constants. Les courbes de fusion, sublimation et vaporisation se rejoignent
en ce point. La variance est nulle au point triple : la température et la pression sont caractéristiques du corps pur.
Point triple de l'eau : T = 273,16 K
0C ; p = 6×10
-3 bar.Point triple du SF
6 : T = 45,5°C ; p = 37 bar.Le point triple de l'eau sert de référence dans l'échelle internationale pratique de température.
c) Point critique et fluide hypercritique La courbe de vaporisation se termine au point C, appelé point critique.Exemple pour l'eau : T
C = 374°C ; p C = 220 bar. c1) Étude de deux types de transformations On considère la transformation AB isotherme réversible. Le système passe par le point I. On se trouve sur la courbe de vaporisation. En ce point, il y a deux phases liquide et vapeur. On observe expérimentalement un ménisque. Si on continue à augmenter la pression (IB), le ménisque disparaît et il y n'y a plus qu'une seule phase (liquide). On considère la transformation A'B' isotherme réversible. Pour arriver en B', le système ne passe jamais par la courbe de vaporisation. On n'observe à aucun moment de ménisque et de changement de phase. c2) Interprétation physique Les propriétés physiques du liquide et de la vapeur sont différentes pour T < T C et p < p C . Quand on se les différences des propriétés physiques des phases liquide et vapeurAu delà du point critique T T
C ou p p C , les propriétés physiques du liquide et de la vapeur sont fluide hypercritique gaz hypercritique. T C (CO 2 ) = 31°C. d) Bilan - Deux types de diagrammes (p, T)La pente de la courbe de fusion est quasi-verticale. La pente de la courbe de vaporisation est plus petite que la pente
de la courbe de sublimation au point triple.Le cas le plus général est celui où la pente de la courbe de fusion est positive. Pour quelques exceptions (l'eau par
exemple), la pente de la courbe de fusion est négative. Étude du corps pur diphasé en équilibre (34-106) Page 3 sur 15 JN Beury III. DÉFINITION DES ENTHALPIES ET ENTROPIES DE TRANSITION DE PHASE a) DéfinitionOn considère un solide et un liquide à la température et à la pression du changement d'état solide-liquide. La
variance vaut 1. La pression est donc reliée à la température par la relation pfT.On définit l
f la chaleur latente massique de fusion à la température T du changement d'état. l f est appelé également enthalpie massique de fusion notée SL hT fSLLS lT h T hT hTRemarques
Dans certains exercices, la chaleur latente massique est notée L. C'est une notation qui n'est pas conforme avec les
notations habituelles de thermodynamique où les grandeurs massiques sont notées en minuscules.On définit de même :
vLVVL lT h T hT hT = chaleur latente massique de vaporisation. sSVVS lT h T hT hT = chaleur latente massique de sublimation.On justifiera que ces trois grandeurs sont positives. C'est inutile de définir les chaleurs latentes massiques de
solidification, condensation, condensation à l'état solide puisqu'elles sont égales à l'opposé des chaleurs latentes
massiques de fusion, vaporisation et sublimation. b) Relation entre les enthalpies massiques de transition de phase au point triple Au point triple, les trois états solide, liquide et vapeur peuvent coexister. La variance vaut 0. On aV Tr S Tr V Tr L Tr L Tr S Tr
hT hT hT hT hT hT On en déduit immédiatement qu'au point triple : sTr f Tr v Tr lT lT lTIII.2 Entropie de transition de phase
On considère un solide et un liquide à la température et à la pression du changement d'état solide-liquide. La variance
vaut 1. La pression est donc reliée à la température par la relation pfT.On définit
SL l'entropie massique de fusion à la température T du changement d'état.SL L S
On a de même :
LV V L
: entropie massique de vaporisationSV V S
: entropie massique de sublimationOn justifiera que ces trois grandeurs sont positives. C'est inutile de définir les entropies massiques de solidification,
condensation, condensation à l'état solide puisqu'elles sont égales à l'opposée des entropies massiques de fusion,
vaporisation et sublimation. III.3 Relations entre les enthalpies et entropies massiques de transition de phaseLes enthalpies et entropies massiques de transition de phase sont des variations de fonctions d'état. Elles ne dépendent
pas du chemin suivi. On envisage une transformation réversible, isotherme et isobare qui fait passer une masse m de
l'état 1 (état solide) à l'état 2 (état liquide) à la pression pfT. , constantsétat 1 état 2
masse solide masse liquide Tp mm Étude du corps pur diphasé en équilibre (34-106) Page 4 sur 15 JN BeuryLe premier principe de la thermodynamique pour un système fermé avec une transformation isobare s'écrit :
21LSf, donc f Qml La transformation est réversible et isotherme. On a donc : QST
Comme T est constant :
f SL mlQSmsTTAprès simplification par m, on obtient :
f SL lTsTT v LV lTsTT et s SV lTsTT Interprétation physique des signes positifs des grandeurs , et fvs ll l: , etSL LV SV
sont positifs car le désordre augmente quand on passe de l'état solide, à l'état liquide puis à l'état gazeux.III.4 Résultats à connaître
On envisage une transformation qui fait passer une masse m de l'état 1 (état solide) à l'état 2 (état liquide) à la
pressionpfT. La pression et la température de l'état initial sont les mêmes à l'état final. La pression est
égale à la pression du changement d'état à la température T : pfT.état 1 état 2
masse solide masse liquide f f Hml mm mlSp fTT p fTTTOn envisage une transformation qui fait passer une masse m de l'état 1 (état liquide) à l'état 2 (état vapeur) à la
pression pfT :état 1 état 2
masse liquide masse vapeur v vOn envisage une transformation qui fait passer une masse m de l'état 1 (état solide) à l'état 2 (état vapeur) à la
pression pfT :état 1 état 2
masse solide masse vapeur s s Hml mmmlSpfTT pfTTT On envisage une transformation qui fait passer une masse m de liquide de la température T 1à la température T
2 . Si on suppose le liquide incompressible (tables incomplètes), on a alors : 212 12 1
état 1 état 2
masse liquide masse liquidelnHmc T T mm TSmcTTT' quotesdbs_dbs31.pdfusesText_37[PDF] variation dentropie dun mélange eau glace
[PDF] surfusion de leau exercice corrigé
[PDF] calculer la température finale dun mélange eau chaude-eau froide
[PDF] exercices corrigés thermodynamique changement détat
[PDF] le lait est il un mélange homogène ou hétérogène
[PDF] mélange homogène et hétérogène 5ème
[PDF] biere melange homogene ou heterogene
[PDF] lors d'une distillation le liquide se transforme en
[PDF] le sang est-il un mélange homogène ou hétérogène
[PDF] questions éthiques personne handicapée
[PDF] ethique et handicap
[PDF] l'intimité des personnes handicapées en institution
[PDF] tableau incompatibilité produits chimiques clp
[PDF] compatibilité stockage produits chimiques nouvel étiquetage
