 Chapitre 4 : Cristallographie
Chapitre 4 : Cristallographie
Solides cristallins et solides amorphes modèle du cristal parfait. On appelle solide tout système qui conserve une forme propre. On distingue les solides
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
PLAN DU COURS. I L'état cristallin. 1) Solides amorphes et solides cristallins. 2) Le modèle du cristal parfait. 3) Définitions fondamentales de
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
me ≃ 1836 ( c'est à dire la masse des électrons est très négligeable devant celle des nucleons). 7. Page 7. 1.1. RAPPEL. COURS DE CHIMIE-PCSI/MPSI
 Chapitre 5 :Systèmes cristallins
Chapitre 5 :Systèmes cristallins
I Vocabulaire de la cristallographie. A) Solide cristallin. Solide : Les constituants https://www.immae.eu/cours/. Page 2. Chapitre 5 : Systèmes cristallins.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
MPSI 2. Exercices de Chimie 2019-20. CRISTALLOGRAPHIE. Donnée : NA = 602.1023 mol-1. N°1 : Alliage or-argent. L'argent de rayon atomique rAg = 144 pm
 Cristallographie minéralogie
Cristallographie minéralogie
https://ipag.osug.fr/~beckp/Research/Teaching_files/mineralo_CAPES_2010.pdf
 Cristallographie
Cristallographie
motifs que contient cette maille : Le nombre de motifs que. Règles Un motif opportemont à compte. Ex : en. * Cutique: Chaque motif (8) apportiat à 8 mailles.
 Programme de Chimie 2ème année Sections MP-T et PC
Programme de Chimie 2ème année Sections MP-T et PC
Thème 1 : Cristallographie Cependant la progression retenue au cours d'un semestre doit respecter les objectifs de l'enseignement dispensé au cours de cette ...
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
Chapitre 4 : Cristallographie I Généralités sur l'état solide ? Solides cristallins et solides amorphes modèle du cristal parfait
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires 4 0 International” https://www immae eu/cours/
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins 1 3 Le modèle du cristal parfait Dans la suite du cours nous décrivons la
 [PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
[PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
On ne s'intéressera dans ce cours qu'à l'état cristallin et plus particulièrement au modèle du cristal parfait dans lequel la périodicité est parfaite
 [PDF] Solides cristallins - Étienne Thibierge
[PDF] Solides cristallins - Étienne Thibierge
11 déc 2017 · 4 - Définir et calculer la compacité C de la structure cubique centrée Exercice 2 : Galène [?00] L'élaboration du plomb par voie sèche
 [PDF] TD : Cristallographie Enoncés et éléments de réponses
[PDF] TD : Cristallographie Enoncés et éléments de réponses
TD : Cristallographie Structure du carbone solide (mines MP 2006) Structure cristalline du fer et de l'acier ( E3A MP 2008 )
 [PDF] CRISTALLOGRAPHIE - Chimie - PCSI
[PDF] CRISTALLOGRAPHIE - Chimie - PCSI
Page 1 sur 30 CRISTALLOGRAPHIE PLAN DU COURS I L'état cristallin 1) Solides amorphes et solides cristallins 2) Le modèle du cristal parfait
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
La cristallographie est l'étude des solides cristallins ou « cristaux » On se limite aux solides cristallins dont l'organisation sera supposé parfaitement
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires (abréviation CE) gardent une position fixe
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Cristallographie - Physique-Chimie – BCPST
[PDF] Cristallographie - Physique-Chimie – BCPST
La cristallographie a fait beaucoup de progrès au début du 20ème siècle avec la découverte de la diffraction des rayons X par Max
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins Table des matières 1 Les cristaux 1 1 1 La phase solide
 [PDF] Cristallographie - cpge paradise
[PDF] Cristallographie - cpge paradise
Cristallographie »Volume de la maille V = (213)? Z (anb) Aire du poralle logrenne ? Multiplicité d'une moitk = motifs que contient cette maille :
Comment comprendre la cristallographie ?
La cristallographie est une science en grande partie expérimentale mais qui est aussi basée sur des concepts mathématiques. Elle étudie l'organisation des atomes dans la matière pour en comprendre et en utiliser les propriétés.C'est quoi la coordinence en cristallographie ?
La coordinence (ou coordinance) d'un atome central dans une molécule ou un cristal est le nombre d'atomes, molécules ou ions voisins les plus proches dans les trois directions de l'espace et reliés à cet atome central. Elle s'appelle aussi le nombre de coordination ou l'indice de coordination.C'est quoi la population d'une maille ?
? La population de la maille est le nombre d'entités (atomes, molécules ou ions) par maille, on la note en général N. ? La coordinence d'un atome est le nombre de ses plus proches voisins.- Masse volumique La masse volumique d'un solide cristallin, ? = m V , est donnée par la masse contenue dans une maille divisée par le volume d'une maille. masse volumique du fer ? (de type CFC) est de 8,21 × 103 kg/m3.
 1/11
1/11 MP5 Chimie
plan du cours de structure de la matière révision du cours de première année ÉTUDE DE LA MATIÈRE À L"ÉTAT SOLIDE I) GÉNÉRALITÉS SUR LA MATIÈRE À L"ÉTAT SOLIDE :A l"état solide, la matière s"approche d"un modèle idéal ( théoriquement atteint à température absolue
nulle ) : l"état cristallin. Dans cet état, les différentes particules constitutives du solide ( atomes, ions ou
molécules ) sont réparties dans un arrangement périodique dans les différentes directions de l"espace
remarque : le solide s"éloigne de l"état cristallin idéal dans deux cas particuliers très importants :
* cas du solide amorphe : dans ce cas, l"arrangement périodique des particules est local et ne s"étend pas à
grande distance ( exemple : les verres ) * cas ( très fréquent ) où le solide présente des défauts, locaux ou linéairesII) ÉTUDE GÉNÉRALE D"UN CRISTAL :
1) La maille :
définition : la maille est la plus petite partie du cristal à partir de laquelle on peut, par translation selon les
trois directions " de référence » de cette maille, engendrer par la pensée le cristaldéfinitions : la maille est un parallélépipède ( non nécessairement rectangle ! ) engendré par trois vecteurs
OA OB OC, , ; la maille est entièrement déterminée par la connaissance de ces trois vecteurs ( dans un
référentiel quelconque ), c"est-à-dire par la connaissance des trois longueurs : a OA b OB c OC= = =, , et des trois angles : ()()()a b g= = =OB OC OC OA OA OB, , , , , 2/11 description du cristal par translation à partir d"une maille : toute translation Tm n p, , du type : T ma nb pcm n p, ,= + + où : ()m n p Z, ,Î et : a OA b OB c OC= = =, , permet de décrire tout le cristal ( lorsqu"on fait varier m, n, p )2) Le réseau :
simplification : dans les cristaux, les différentes particules ( atomes, ions, molécules ) occupent un
certains volume autour de certains sommets des différentes mailles. Pour décrire le cristal, on s"intéresse
seulement, dans un premier temps, à la disposition dans l"espace de ces différents " centres » des
particulesdéfinition : on appelle noeuds du cristal l"ensemble des sommets des différentes mailles autour desquels
se trouvent des particules. On appelle réseau cristallin l"arrangement tridimensionnel ou dans l"espace de
ces noeuds3) Le motif :
définition : on appelle motif du réseau cristallin l"ensemble des particules situées autour des noeuds du
réseau, à l"intérieur d"une maille la structure cristalline est l"association du réseau cristallin et du motif 3/11 III) LES DIFFÉRENTS RÉSEAUX CRISTALLINS :On peut classer l"ensemble des cristaux en sept catégories, selon la nature géométrique de la maille de ces
cristaux : c"est la classification de Bravais système cristallin nature de la maille côtés de la maille angles dans la maille cubique cube a = b = c a = b = g = 90° quadratique ou tétragonale prisme droit à base carrée a = b , c a = b = g = 90° orthorhombique prisme droit à base rectangulaire a , b , c a = b = g = 90° clinorhombique prisme incliné à base rectangulaire a , b , c a = g = 90° ; b¹°90 rhomboédrique ou trigonale rhomboèdre ( c"est-à-dire solide délimité par six losanges égaux a = b = c a = b = g ¹°90 hexagonal prisme droit à base losange ( d"angle au sommet 60° ) a = b = c a = b = 90° ; g = 120° triclinique parallélépipède quelconque a , b , c abg¹¹¹°90 4/11 IV) DÉFINITIONS GÉNÉRALES RELATIVES AUX CRISTAUX :les définitions ci-dessous sont rigoureusement précises pour un cristal dont les particules constitutives
peuvent être assimilées à des sphères1) Coordinence d"un cristal :
définition : la coordinence [x] d"un cristal est le nombre de plus proches voisins d"une sphère quelconque
du cristal2) Compacité d"un cristal :
définition : la compacité C d"un cristal est le rapport du volume occupé par les sphères constituant les
particules du cristal au volume total du cristal3) Sites des réseaux :
définition : on appelle site interstitiel ou cristallographique une cavité située dans l"espace laissé libre par
les sphères des particules constituant le réseau, qu"on peut alors appeler " réseau - hôte ». Les centres des
sites interstitiels coïncident avec les centres des polyèdres de coordination, réguliers ou non, ayant pour
sommets les centres des premiers voisins du réseau cristallin définitions :* un site cubique est une cavité située au centre d"un cube défini par huit particules en contact (la
coordinence d"un site cubique est donc 8)* un site tétraédrique est une cavité située au centre d"un tétraèdre régulier défini par quatre particules en
contact (la coordinence d"un site tétraédrique est donc 4)* un site octaédrique est une cavité située au centre d"un octaèdre régulier défini par six particules en
contact (la coordinence d"un site octaédrique est donc 6) condition géométrique d"occupation d"un site par un atome :si R est le rayon des atomes du réseau hôte et si r est le rayon de l"atome occupant un site interstitiel, la
condition géométrique pour que cet atome puisse occuper le site est : R + rle centre du polyèdre définissant le site et l"un des sommets les plus proches de ce polyèdre
tableau récapitulant ces conditions :Coordinence site
8 Cubique |préférentiellement| impossible 6 Octaédrique |préférentiellement| impossible impossible 4 tétraédrique préférentiellement| impossible impossible impossible 5/11 V) CLASSIFICATION DES CRISTAUX EN FONCTION DE LA NATURE CHIMIQUEDES LIAISONS CHIMIQUES :
Si l"on étudie ( ce qui est hors programme ) la nature de la liaison chimique qui intervient dans différents
types de cristaux, on est amené à distinguer :1) les cristaux métalliques :
la liaison métallique résulte de l"interaction électrostatique coulombienne entre les ions positifs, situés de
manière fixe à certains noeuds du réseau, et des charges négatives de certains électrons de la couche
externe qui peuvent très facilement se déplacer dans le champ électrique des ions positifs : ces électrons
sont appelés électrons de conduction ou gaz d"électrons et assurent la conductivité électrique ( grande ! )
des métauxUn cristal métallique est, géométriquement, constitué d"un assemblage d"atomes assimilables à des
sphères, chacune étant cotangente à ses plus proches voisines exemples : tous les métaux !2) les cristaux covalents :
un cristal covalent est un cristal dans lequel les atomes sont unis par des liaisons covalentes : un tel cristal
constitue une macromolécule covalente de taille infinieUn cristal covalent est, géométriquement, constitué d"un assemblage d"atomes assimilables à des sphères,
chacune étant cotangente à ses plus proches voisines exemples : C, Si, As3) les cristaux ioniques :
la liaison ionique résulte de l"attraction électrostatique entre ions de charges opposées, qui ont
généralement acquis la structure du gaz rare le plus proche, et de répulsions à courte distance
exemples : NaCl, CsCl, ZnS4) les cristaux moléculaires :
dans les cristaux moléculaires, la cohésion provient de l"interaction dipôle - dipôle entre les dipôles que
constituent les différentes molécules constituant le cristal exemples : Cl2, CH4, CO, CO2
6/11VI) LES CRISTAUX DE CORPS SIMPLES :
1) Les empilements compacts :
a) Maille cubique face centrée ( CFC ) :la maille est un cube ; les atomes sont placés aux sommets et au milieu des faces du cube
nombre d"atomes contenus en propre par la maille : 4 coordinence : [12] compacité : C= =p320 74,
nombre de sites octaédriques par maille : 4 nombre de sites tétraédriques par maille : 8 sites octaédriques : dans la structure CFC, les sites octaédriques sont : * le centre de la maille * le milieu de chaque arête de la maille nombre de sites octaédriques par maille : 4 rayon d"un site octaédrique : ()2 1 0 414- =r r, ( où r est le rayon d"une particule du cristal ) sites tétraédriques : dans la structure CFC, les sites tétraédriques sont :* les centres des cubes obtenus en découpant la maille en huiit cubes d"arête égale à la moitié de
l"arête de la maille nombre de sites tétraédriques par maille : 8 rayon d"un site tétraédrique : 321 0 225-
=r r, ( où r est le rayon d"une particule du cristal ) 7/11dans un réseau CFC, il y a autant de sites octaédriques O que de sites constituant le réseau - hôte
dans un réseau CFC, il y a deux fois plus de sites tétraédriques T que de sites constituant le réseau - hôte
exemples : de nombreux métaux : Ni, Cu, Ag, Au, Fe g, Al, Ca, Sr, Ce, Pb b) Maille hexagonale compacte ( HC ) : la maille élémentaire HC est un prisme droit à base losange nombre d"atomes contenus en propre par la maille : 2 coordinence : [12] compacité : C= =p320 74,
nombre de sites octaédriques par maille : 2 nombre de sites tétraédriques par maille : 4 sites octaédriques :dans la structure HC, les sites octaédriques sont situés au quart et aux trois quarts de la hauteur de
la maille ( orthogonalement aux plans de tassement maximal ) nombre de sites octaédriques par maille : 2 rayon d"un site octaédrique : ()2 1 0 414- =r r, ( où r est le rayon d"une particule du cristal ) sites tétraédriques :dans la structure HC, les sites tétraédriques sont situés au huitième et aux sept huitièmes de la
hauteur de la maille ( orthogonalement aux plans de tassement maximal ) nombre de sites tétraédriques par maille : 4 rayon d"un site tétraédrique : 321 0 225-
=r r, ( où r est le rayon d"une particule du cristal ) 8/11 exemples: de nombreux métaux : premier éléments de la colonne 2 :Be, Mg, éléments de la colonne 12 :
Zn, Cd, éléments de transition
remarque importante : les réseaux à maille HC et CFC sont les réseaux de plus grande compacité
2) Les empilements non compacts :
a) Maille cubique centrée ( CC ) : la maille est un cube ; les atomes sont placés aux sommets et au centre du cube nombre d"atomes contenus en propre par la maille : 2 coordinence : 8 compacité : C= =p380 68,
exemples : métaux alcalins, baryum, fer a b) Maille cubique simple : la maille est un cube ; les atomes sont placés aux sommets du cube nombre d"atomes contenus en propre par la maille : 1 9/11 coordinence : [6] compacité : C = 0,51 nombre de sites cubiques par maille : 1en réalité, aucun corps simple ne cristallise dans un réseau cubique simple, mais le site cubique est
souvent utilisé comme site interstitiel ( voir ci - dessous ) c) Structure de type diamant :c"est une structure de type CFC où les atomes de carbone occupent simultanément toutes les positions
d"un réseau CFC et la moitié de ses sites tétraédriques nombre d"atomes contenus en propre par la maille : 8 coordinence : [4] compacité :C= »p3
160 34,C = 0,51
d) Structure de type graphite :c"est une structure hexagonale non compacte, résultant de l"empilement de couches parallèles ; la maille
est un prisme droit à base losange, mais il n"y a d"atomes qu"aux noeuds du réseau VII) LES CRISTAUX DE CORPS COMPOSÉS IONIQUES BINAIRES :1) Généralités :
définition : on appelle corps composé ionique binaire un composé ionique constitué uniquement de deux
types d"ions : un anion et un cation principes généraux :1) le cristal est électriquement neutre
2) les ions les plus petits ( en général les cations ), de rayon r, viennent occuper les sites interstitiels du
réseau - hôte constitué par les ions les plus gros, de rayon R, afin d"être en contact avec ceux-ci (ceci
résultant du fait que les forces d"attraction électrostatique tendent à mettre en contact cations et anions, les
forces de répulsion tendant au contraire à séparer les espèces dont la charge électrique est de même
signe) : il y a donc contact entre les ions de signes contraire et non entre les ions de même signe, le réseau
hôte étant déforméconséquence : le rayon de l"ion occupant le site doit être supérieur au rayon du site occupé
on en déduit, à partir de l"étude faite au paragraphe IV)3) : 10/11 coordinence site 8 Cubique impossible impossible impossible |préférentiellement|impossible 6Octaédrique
impossible impossible |préférentiellement | possible | impossible 4 tétraédrique impossible | préférentiellement| possible possible impossibledémarche générale à suivre dans la détermination de la structure cristalline d"un cristal ionique :
1) recherche, dans une table, des rayons ioniques des ions intervenant dans le cristal ionique
2) identification, à partir du rapport r/R, de la nature du site cristallographique occupé par les ions les plus
petits3) détermination du réseau des ions plus gros
4) analyse de la structure
nomenclature: on définit en général la structure d"un cristal ionique par référence à un composé ionique
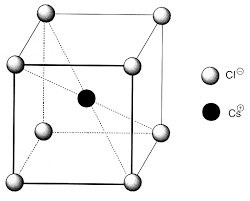
connue ayant la même structure cristalline2) Structure du type chlorure de césium CsCl :
les ions Cl - forment un réseau cubique simple, ce qui correspond à la présence d"un ion Cl- par maille les ions Cs+ occupent tous les sites cubiques du réseau cubique simple des ions Cl- ( afin d"être en nombre
égal avec les ions Cl
-, pour respecter la condition d"électroneutralité du cristal ) : ces ions forment donc un second réseau cubique simple décalé d"une demi - diagonale de celui des ions Cl nombre de motifs CsCl par maille : 1 coordinence : on peut définir trois coordinences différentes : Cl -/Cl- = Cs+/Cs+ = [6] Cs +/Cl- = Cl-/Cs+ = [8] compacité : C = 0,683 11/113) Structure du type chlorure de sodium NaCl :
les ions Cl - forment un réseau cubique à faces centrées les ions Na+ occupent tous les sites octaédriques du réseau CFC des ions Cl- ( afin d"être en nombre égal
avec les ions Cl -, pour respecter la condition d"électroneutralité du cristal ) : ces ions forment donc un second réseau CFC décalé d"une demi - arête de celui des ions Cl nombre de motifs CsCl par maille : 4 coordinence : on peut définir trois coordinences différentes : Cl -/Cl- = Na+/Na+ = [12] Na +/Cl- = Cl-/Na+ = [6] compacité : C = 0,6674) Structure du type blende ZnS :
les ions S2- forment un réseau cubique à faces centrées
les ions Zn2+ occupent la moitié des sites tétraédriques du réseau CFC des ions S2- ( afin d"être en nombre
égal avec les ions S
2-, pour respecter la condition d"électroneutralité du cristal )
nombre de motifs ZnS par maille : 4 coordinence : on peut définir trois coordinences différentes : S2-/S2- = Zn2+/Zn2+ = [12]
Zn2+/S2- = S2-/Zn2+ = [4]
quotesdbs_dbs32.pdfusesText_38[PDF] les différentes formes de cybercriminalité pdf
[PDF] cycle de l'eau explication
[PDF] résumé cycle de l'eau
[PDF] les différentes étapes du cycle de l'eau
[PDF] cycle de l'eau schéma simple
[PDF] cycle de l'eau schéma ? compléter
[PDF] schéma cycle de l'eau 5ème
[PDF] cycle de l'eau cours pdf
[PDF] lalgèbre linéaire cours et exercices corrigés
[PDF] algebre generale exercices corrigés pdf
[PDF] pdf algebre premier cycle
[PDF] livre automatisme industriel pdf
[PDF] cours d'automatisme et informatique industrielle pdf
[PDF] cours de base automatisme

