 Chapitre 4 : Cristallographie
Chapitre 4 : Cristallographie
Solides cristallins et solides amorphes modèle du cristal parfait. On appelle solide tout système qui conserve une forme propre. On distingue les solides
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
PLAN DU COURS. I L'état cristallin. 1) Solides amorphes et solides cristallins. 2) Le modèle du cristal parfait. 3) Définitions fondamentales de
 cristallographie 2a mp 2016
cristallographie 2a mp 2016
plan du cours de structure de la matière révision du cours de première année. ÉTUDE DE LA MATIÈRE À L'ÉTAT SOLIDE. I) GÉNÉRALITÉS SUR LA MATIÈRE À L'ÉTAT
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
me ≃ 1836 ( c'est à dire la masse des électrons est très négligeable devant celle des nucleons). 7. Page 7. 1.1. RAPPEL. COURS DE CHIMIE-PCSI/MPSI
 Chapitre 5 :Systèmes cristallins
Chapitre 5 :Systèmes cristallins
I Vocabulaire de la cristallographie. A) Solide cristallin. Solide : Les constituants https://www.immae.eu/cours/. Page 2. Chapitre 5 : Systèmes cristallins.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
MPSI 2. Exercices de Chimie 2019-20. CRISTALLOGRAPHIE. Donnée : NA = 602.1023 mol-1. N°1 : Alliage or-argent. L'argent de rayon atomique rAg = 144 pm
 Cristallographie minéralogie
Cristallographie minéralogie
https://ipag.osug.fr/~beckp/Research/Teaching_files/mineralo_CAPES_2010.pdf
 Cristallographie
Cristallographie
motifs que contient cette maille : Le nombre de motifs que. Règles Un motif opportemont à compte. Ex : en. * Cutique: Chaque motif (8) apportiat à 8 mailles.
 Programme de Chimie 2ème année Sections MP-T et PC
Programme de Chimie 2ème année Sections MP-T et PC
Thème 1 : Cristallographie Cependant la progression retenue au cours d'un semestre doit respecter les objectifs de l'enseignement dispensé au cours de cette ...
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
Chapitre 4 : Cristallographie I Généralités sur l'état solide ? Solides cristallins et solides amorphes modèle du cristal parfait
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires 4 0 International” https://www immae eu/cours/
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins 1 3 Le modèle du cristal parfait Dans la suite du cours nous décrivons la
 [PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
[PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
On ne s'intéressera dans ce cours qu'à l'état cristallin et plus particulièrement au modèle du cristal parfait dans lequel la périodicité est parfaite
 [PDF] Solides cristallins - Étienne Thibierge
[PDF] Solides cristallins - Étienne Thibierge
11 déc 2017 · 4 - Définir et calculer la compacité C de la structure cubique centrée Exercice 2 : Galène [?00] L'élaboration du plomb par voie sèche
 [PDF] TD : Cristallographie Enoncés et éléments de réponses
[PDF] TD : Cristallographie Enoncés et éléments de réponses
TD : Cristallographie Structure du carbone solide (mines MP 2006) Structure cristalline du fer et de l'acier ( E3A MP 2008 )
 [PDF] CRISTALLOGRAPHIE - Chimie - PCSI
[PDF] CRISTALLOGRAPHIE - Chimie - PCSI
Page 1 sur 30 CRISTALLOGRAPHIE PLAN DU COURS I L'état cristallin 1) Solides amorphes et solides cristallins 2) Le modèle du cristal parfait
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
La cristallographie est l'étude des solides cristallins ou « cristaux » On se limite aux solides cristallins dont l'organisation sera supposé parfaitement
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires (abréviation CE) gardent une position fixe
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Cristallographie - Physique-Chimie – BCPST
[PDF] Cristallographie - Physique-Chimie – BCPST
La cristallographie a fait beaucoup de progrès au début du 20ème siècle avec la découverte de la diffraction des rayons X par Max
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins Table des matières 1 Les cristaux 1 1 1 La phase solide
 [PDF] Cristallographie - cpge paradise
[PDF] Cristallographie - cpge paradise
Cristallographie »Volume de la maille V = (213)? Z (anb) Aire du poralle logrenne ? Multiplicité d'une moitk = motifs que contient cette maille :
Comment comprendre la cristallographie ?
La cristallographie est une science en grande partie expérimentale mais qui est aussi basée sur des concepts mathématiques. Elle étudie l'organisation des atomes dans la matière pour en comprendre et en utiliser les propriétés.C'est quoi la coordinence en cristallographie ?
La coordinence (ou coordinance) d'un atome central dans une molécule ou un cristal est le nombre d'atomes, molécules ou ions voisins les plus proches dans les trois directions de l'espace et reliés à cet atome central. Elle s'appelle aussi le nombre de coordination ou l'indice de coordination.C'est quoi la population d'une maille ?
? La population de la maille est le nombre d'entités (atomes, molécules ou ions) par maille, on la note en général N. ? La coordinence d'un atome est le nombre de ses plus proches voisins.- Masse volumique La masse volumique d'un solide cristallin, ? = m V , est donnée par la masse contenue dans une maille divisée par le volume d'une maille. masse volumique du fer ? (de type CFC) est de 8,21 × 103 kg/m3.
Page 1
TD : Cristallographie
Structure du carbone solide (mines MP 2006)
Le carbone solide existe dans la nature sous deux structures cristallines différentes : le graphite et le
1- Représenter la maille cristalline du diamant.
2- Définir et calculer la coordinence et le nombre d'atomes par maille.
3- Donner la relation liant le paramètre de maille noté a et le rayon r d'un atome de carbone. 4- En déduire la compacité du diamant (la valeur numérique devra être calculée).
5- Calculer la masse volumique du diamant.
6- Le diamant contient-il des sites permettant d'accueillir des atomes supplémentaires ? Si oui,
7- Exprimer la densité du graphite en fonction de la longueur de liaison l
1 carbone-carbone dans les M C = 12 g.mol -1 ; Nombre d'Avogadro : 6.10 23mol -1 ; Rayon de l'atome de carbone : r =
SOLUTION
Les atomes de C occupent une cfc avec la moitié des sites tétraédriques occupés 2 - La coordinence d'un atome est le nombre d'atomes les plus proches à cet atome. Chaque atome est entouré de 4 atomes proches coordinance égale à 4. Nombre d'atmes par maille = 4x1/4+6x1/2+8x1/8= 8 atomes par maille.3- Les atomes sont tangents selon la grande diagonale du cube (
site tétraédrique ) .4- La compacité est :
et 34,0C5- La masse volumique est :
6- Sites tétraédriques : les centres des 4 tétraédres vides soit 4 par maille.
Sites octaédriques : un au centre du cube et 12 au milieu des arêtes soit 4 par maille.7- .)m.g(10.3,2d
36eaugraphitegraphite et le nombre d'atomes par maille est égale à 1x1/1+ 2x1/2 + 4x1/4 + 8x1/8 = 4.
Sachant que
et Structure cristalline du fer et de l'acier ( E3A MP 2008 ) ouaali 2Page 2
Données numériques :M(Fe) 55,85 g.mol
-1 , M(C) 12 g.mol -1 , nombre d'Avogadro : N A qui adopte la structure cubique à faces centrées. est R129 pm. Calculer le paramètre a
de la maille cubique. du fer .Le carbone, dont le rayon atomique vaut R
C77 pm, doit s'insérer dans les sites octaédriques des
ou de fer .6- Où sont situés les sites octaédriques dans le fer ? S'agit-il d'octaèdres réguliers ?
d'un atome qui s'insérerait dans ce site sans déformer la solide ?SOLUTION
Les atomes sont placés aux sommets et au centre des faces du cube.2- Elle renferme Z = 8x1/8 + 6x1/2, soit 4 atomes /maille.
3- La compacité est :
Les atomes sont tangents selon la diagonale de la face :On en déduit :
4- .)pm(365a
5- .)Kg.m(10.3,1u 1346- La maille renferme un site octaédrique au centre et 12 sites octaédriques aux milieux des arêtes.
Ce sont des octaèdres réguliers.
7- aR2R2
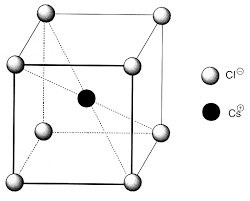
max,Oct et R41,0R max,Oct .)pm(53R max,Oct 8- max,octC RR l'atome de carbone ne peut pas s'insérer dans un site octaédrique, donc il occupe la position de l'atome de fer. La solubilité se fait par substitution. Cristaux d'iodure de césium et d'iodure de sodium: Les iodures de sodium et de césium possèdent des structures cubiques dans lesquelles les ouaali 3Page 3
1- Pour )I,Na(
: la coordinance est 6 chaque cationNa est
entouré de 6 anionsI et réciproquement pour
I c'est la structure
de NaCl. Pour )I,Cs( : la coordinance est 8 chaque cationNa est entouré
de 8 anionsI et réciproquement pour
Cs c'est la structure de
CsCl.2- Les ions I
et Na sont tangents selon l'arête : )rr(2aINaNaI
.)pm(227r I Le réseau des anions est compact si ils sont tangents selon la diagonale d'une face : .)pm(908r4 I etLe réseau des
anions n'est pas compact.3- Les ions I
et Cs sont tangents selon la grande diagonale: .)pm(488a CsI4- Pour NaI :
etPour CsI :
etStructure de la blende (Mines PSI 2008 )
Dans le cristal de blende ZnS, les ions Zn
2+ et S 2- jouent des rôles symétriques. On peut ainsi décrire ȡ de la blende en fonction du paramètre a de laSOLUTION
Coordinence :
[Zn 2+/ S 2- ] = [S 2- /Zn 2+ ] = 4 coordinance 4/4 (tétraédrique). ouaali 4Page 4
2- Nombre de motifs par maille :
S 2- : 8x1/8 + 6x1/2 =4 et Zn 2+ : 4x 1 = 4 soit Z = 4 motifsZnS/maille.
3-La plus petite distance entre Zn
2+ et S 2- est suivant la grande diagonale du cube : 2222SZnSZn
rrd : le modèle des sphères dures n'est pas valable.Structure du magnésium (Mines 2005 PSI )
Le magnésium métal cristallise dans une structure hexagonale compacte qu'on admettra idéale.
- Représenter la maille élémentaire de cette structure (prisme droit à base losange). - Montrer que la relation donnant la hauteur h de la maille en fonction de la distance interatomique - Calculer la compacité ou coefficient de remplissage de la structure.1,7. En déduire une valeur
24 g.mol-1, NA 6.1023 mol-
SOLUTION
La pseudo-maille renferme :1 atome à l'intérieur, 8 atomes sur les bases.2- AJ = h/2 ; BC = DE =EB = AC = AD = AE= AB = d = 2R
Triangle ABJ:
3/2BHBJ (*)
Triangle BCD :
Les 3 relations (*)
3- Nombre d'atomes par pseudo-maille (1/3 de maille hexagonale
Z = 4x1/6 + 4x1/12 + 1 = 2.atomes par maille.
et en tenant compte de et R2d S4- .)m.g(10.7,1d
36eauMgMg et .)pm(153R ouaali 5
Page 5
Cristal d'oxyde de magnésium:
L'oxyde de magnésium MgO a une structure type NaCl.Les ions O
2- sont aux sommets du cube et au centre des faces (forment un cfc). Les ions Na occupent tous les sites octaédriques cad le centre du cube et les milieux des arêtes. b- Le nombre de O 2- par maille : Z(O 2- ) = 4 et le nombre de Mg 2+quotesdbs_dbs11.pdfusesText_17[PDF] les différentes formes de cybercriminalité pdf
[PDF] cycle de l'eau explication
[PDF] résumé cycle de l'eau
[PDF] les différentes étapes du cycle de l'eau
[PDF] cycle de l'eau schéma simple
[PDF] cycle de l'eau schéma ? compléter
[PDF] schéma cycle de l'eau 5ème
[PDF] cycle de l'eau cours pdf
[PDF] lalgèbre linéaire cours et exercices corrigés
[PDF] algebre generale exercices corrigés pdf
[PDF] pdf algebre premier cycle
[PDF] livre automatisme industriel pdf
[PDF] cours d'automatisme et informatique industrielle pdf
[PDF] cours de base automatisme
