 Chapitre 4 : Cristallographie
Chapitre 4 : Cristallographie
Solides cristallins et solides amorphes modèle du cristal parfait. On appelle solide tout système qui conserve une forme propre. On distingue les solides
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
PLAN DU COURS. I L'état cristallin. 1) Solides amorphes et solides cristallins. 2) Le modèle du cristal parfait. 3) Définitions fondamentales de
 cristallographie 2a mp 2016
cristallographie 2a mp 2016
plan du cours de structure de la matière révision du cours de première année. ÉTUDE DE LA MATIÈRE À L'ÉTAT SOLIDE. I) GÉNÉRALITÉS SUR LA MATIÈRE À L'ÉTAT
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
me ≃ 1836 ( c'est à dire la masse des électrons est très négligeable devant celle des nucleons). 7. Page 7. 1.1. RAPPEL. COURS DE CHIMIE-PCSI/MPSI
 Chapitre 5 :Systèmes cristallins
Chapitre 5 :Systèmes cristallins
I Vocabulaire de la cristallographie. A) Solide cristallin. Solide : Les constituants https://www.immae.eu/cours/. Page 2. Chapitre 5 : Systèmes cristallins.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
MPSI 2. Exercices de Chimie 2019-20. CRISTALLOGRAPHIE. Donnée : NA = 602.1023 mol-1. N°1 : Alliage or-argent. L'argent de rayon atomique rAg = 144 pm
 Cristallographie minéralogie
Cristallographie minéralogie
https://ipag.osug.fr/~beckp/Research/Teaching_files/mineralo_CAPES_2010.pdf
 Cristallographie
Cristallographie
motifs que contient cette maille : Le nombre de motifs que. Règles Un motif opportemont à compte. Ex : en. * Cutique: Chaque motif (8) apportiat à 8 mailles.
 Programme de Chimie 2ème année Sections MP-T et PC
Programme de Chimie 2ème année Sections MP-T et PC
Thème 1 : Cristallographie Cependant la progression retenue au cours d'un semestre doit respecter les objectifs de l'enseignement dispensé au cours de cette ...
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
Chapitre 4 : Cristallographie I Généralités sur l'état solide ? Solides cristallins et solides amorphes modèle du cristal parfait
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires 4 0 International” https://www immae eu/cours/
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins 1 3 Le modèle du cristal parfait Dans la suite du cours nous décrivons la
 [PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
[PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
On ne s'intéressera dans ce cours qu'à l'état cristallin et plus particulièrement au modèle du cristal parfait dans lequel la périodicité est parfaite
 [PDF] Solides cristallins - Étienne Thibierge
[PDF] Solides cristallins - Étienne Thibierge
11 déc 2017 · 4 - Définir et calculer la compacité C de la structure cubique centrée Exercice 2 : Galène [?00] L'élaboration du plomb par voie sèche
 [PDF] TD : Cristallographie Enoncés et éléments de réponses
[PDF] TD : Cristallographie Enoncés et éléments de réponses
TD : Cristallographie Structure du carbone solide (mines MP 2006) Structure cristalline du fer et de l'acier ( E3A MP 2008 )
 [PDF] CRISTALLOGRAPHIE - Chimie - PCSI
[PDF] CRISTALLOGRAPHIE - Chimie - PCSI
Page 1 sur 30 CRISTALLOGRAPHIE PLAN DU COURS I L'état cristallin 1) Solides amorphes et solides cristallins 2) Le modèle du cristal parfait
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
La cristallographie est l'étude des solides cristallins ou « cristaux » On se limite aux solides cristallins dont l'organisation sera supposé parfaitement
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires (abréviation CE) gardent une position fixe
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Cristallographie - Physique-Chimie – BCPST
[PDF] Cristallographie - Physique-Chimie – BCPST
La cristallographie a fait beaucoup de progrès au début du 20ème siècle avec la découverte de la diffraction des rayons X par Max
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins Table des matières 1 Les cristaux 1 1 1 La phase solide
 [PDF] Cristallographie - cpge paradise
[PDF] Cristallographie - cpge paradise
Cristallographie »Volume de la maille V = (213)? Z (anb) Aire du poralle logrenne ? Multiplicité d'une moitk = motifs que contient cette maille :
Comment comprendre la cristallographie ?
La cristallographie est une science en grande partie expérimentale mais qui est aussi basée sur des concepts mathématiques. Elle étudie l'organisation des atomes dans la matière pour en comprendre et en utiliser les propriétés.C'est quoi la coordinence en cristallographie ?
La coordinence (ou coordinance) d'un atome central dans une molécule ou un cristal est le nombre d'atomes, molécules ou ions voisins les plus proches dans les trois directions de l'espace et reliés à cet atome central. Elle s'appelle aussi le nombre de coordination ou l'indice de coordination.C'est quoi la population d'une maille ?
? La population de la maille est le nombre d'entités (atomes, molécules ou ions) par maille, on la note en général N. ? La coordinence d'un atome est le nombre de ses plus proches voisins.- Masse volumique La masse volumique d'un solide cristallin, ? = m V , est donnée par la masse contenue dans une maille divisée par le volume d'une maille. masse volumique du fer ? (de type CFC) est de 8,21 × 103 kg/m3.
![[PDF] Solides cristallins - Étienne Thibierge [PDF] Solides cristallins - Étienne Thibierge](https://pdfprof.com/Listes/17/48478-17td_am5_cristallo.pdf.pdf.jpg) Architecture de la matière 5 - Travaux dirigésLangevin-Wallon, PTSI 2017-2018
Architecture de la matière 5 - Travaux dirigésLangevin-Wallon, PTSI 2017-2018 Solides cristallinsArchitecture de la matière 5 - Travaux dirigésLangevin-Wallon, PTSI 2017-2018
Solides cristallins
Exercices
Exercice 1 : Structure cristalline du niobium []Le niobium Nb, élément de numéro atomiqueZ= 41et de masse molaireM= 92,0g·mol-1,
cristallise à température ambiante dans la structure cubique centrée CC de paramètre de maille
a= 330pm. Les atomes occupent les sommets et le centre d"une maille cubique, voir ci-contre.1 -Déterminer la populationNde la maille.
2 -Calculer la masse volumiqueρdu niobium.
3 -Déterminer le rayon métalliqueRdu niobium en précisant au préalable où a lieu le contact entre les atomes.
4 -Définir et calculer la compacitéCde la structure cubique centrée.
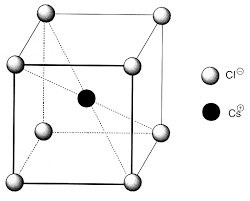
Exercice 2 : Galène []
L"élaboration du plomb par voie sèche repose sur l"extraction et l"exploitation d"un minerai appelé galène : le
sulfure de plomb PbS. Ce minerai cristallise selon une structure du type chlorure de sodium, où les cations Pb
2+ occupent les sites octaédriques d"un réseau CFC d"anions S 2-. Données :MPb= 207,2g·mol-1;MS= 32,1g·mol-1; densité de la galène 7,62.1 -Représenter la maille élémentaire de la galène.
2 -Déterminer la coordinence de chacun des ions de cette structure.
3 -Déterminer le paramètre de mailleade la structure.
Exercice 3 : Trioxyde de tungstène []
Le trioxyde de tungstène WO
3solide est, en première approche, un solide ionique. Il présente une structure
cubique telle que les ions tungstène W6+occupent les sommets de la maille et les ions oxyde O2-le milieu des arêtes.
On noteale paramètre de maille.
1 -Dessiner une maille et vérifier la stoëchiométrie du cristal.
2 -On admet une tangence anion-cation. Calculer la compacité du cristal WO3.
3 -Le centre du cube et les centres des faces de la maille dessinée précédemment sont vides. Calculer le rayon maximal
d"un hétéroélément qui pourrait s"insérer dans ces sites sans déformation de la structure.
4 -On observe expérimentalement que les cationsM+, oùMpeut être H, Li, Na ou K, peuvent s"insérer dans le
cristal et occupent tous le même type de site. En déduire de quel site il s"agit.EspèceH +Li+Na+K+O2-W6+Rayon ionique (pm)10 -578,0 98,0 133 132 62,0Exercice 4 : Alliages du cuivre []Le cuivre peut être utilisé pur, notamment pour des applications exploitant sa haute conductivité électrique, ou
bien en alliage, tel que le laiton (alliage cuivre-zinc) et le bronze (alliage cuivre-étain).Données :
?masse volumique du cuivre pur :ρCu= 8,96·103kg·m-3; ?masses molaires :MCu= 63,5g·mol-1;MAg= 108g·mol-1;MZn= 65,4g·mol-1; ?rayons métalliques :rCu= 128pm;rAg= 144pm;rZn= 134pm.1 -Le cuivre pur cristallise dans un réseau cubique faces centrées. Représenter la maille et déterminer sa population.
Déterminer le paramètre de maillea.
1/3Étienne Thibierge, 11 décembre 2017,www.etienne-thibierge.fr
TD AM5 : Solides cristallins Langevin-Wallon, PTSI 2017-2018Lorsqu"un atome a un rayon voisin de celui du cuivre, il peut former des alliages dits de substitution, où l"hété-
roatome remplace un ou plusieurs atomes de cuivre par maille.2 -L"alliage Cu-Ag est utiliser pour augmenter la résistance à la température du matériau. Dans cette structure, les
atomes d"argent remplacent les atomes de cuivre aux sommets de la maille CFC.2.a -Faire un schéma de la maille. Quelle est la stoëchiométrie de l"alliage?
2.b -Déterminer le nouveau paramètre de maillea?ainsi que la masse volumiqueρ?de l"alliage. Commenter.
3 -Le laiton, alliage Cu-Zn, est l"alliage le plus fabriqué. Il permet d"augmenter la résistance mécanique et la dureté
du cuivre, mais diminue la densité et la conductivité thermique. La structure du laiton peut être décrite par un
réseau cubique hôte d"atomes de cuivre avec un atome de zinc au centre du cube.3.a -Faire un schéma de la maille. Quelle est la stoëchiométrie de l"alliage?
3.b -Déterminer le nouveau paramètre de maillea??ainsi que la masse volumiqueρ??de l"alliage.
4 -Les différences structurales induites par la substitution sont responsables d"une modification des propriétés de
conduction électrique et de résistance mécanique. Proposer une explication.Exercice 5 : Solide ionique ou covalent? []
L"objectif de cet exercice est de déterminer lequel des modèles de liaison ionique ou covalente décrit le mieux
l"iodure cuivreux CuI. Les atomes d"iode y forment un réseau cubique faces centrées où les atomes de cuivre occupent
la moitié des sites tétraédriques en alternance. On mesure expérimentalement un paramètre de maillea= 615pm.
Données :
?Électronégativités de Pauling :χ(I) = 2,66etχ(Cu) = 1,90; ?Rayons ioniques :R(I-) = 220pm,R(Cu+) = 96pmetR(Cu2+) = 73pm; ?Rayons covalents :R(I) = 133pmetR(Cu) = 117pm.1 -Représenter la maille CFC et déterminer sa population. Rappeler la localisation des sites tétraédriques dans la
maille et en déduire leur nombre. Conclure quant à la stoëchiométrie du cristal.2 -Donner la structure électronique de l"iode (Z= 53) et du cuivre (Z= 29). Le cuivre est une exception à la règle
de Klechkowski : contrairement à ce que prévoit cette règle, sa dernière sous-couchedest pleine.
Étudions dans un premier temps l"iodure cuivreux en supposant qu"il s"agit d"un solide ionique.3 -Quels sont les ions monoatomiques les plus stables que ces deux éléments peuvent former? Cela est-il cohérent
avec la stoëchiométrie du cristal?4 -Pour qu"un cristal ionique soit stable, il faut qu"il y ait davantage de contact entre ions de charge opposée qu"entre
ions de même charge. Montrer que pour que les cations et les anions puissent être en contact il faut que les rayons
ioniques soient tels queR(Cu+)R(I-)>?3
2 -1.Compte tenu des valeurs numériques données en début d"énoncé, que peut-on en conclure?
5 -Déterminer le paramètre de maille théoriqueaide l"iodure cuivreux en fonction des rayons ioniques. Comparer
sa valeur à celle mesurée. Conclure. Considérons maintenant que les liaisons sont de nature covalente au sein de l"iodure cuivreux.6 -Déterminer sans calcul supplémentaire le paramètre de mailleacdans le modèle covalent. Conclure quant à la
nature des liaisons au sein du cristal.7 -Pouvait-on anticiper ces résultats compte tenu des électronégativités des deux éléments?Annale de concours
Exercice 6 : Oxyde de zirconium solide [écrit PT 2015,]Les piles à combustible à oxyde solide permettent d"avoir en contact deux phases solide et gazeuse, ce qui supprime
les problèmes liés à la gestion de trois phases, notamment la corrosion. Les électrodes sont poreuses de façon à
permettre un transport rapide des gaz. Un matériau de choix pour l"électrolyte est l"oxyde de zirconium, appelé
zircone, stabilisé à l"yttrium.1 -Le zirconium se situe dans la classification périodique (fournie en annexe du sujet original, à reprendre dans votre
cours AM2) dans la colonne du titane, directement en dessous de cet élément. Indiquer à quelle famille d"éléments
appartient le zirconium.2 -Indiquer la configuration électronique fondamentale du titane et celle du zirconium.
3 -Énoncer les règles utilisées pour établir ces configurations électroniques.
2/3Étienne Thibierge, 11 décembre 2017,www.etienne-thibierge.fr
TD AM5 : Solides cristallins Langevin-Wallon, PTSI 2017-2018 La zircone peut être assimilée à un cristal ionique formé de cations Zr4+et d"anions O2-assimilés à des sphères
dures de rayons respectifsr+etr-. Les cations sont distribués aux noeuds d"un réseau cubique faces centrées cfc.
4 -Représenter la maille conventionnelle d"une structure de cations cfc. Indiquer le nombre de cations par maille.
5 -Donner sans démonstration la compacité d"une telle structure dans le cas d"une maille métallique. Commenter.
6 -Indiquer où se situent les sites tétraédriques de cette maille. Combien y en a-t-il?
7 -Exprimer le rayon maximalr-de la particule sphérique pouvant s"insérer dans ces sites sans induire de déformation
en fonction dea, le paramètre de la maille et der+. Les anions occupent tous les sites tétraédriques de la maille cfc formée par les cations.8 -Déterminer le nombre d"anions contenus dans cette maille.
9 -Indiquer alors la formule de la zircone.
10 -Donner la coordinence des anions par rapport aux cations, et des cations par rapport aux anions.
11 -Exprimer la masse volumique de la zircone en fonction du paramètre de maillea, de la masse molaireMZrdu
zirconium, de la masse molaireMOde l"oxygène et du nombre d"Avogadro.La formule de l"oxyde d"yttrium est Y
2O3.12 -En déduire la charge du cation yttrium.
13 -Le dopage consiste à substituer dans la maille élémentaire de l"oxyde de zirconium une fraction molairexdes
cations Zr4+par des cations yttrium. Expliquer pourquoi l"électroneutralité de la structure n"est alors pas respectée.
14 -Proposer une modification de la formule chimique impliquant le nombreyd"anions O2-présents dans la zircone
dopée à l"oxyde d"yttrium, au moyen dex, pour rétablir cette électroneutralité.Résolution de problème
Pour aborder un exercice de type résolution de problème, il peut notamment être utile de faire un
schéma modèle, d"identifier et nommer les grandeurs pertinentes, d"utiliser l"analyse dimensionnelle,
de proposer des hypothèses simplificatrices, de décomposer le problème en des sous-problèmes simples,
etc. Le candidat peut également être amené à proposer des valeurs numériques raisonnables pour
les grandeurs manquantes ... et toutes les valeurs données ne sont pas forcément utiles. Le tout est
évidemment à adapter à la situation proposée !Exercice 7 : Un glaçon qui coule!? [] Expliquer pourquoi le glaçon d"eau deutérée D2O coule au fond du verre. Des valeurs numériques sont attendues
en appui du raisonnement.D est le deutérium, aussi noté
2H : c"est un isotope de l"hydrogène dont le noyau contient un neutron. La glace
ordinaire cristallise dans un réseau hexagonal compact1, dont la maille est représentée à droite. Il s"agit d"un prisme
à base losange de côtéa= 452pmet de hauteurc= 739pm, dans laquelleγ= 2π/3.H2O(s)H
2O(liq)D
2O(s)1. Pour la culture, il s"agit du réseau obtenu par empilement compact ABAB. C"est de là que vient la valeur de l"angleγ.
3/3Étienne Thibierge, 11 décembre 2017,www.etienne-thibierge.fr
TD AM5 : Solides cristallins Langevin-Wallon, PTSI 2017-20184/3Étienne Thibierge, 11 décembre 2017,www.etienne-thibierge.fr
Architecture de la matière 5 - Correction des travaux dirigésLangevin-Wallon, PTSI 2017-2018Solides cristallinsArchitecture de la matière 5 - Correction des travaux dirigésLangevin-Wallon, PTSI 2017-2018
Solides cristallins
Exercices
Exercice 1 : Structure cristalline du niobium
1Un atome sur un des sommets est partagé entre huit mailles et compte pour1/8, l"atome central n"appartient
qu"à une seule maille, doncN= 8×18
+ 1 = 2.2La masse d"un atome de niobium est égale àmNb=M/NA, la masse d"une maille vaut donc2M/NA, d"où
ρ=2MN
Aa3= 8,51·103kg·m-3.3La distance entre atomes situés sur deux sommets vauta, celle entre atomes situé sur un sommet et au centre
de la maille vauta⎷3/2< a: le contact a donc lieu le long de la grande diagonale du cube. Ainsi, en comptant
successivement les atomes, a ⎷3 =R+ 2R+Rd"oùR=⎷3 4a= 143pm.4La compacité est la proportion du volume de la maille réellement occupé par la matière. Dans le cas de la
structure CC,C=2×43
πR3a
3=8π3
⎷3 4 3 d"oùC=π⎷3 8 = 0,68.Exercice 2 : Galène1Voir figure 1.
Figure 1-Maille élémentaire de la galène.Les anions S2-sont représentés en vert, les cations Pb2+en gris. Version
couleur sur le site de la classe.2Raisonnons d"abord sur un cation. Le plus simple pour la visualisation est de raisonner à partir du cation situé
au centre du cube. Ses plus proches voisins sont les anions situés au centre des six faces du cube, distants dea/2.
Les cations ont donc une coordinence 6.
Raisonnons maintenant sur un anion, en considérant par exemple celui situé au centre de la face avant de la maille
représentée. Ses plus proches voisins sont les cations situés au milieu des arêtes du cube, auquel il ne faut pas oublier
1/7Étienne Thibierge, 11 décembre 2017,www.etienne-thibierge.fr
Correction TD AM5 : Solides cristallins Langevin-Wallon, PTSI 2017-2018d"ajouter le cation central de la maille représentée et le cation central de l"autre maille à laquelle appartient la face
considérée. On en déduit queles anions ont également une coordinence 6.3La population d"une maille CFC est de 4 (8×1/8 + 6×1/2), d"où on déduit la population en anionsNS2-= 4,
et elle compte quatre sites octaédriques en propre (1 au centre et 1 au centre de chacune des 12 arêtes, ces arêtes
étant partagées entre 4 mailles). On en déduit la population en cationsNPb2+= 4. Ainsi, la masse volumique de la
galène vautρ=4MPb+ 4MSN
Aa3d"oùa=?4(MPb+MS)N
Aρ?
1/3 = 596pm.Exercice 3 : Trioxyde de tungstène
1Voir figure 2. Cette maille compte8×1/2 = 1cation W6+et12×1/4 = 3anions O2-. On retrouve bien la
stoëchiométrie WO3.Figure 2-Maille élémentaire du trioxyde de tungstène.Les anions O2-sont représentés en rouge, les cations W6+
en bleu. Version couleur sur le site de la classe.2Le contact anion-cation se fait selon l"arête du cube, donca= 2RW+ 2RO= 388pm. On en déduit alors la
compacité, C=43πR3W+ 3×43
πR3O(2RW+ 2RO)3= 0,51.3Les anions O
2-ont un rayon ionique supérieur aux cations W6+, ce sont donc eux qui contraignent l"habitabilité
des sites. Pour loger un hétéroélément au centre d"une face, il faut que son rayonRsoit tel que
-RO= 62pm.Pour loger un hétéroélément au centre du cube, la contrainte est imposée par les anions au centre de deux arêtes
opposées le long de la " diagonale » du cube. On en déduit 2 -RO= 142pm.4H+pourrait s"insérer dans les deux types de sites, mais les autres cations alcalins ne peuvent s"insérer qu"au
centre du cube.Exercice 4 : Alliages du cuivre
1Voir cours :N= 8×18
+ 6×12 = 4. Dans une maille CFC, il y a contact entre atomes le long de la diagonale d"une face. Ainsi, a ⎷2 = 4rCud"oùa=4rCu⎷2= 361pm2.aSchéma à faire. La maille compte8×1/8 = 1atome d"argent et6×1/2 = 3atomes de cuivre, l"alliage est
donc Cu 3Ag.quotesdbs_dbs32.pdfusesText_38[PDF] les différentes formes de cybercriminalité pdf
[PDF] cycle de l'eau explication
[PDF] résumé cycle de l'eau
[PDF] les différentes étapes du cycle de l'eau
[PDF] cycle de l'eau schéma simple
[PDF] cycle de l'eau schéma ? compléter
[PDF] schéma cycle de l'eau 5ème
[PDF] cycle de l'eau cours pdf
[PDF] lalgèbre linéaire cours et exercices corrigés
[PDF] algebre generale exercices corrigés pdf
[PDF] pdf algebre premier cycle
[PDF] livre automatisme industriel pdf
[PDF] cours d'automatisme et informatique industrielle pdf
[PDF] cours de base automatisme
