 Chapitre 4 : Cristallographie
Chapitre 4 : Cristallographie
Solides cristallins et solides amorphes modèle du cristal parfait. On appelle solide tout système qui conserve une forme propre. On distingue les solides
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
PLAN DU COURS. I L'état cristallin. 1) Solides amorphes et solides cristallins. 2) Le modèle du cristal parfait. 3) Définitions fondamentales de
 cristallographie 2a mp 2016
cristallographie 2a mp 2016
plan du cours de structure de la matière révision du cours de première année. ÉTUDE DE LA MATIÈRE À L'ÉTAT SOLIDE. I) GÉNÉRALITÉS SUR LA MATIÈRE À L'ÉTAT
 COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
COURS DE CHIMIE-PCSI/MPSI/TSI- elfilalisaid@yahoo.fr Page -2
me ≃ 1836 ( c'est à dire la masse des électrons est très négligeable devant celle des nucleons). 7. Page 7. 1.1. RAPPEL. COURS DE CHIMIE-PCSI/MPSI
 Chapitre 5 :Systèmes cristallins
Chapitre 5 :Systèmes cristallins
I Vocabulaire de la cristallographie. A) Solide cristallin. Solide : Les constituants https://www.immae.eu/cours/. Page 2. Chapitre 5 : Systèmes cristallins.
 CRISTALLOGRAPHIE
CRISTALLOGRAPHIE
MPSI 2. Exercices de Chimie 2019-20. CRISTALLOGRAPHIE. Donnée : NA = 602.1023 mol-1. N°1 : Alliage or-argent. L'argent de rayon atomique rAg = 144 pm
 Cristallographie minéralogie
Cristallographie minéralogie
https://ipag.osug.fr/~beckp/Research/Teaching_files/mineralo_CAPES_2010.pdf
 Cristallographie
Cristallographie
motifs que contient cette maille : Le nombre de motifs que. Règles Un motif opportemont à compte. Ex : en. * Cutique: Chaque motif (8) apportiat à 8 mailles.
 Programme de Chimie 2ème année Sections MP-T et PC
Programme de Chimie 2ème année Sections MP-T et PC
Thème 1 : Cristallographie Cependant la progression retenue au cours d'un semestre doit respecter les objectifs de l'enseignement dispensé au cours de cette ...
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
Chapitre 4 : Cristallographie I Généralités sur l'état solide ? Solides cristallins et solides amorphes modèle du cristal parfait
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires 4 0 International” https://www immae eu/cours/
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins 1 3 Le modèle du cristal parfait Dans la suite du cours nous décrivons la
 [PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
[PDF] Poly-13x14-Cristallographiepdf - Physique-Chimie – BCPST
On ne s'intéressera dans ce cours qu'à l'état cristallin et plus particulièrement au modèle du cristal parfait dans lequel la périodicité est parfaite
 [PDF] Solides cristallins - Étienne Thibierge
[PDF] Solides cristallins - Étienne Thibierge
11 déc 2017 · 4 - Définir et calculer la compacité C de la structure cubique centrée Exercice 2 : Galène [?00] L'élaboration du plomb par voie sèche
 [PDF] TD : Cristallographie Enoncés et éléments de réponses
[PDF] TD : Cristallographie Enoncés et éléments de réponses
TD : Cristallographie Structure du carbone solide (mines MP 2006) Structure cristalline du fer et de l'acier ( E3A MP 2008 )
 [PDF] CRISTALLOGRAPHIE - Chimie - PCSI
[PDF] CRISTALLOGRAPHIE - Chimie - PCSI
Page 1 sur 30 CRISTALLOGRAPHIE PLAN DU COURS I L'état cristallin 1) Solides amorphes et solides cristallins 2) Le modèle du cristal parfait
 [PDF] Chapitre 4 : Cristallographie - Free
[PDF] Chapitre 4 : Cristallographie - Free
La cristallographie est l'étude des solides cristallins ou « cristaux » On se limite aux solides cristallins dont l'organisation sera supposé parfaitement
 [PDF] Chapitre 5 :Systèmes cristallins - Melusine
[PDF] Chapitre 5 :Systèmes cristallins - Melusine
I Vocabulaire de la cristallographie A) Solide cristallin Solide : Les constituants élémentaires (abréviation CE) gardent une position fixe
 [PDF] cristallographie 2a mp 2016 - Unisciel
[PDF] cristallographie 2a mp 2016 - Unisciel
plan du cours de structure de la matière révision du cours de première année définition : on appelle site interstitiel ou cristallographique une cavité
 [PDF] Plan du cours Cristallographie - Chimie en PCSI
[PDF] Plan du cours Cristallographie - Chimie en PCSI
Un cristal est un arrangement triplement périodique d'atomes d'ions ou de molécules 2014 Année Internationale de la Cristallographie Premier chapitre de l'
 [PDF] Cristallographie - Physique-Chimie – BCPST
[PDF] Cristallographie - Physique-Chimie – BCPST
La cristallographie a fait beaucoup de progrès au début du 20ème siècle avec la découverte de la diffraction des rayons X par Max
 [PDF] Cours CH3 Solides cristallins - Thierry FERRARI
[PDF] Cours CH3 Solides cristallins - Thierry FERRARI
MPSI – 2018-2019 – Lycée Jeanne d'Albret D Malka CH3 – Solides cristallins Table des matières 1 Les cristaux 1 1 1 La phase solide
 [PDF] Cristallographie - cpge paradise
[PDF] Cristallographie - cpge paradise
Cristallographie »Volume de la maille V = (213)? Z (anb) Aire du poralle logrenne ? Multiplicité d'une moitk = motifs que contient cette maille :
Comment comprendre la cristallographie ?
La cristallographie est une science en grande partie expérimentale mais qui est aussi basée sur des concepts mathématiques. Elle étudie l'organisation des atomes dans la matière pour en comprendre et en utiliser les propriétés.C'est quoi la coordinence en cristallographie ?
La coordinence (ou coordinance) d'un atome central dans une molécule ou un cristal est le nombre d'atomes, molécules ou ions voisins les plus proches dans les trois directions de l'espace et reliés à cet atome central. Elle s'appelle aussi le nombre de coordination ou l'indice de coordination.C'est quoi la population d'une maille ?
? La population de la maille est le nombre d'entités (atomes, molécules ou ions) par maille, on la note en général N. ? La coordinence d'un atome est le nombre de ses plus proches voisins.- Masse volumique La masse volumique d'un solide cristallin, ? = m V , est donnée par la masse contenue dans une maille divisée par le volume d'une maille. masse volumique du fer ? (de type CFC) est de 8,21 × 103 kg/m3.
Matériaux 7 :
Cristallographie
La cristallographie a fait beaucoup de progrès au début du 20ème siècle avec la découverte de la diffraction des rayons X par Max
Von Laue (prix Nobel 1914).
microscopique.1B I·pPMP VROLGH : ordre et désordre
L'Ġtat solide est un Ġtat condensĠ (ordonnĠ ou non) caractĠrisĠ par : - des entités chimiques (atomes, ions, molécules) en contact - des vides interstitiels de taille inférieure à celle des entités chimiques On distingue l'état amorphe et l'état cristallin : - Etat cristallin : état le plus ordonné de la matière : o Les atomes, molécules ou ions occupent une place bien déterminée, o Le cristal présente une périodicité spatiale o Température de fusion nette - État amorphe ͗ c'est un état désordonné de la matière condensée o Dans cet état, les atomes, molécules ou ions ont des positions spatiales non périodiqueso La tempĠrature de fusion n'est pas bien dĠfinie (la fusion s'opğre sur une plage parfois large de tempĠrature).
o Si le refroidissement est lent : les atomes, molécules ou ions ont " le temps ͩ de s'organiser les uns par rapport
intermoléculaires. Ö Un refroidissement lent permet d'atteindre un Ġtat solide cristallino Si le refroidissement est brutal (= trempe) : les atomes, molécules ou ions sont " figés ͩ dans l'Ġtat dĠsordonnĠ
Ö Un refroidissement brutal permet d'atteindre un Ġtat solide amorphepériodicité est parfaite. On admet que ce modèle est valable dès lors que la périodicité est observable sur des distances de
l'ordre de 100 m.2. Notions de cristallographie
2.1. Motif
- On appelle motif le plus petit " ensemble chimique ͩ (atome, molĠcule ou ion, ou ensemble d'atomes, de molĠcules, ou
Expl : Dans le cristal de cuivre : motif = {un atome de cuivre} Dans le cristal de fluorure de calcium : motif = {un ensemble Ca2+, 2 Fо} -2-2.2. Réseau
- Le réseau est un outil géométrique permettant de dĠcrire la pĠriodicitĠ d'une structure cristalline.
- Pour obtenir l'ensemble du cristal, il suffit de faire des opérations de translation : un réseau est défini par trois vecteurs de
translation, notés a b et c , tels que tout vecteur qui relie deux noeuds (N1 et N2) quelconques du réseau puisse s'Ġcrire sous la forme : 12NN = n1 a + n2 b + n3 c (avec n1, n2 et n3 des entiers relatifs)Expl : réseau à 2D (у papier peint)
Papier peint Réseau Motif
2.3. Maille
maille.- La maille conventionnelle est la maille généralement utilisée pour étudier simplement le cristal.
Expl :
+ 20 -3-2.4. Systèmes cristallins
- Systèmes cristallins : Il est possible de définir 7 formes de mailles qui définissent 7 systèmes cristallins :
Système cristallin Nature de la maille Paramètres cristallinsCubique Cube a = b = c
= = = 90° Quadratique Prisme droit à base carrée a с b т c = = = 90° Orthorhombique Prisme droit à base rectangulaire a т b т c = = = 90° Monoclinique Prisme incliné à base rectangulaire a т b т c = = 90°, т 90ΣRhomboédrique Rhomboèdre
(toutes les faces sont des losanges) a = b = c = = т 90Σ Hexagonal Prisme droit à base losange a с b т c = = 90°, = 120° Triclinique Parallélépipède quelconque a т b т cMode simple (P) :
Motif situé aux sommets de
la mailleMode centré (I) :
Motifs situés aux sommets et
au centre de la mailleMode base centrée (S) :
Motifs situés aux sommets et
aux centres des deux faces parallèlesMode faces centrées (F) :
Motifs situés aux sommets et
aux centres de toutes les faces- Réseaux au programme : L'association des 7 types de mailles et des 4 modes de peuplement conduit à la définition de 14
types des réseaux, appelés réseaux de Bravais.Seuls 4 de ces réseaux sont au programme :
Cubique Cubique Cubique à Hexagonal
Simple Centré Faces Centrées
2.5. Population de la maille
Si Z = 1, on parle de maille unitaire
Si Z > 1, on parle de maille multiple
inclus dans la maille. -4-Expl : Cubique à faces centrées
Représentation compacte Représentation éclatée Atomes en propre à la maille
Un atome au sommet d'une maille est partagĠ par 8 mailles. Chaque maille ne possède donc que 1/8ème de sphère. Il y a 8 sommets. D'autre part, un atome au centre d'une face est partagĠ par 2 mailles. Il y a 6 faces.Population de la maille : 8 sommets x 1/8ème motif + 6 faces x ½ motif = 4 motifs Z = 4
A retenir :
Sphère sur un sommet : 1/8ème appartient à la maille Sphğre au milieu d'une face : ½ appartient à la maille Sphğre au milieu d'une arġte : ¼ appartient à la maille2.6. Coordinence
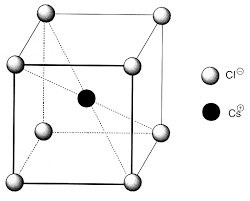
- La coordinence est le nombre de plus proches voisins que possède un point. ces 12 autres sphères).La coordinence vaut donc 12.
2.7. Masse volumique du cristal
- Masse volumique :- Si le cristal est parfait, il est obtenu par répétition tripériodique de la maille. La masse volumique du cristal est donc égale à
celle de la maille : o Si la maille contient Z motifs, la masse de matière dans la maille vaut : o La masse volumique de la maille vaut donc : -5-2.8. Compacité C
- Compacité : c'est le taudž de remplissage de la maille (proportion de l'espace rĠellement occupĠ par la matiğre).
- Calcul : - Sens physique :3. Cohésion dans un cristal
3B1B FROpVLRQ G·XQ ŃULVPMO
- CohĠsion d'un cristal : La cohĠsion d'un cristal est assurĠe par des forces de nature et d'intensité différentes. Ce sont ces
forces qui maintiennent les entités chimiques proches les unes des autres. Plus ces forces sont intenses, plus la matière est
cohĠsiǀe. Les changements d'Ġtat nĠcessiteront alors d'atteindre des tempĠratures ĠleǀĠes.
- En fonction du type de force responsable de cette cohésion, on classe le cristal selon quatre catégories :
Cristal métallique
Cristal ionique
Cristal covalent
Cristal moléculaire
Ö Chaque type de cristal possède des caractéristiques physiques qui lui sont propres :3.2. Cristaux métalliques
- Les métaux cristallisent dans cette catégorie.- Leur cohésion est due à la liaison métallique : celle-ci est décrite par le modğle du gaz d'Ġlectrons libres : chaque atome
métallique M, qui a une position fixe dans le cristal, " partage » un électron de valence aǀec l'ensemble des autres atomes.
>[ensemble des électrons " libres » est dĠlocalisĠ sur l'intĠgralitĠ du cristal. -6-- La liaison métallique peut être vue comme le rĠsultat d'une interaction coulombienne entre électrons libres et cations M+
fixes. - Propriétés des cristaux métalliques : Excellente conductivité électrique et thermique Éclat métallique
Caractère réducteur
Dureté variable
- Allotropie : Certains composĠs peuǀent adopter ă l'Ġtat solide des structures cristallines diffĠrentes en fonction de la
Entre 13 °C et 162 °C, l'étain solide est sous une forme dite ɴ de masse volumique 7,28 g.cm-3.
poudre.En dessous de 13 °C, l'étain blanc se transforme lentement en étain gris, de structure diamant, c'est la forme dite ɲ, de
densité 5,75 g.cm-3.3.3. Cristaux ioniques
- Cristal ionique : Assemblage électriquement neutre de cations et d'anions- Les anions sont issus d'atomes relatiǀement ĠlectronĠgatifs (à droite dans la classification) ; les cations, d'atomes peu
électronégatifs (à gauche dans la classification)- La cohésion du cristal est assurĠe par l'attraction électrostatique entre anions et cations, modérée par les répulsions entre
ions de même signe. - Propriétés des cristaux ioniques : Température de fusion élevée (car force électrostatique anion-cation très intense)
3.4. Cristaux covalents
- Dans un cristal covalent, les atomes sont liés entre eux par une (ou plusieurs) liaisons covalentes. La mise en commun
d'Ġlectrons de valence entre atomes assure donc la cohésion du cristal.Expl : Cristal de carbone diamant : chaque atome de carbone est lié à 4 autres atomes de carbone
Diamant taillé Maille cristalline (un bâton gris = 1 liaison covalente)
- Propriétés des cristaux covalents : Cristaux rigides
Température de fusion élevée (liaisons covalentes difficiles à rompre) Grande dureté
Cristaux isolants ou semi-conducteurs
-7-3.5. Cristaux moléculaires
- Un cristal moléculaire est un assemblage de molécules, retenues les unes avec autres, par des forces intermoléculaires
(liaisons de Van der Waals et éventuellement liaisons hydrogène). Expl : Le sucre cristallisé est un assemblage de molécules de saccharose La glace, un assemblage solide de molécules H2O - Propriétés des cristaux moléculaires : Temp. de fusion faible (les forces intermoléculaires sont moins fortes que les liaisons ioniques ou covalentes)
Cristaux friables et de faible dureté
Cristaux isolants électriques
4. Cristaux métalliques
Modèle des sphères dures : les atomes métalliques sont assimilés à des sphères dures de rayon r.
- Cristaux métalliques ͗ rĠpartition d'atomes de métal dans le réseau (motif = un atome)
Ö Une sphère rigide indéformable = un atome de métal- Rayon métallique : moitié de la distance séparant deux noyaux lorsque les atomes (neutres) du métal sont en contact.
4.1. Empilements compacts de sphères dures
On s'intĠresse ici audž diffĠrentes faĕons d'empiler des sphğres dures de maniğre compacte, c'est-à-dire en minimisant la
proportion de vide dans la structure (= obtenir une compacité maximale). - Les sphères sont assemblées de façon à occuper un volume minimal. Ligne 1D compacte : Pour minimiser le vide, il faut que les sphères se touchentPlan 2D compact : Cela revient à placer une deuxième ligne en quinconce par rapport à la première
Couche A
-8- - Passage à trois dimensions : par empilement des plans les uns au dessus des autres :1ère couche : notée A chaque sphère est entourée de 6 sphères et 6 creux.
2ème couche : notée B une seule possibilité : positionner les sphères du nouveau plan à la verticale des creux formés
dans la couche A. Il existe six creux autour d'une sphğre, seuls trois peuvent être occupés3ème couche : il y a 2 possibilités pour ajouter un troisiğme Ġtage ă l'ensemble de 2 couches dĠjă constituĠ :
¾ Soit, les sphères de la 3ème couche sont placĠes d'aplomb ă celles de la 1ère couche (puis les sphères de la 4ème
couche sont ă l'aplomb de celles de la 2ème couche, et ainsi de suite) : on obtient un empilement A-B-A-B.
Arrangement {AB}
Structure dite hexagonale compacte
¾ Soit, les sphères de la 3ème couche se superposent aux creux inoccupés de la 1ère couche (puis les sphères de la 4ème
couche se superposent à celles de la 1ère couche et ainsi de suite) : on obtient un empilement de trois couches
orientées différemment.Arrangement dit {ABC}
Structure cubique à faces centrées
-9-4.2. Empilement compact 1 : Structure cubique à faces centrées (cfc)
- Etude de la structure :Réseau = cubique ; Mode = faces centrées
Motif : 1 atome métallique
Maille conventionnelle :
Représentation compacte Représentation éclatée Atomes en propre à la maille
Population : Calcul déjà fait précédemment : Z = 4Coordinence : Chaque sphère est entourée de 12 autres sphğres. En effet, la structure cfc est issue d'un empilement
compact de plans compacts (ABC). Chaque atome est en contact avec 6 sphères de son propre plan (B), 3 sphères du
plan supérieur (C) et 3 sphères du plan inférieur (A).Relation de tangence entre atomes : La distance la plus courte séparant deux atomes est la demi-diagonale d'une face.
A retenir :
Arête du cube : a
Diagonale d'une face : a
2Diagonale du cube : a
3 -10-quotesdbs_dbs11.pdfusesText_17[PDF] les différentes formes de cybercriminalité pdf
[PDF] cycle de l'eau explication
[PDF] résumé cycle de l'eau
[PDF] les différentes étapes du cycle de l'eau
[PDF] cycle de l'eau schéma simple
[PDF] cycle de l'eau schéma ? compléter
[PDF] schéma cycle de l'eau 5ème
[PDF] cycle de l'eau cours pdf
[PDF] lalgèbre linéaire cours et exercices corrigés
[PDF] algebre generale exercices corrigés pdf
[PDF] pdf algebre premier cycle
[PDF] livre automatisme industriel pdf
[PDF] cours d'automatisme et informatique industrielle pdf
[PDF] cours de base automatisme
