 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
ne peuvent plus réduire les ions MnO4- en Mn2+ . On relève la chute de burette dès que la coloration rose persiste. Dans la burette : -
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Pour éviter ce problème on utilisera le sel de Mohr
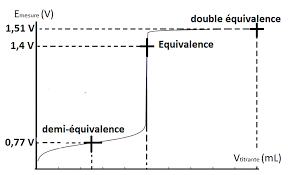 Dosage potentiométrique
Dosage potentiométrique
Etudions l'exemple du dosage des ions fer Fe2+ par les ions permanganate MnO4. - ions ferreux Fe2+ en solution mais le sel de Mohr est moins facilement ...
 Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en
solution de sel de Mohr connaissant la concentration d'une solution de permanganate de potassium acidifiée constituée d'ions permanganate MnO4. -. S Maret.
 Méthodes de titrage en électrochimie
Méthodes de titrage en électrochimie
2 mai 2020 d'une des méthodes présentées dans ce cours. Exemple de TP : titrages potentiométriques du fer (II) dans le sel de Mohr par. KMnO4. Introduction.
 Analyse physique-chimique des eaux destinées à la consommation
Analyse physique-chimique des eaux destinées à la consommation
Oxydation de sel de MOHR par le KMnO4 : L'équation de la réaction de titrage Pour cela avant tout dosage on doit comparer la solution de sel de MOHR à la ...
 - est réduit en MnO2 insoluble de couleur brune qui empêche la
- est réduit en MnO2 insoluble de couleur brune qui empêche la
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR. I- PRÉPARATION de la • Préparer la burette la remplir de la solution de permanganate de potassium.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
(V ) = volume de solution de permanganate de potassium verséàl'équivalence. avancement. 8H+. + 5 Fe2+ + MnO4. -. ? 5 Fe.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié
 TRAVAUX PRATIQUES DE CHIMIE
TRAVAUX PRATIQUES DE CHIMIE
solution oxydante le permanganate de potassium KMnO4. Mesure 2 : Doser 10mL de sel de Mohr par la solution de permanganate en.
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
calcul de la concentration de la solution à doser se fait comme dans le Le sel de Mohr est un sulfate double d'ammonium et de fer II hexahydraté se ...
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de. K2Cr2O7. Les équations bilans en milieu acide
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
1- Principe du dosage. On dose une solution de fer (II) de concentration (C2) par une solution de permanganate de potassium de concentration (C1 = 002 mol.
 Les éléments chimiques liés à la potabilité de leau
Les éléments chimiques liés à la potabilité de leau
Les chlorures sont dosés en milieu neutre par une solution titrée de nitrate Soit n0 le volume de KMnO4 qui a servi au dosage de l'excès de sel de MOHR.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol.L– 1. Entre V = 0 et V1 la réaction de dosage est : MnO4.
 [PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
[PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR OBJECTIFS: ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
[DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
Le titrage de la solution de sel de Mohr (Fe2+) se fait par potentiométrie à intensité nulle à l'aide des ions permanganate (
 [PDF] dosage-de-sel-de-mohrpdf - WordPresscom
[PDF] dosage-de-sel-de-mohrpdf - WordPresscom
Dosage d'oxydoréduction - Suivi potentiométrique Objectif : ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO46H2O)
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
2) Pourquoi acidifier le sel de Mohr ? L'ion permanganate appartient à différents couples selon l'acidité du milieu Pour que ce soit le couple MnO4
 [PDF] Dosage dune solution de sel de Mohr (Fe
[PDF] Dosage dune solution de sel de Mohr (Fe
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de K2Cr2O7 Les équations bilans en milieu acide
 [PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
[PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
Le sel de Mohr a pour formule FeSO4(NH4)2SO4 x H2O Le but du dosage est de déterminer la L'équation de la réaction support du dosage est : MnO4
 tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
TP 13 OBJECTIFS: DOSAGE des IONS FER (II) contenus dans le SEL de MOHR Raliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [PDF] universite paris 12 val de marne
[PDF] universite paris 12 val de marne
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié est un oxydant fort capable d'oxyder en solution aqueuse les ions Fe2+
 [PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
[PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
Préparer une solution contenant une quantité (pesée avec précision) de l'ordre de 07g d'orthophénanthroline (M = 19823) et 14 g de sel de Mohr (M = 39213)
 [PDF] Le but du dosage à réaliser est de déterminer la concentration en
[PDF] Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en ions Fe2+dans une solution de sel de Mohr connaissant la concentration d'une solution de
N° 785
Synthèse et analyse d"un complexe :
l"oxalate de fer II par Jérôme GIRARDUniversité Paul Sabatier - 31000 Toulouse
et Florence MICHAUDTA Académie de Toulouse
La synthèse (fort simple) de ce complexe sera suivie de son analyse par deux méthodes afin de déterminer sa stoechiométrie.La réaction de synthèse peut s"écrire :
Fe 2 + + x C 2 O 4 2 - + y H 2O ® Fe(C
2 O 4 x (H 2 O) y L"analyse permettra de vérifier que x = 1 (électroneutralité respec- tée) et de déterminer y. Enfin nous discuterons de la structure de ce complexe.A - Synthèse du complexe [1]
1 - Réactifs
- Sel de Mohr : Fe SO 4 (NH 4 2 SO 4 ,6H 2O M = 392,13 g.mol
- 1 H 2 SO 4 (2 mol.L - 1 - Acide oxalique : H 2 C 2 O 4 , 2H 2O M = 126,07 g.mol
- 1 - Acétone.2 - Mode opératoire
- Dissoudre de sel de Mohr dans 25 mL d"eau acidifiée par 1 mL d" H 2 SO 42 mol.L
- 1 - Préparer une solution d"acide oxalique : dans 30 mL d"eau. - Ajouter la totalité de cette solution à celle de sel de Mohr et chauffer lentement jusqu"à ébullition. Un précipité jaune apparaît.BULLETIN DE L"UNION DES PHYSICIENS 1125
Vol. 90 - Juin 1996 J. GIRARD...
- Filtrer ce précipité sur Büchner ou verre fritté. Le laver avec 30 mL d"eau chaude (60°C) puis avec 30 mL d"acétone. Laisser l"aspiration se poursuivre cinq minutes. - Recueillir le produit dans une boîte de Pétri préalablement pesée. Sécher à l"étuve (60°C) ou à défaut à l"air libre pendant quelques jours. - Déterminer la masse d"oxalate de fer II sec obtenu.B - Analyse du complexe : dosage des ions
Fe 2 + et C 2 O 4 2 [1]1.PREMIÈRE MÉTHODE : POTENTIOMÉTRIE
1 - Expérience
Dissoudre, dans 20 mL d"
H 2 SO 42 mol.L
- 1 , environ 120 mg de complexe sec (masse m pesée avec précision). Chauffer légèrement pour le dissoudre. Attention : si on chauffe trop, on risque de favoriser l"oxydation de Fe 2 + en Fe 3 + Réaliser le montage potentiométrique suivant : - électrodes : calomel saturée, platine, - réactif titrant dans une burette : solution de permanganate de potassium KMnO 4 (C = 0.0200 mol.L - 1 Au début du dosage, la couleur du permanganate disparaît instanta- nément et le potentiel prend rapidement une valeur stable. Puis après un premier saut de potentiel, (observé pour un volume V 1 ) la décoloration est plus lente et le potentiel, après avoir augmenté, diminue assez rapidement. Dans cette partie, on notera le potentiel maximal obtenu après l"ajout, puis le potentiel trente secondes et une minute après.Après un deuxième saut de potentiel (volume
V 2 ) le potentiel prend, après chaque ajout, une valeur stable et la couleur du permanganate persiste. Poursuivre le titrage 5 mL au-delà de l"équivalence.Tracer la courbe D
E = E platine - E calomel = f (V MnO 4 ) sur une feuille de papier millimétré.1126 BULLETIN DE L"UNION DES PHYSICIENS
Synthèse et analyse d"un complexe... B.U.P. n° 785Déterminer sur la courbe V
1 et V 2 . La méthode des tangentes n"est pas valable ici; nous avons fait une détermination à vue de nez. (Exemple de courbe obtenue en annexe).2 - Interprétation
On donne :
H 2 C 2 O 4 pKa 1 = 1,2 pKa 2 = 4,3 E 0 (Fe 3 + Fe 2 + ) = + 0,77 V E 0 (CO 2 1 2 H 2 C 2 O 4 ) = - 0,49 V E 0 (MnO 4 - Mn 2 + ) = + 1,49 VA la lecture de ces potentiels, MnO
4 - devrait oxyder H 2 C 2 O 4 puis Fe 2 + Or c"est le contraire qui se produit. Il faut tenir compte de la cinétique de ces réactions : le système Fe 3 + Fe 2 + est un système rapide et le système CO 2 1 2 H 2 C 2 O 4 est un système lent. Ainsi MnO 4 - réagit d"abord avec Fe 2 + (entre les volumes V = 0 et V 1 ) puis avec H 2 C 2 O 4 (entre V 1 et V 2 ) avec une évolution lente du potentiel car les ions MnO 4 - ne sont réduits en Mn 2 + que petit à petit.3 - Détermination de la stoechiométrie
Entre V = 0 et
V 1 la réaction de dosage est : MnO 4 + 8 H 3 O + 5 Fe 2 +® Mn
2 + + 12 H 2O + 5 Fe
3 + donc il faut une mole de MnO 4 pour oxyder cinq moles de Fe 2 + n Fe2 + = 5 C V
1 masse de Fe 2 + dans l"échantillon (en g) : m Fe2 + = n
Fe 2 + M Fe2 + = 5 . 55,8 C V
· Entre V
1 et V 2 MnO 4 - + 5 2 H 2 C 2 O 4 + 3 H 3 O® Mn
2 + + 7 H 2O + 5 CO
2BULLETIN DE L"UNION DES PHYSICIENS 1127
Vol. 90 - Juin 1996 J. GIRARD...
donc il faut une mole de MnO 4 - pour oxyder deux moles et demi de H 2 C 2 O 4 n H 2 C 2 O 4 = 52 C (V
2 - V 1 masse de C 2 O 4 2 dans l"échantillon : m C 2 O 42 - = n
H 2 C 2 O 4 M C 2 O 4 2 - = 52 . 88 C (V
2 - V 1 · Par simple différence, on peut en déduire la masse d"eau dans l"échantillon : m H 2 O = m - aeèm Fe2 + + m
C 2 O 4 2 - et le nombre de moles d"eau : n H 2 O = m H 2 O M H 2 O = m H 2 O 18· Calcul de x :x = n
C 2 O 4 2 - n Fe 2 +· Calcul de y :y = n
H 2 O n Fe 2 +2.DEUXIÈME MÉTHODE : VOLUMÉTRIE
1 - Expérience
Dissoudre, dans 20 mL de
H 2 SO 42 mol.L
- 1 , environ 120 mg de complexe sec (masse m pesée avec précision). Chauffer légèrement pour le dissoudre. Attention : si on chauffe trop, on risque de favoriser l"oxydation de Fe 2 + en Fe 3 + Titrer avec une solution de permanganate de potassium KMnO 4 (C = 0,0200 mol.L - 1 ). Quand la couleur du permanganate est lente à disparaître, chauffer la solution à 60°C environ, et continuer la titration jusqu"à la persistance de la couleur du permanganate. On note le volume V 3 Ajouter lentement environ de poudre de zinc puis faire bouillir la solution pendant vingt minutes.1128 BULLETIN DE L"UNION DES PHYSICIENS
Synthèse et analyse d"un complexe... B.U.P. n° 785 · Tester une goutte de solution avec une solution de thiocyanate de potassium KSCN (C @ 1 mol.L
- 1 ). Si une couleur rose persiste, pour- suivre l"ébullition pendant dix minutes puis refaire le test. Refroidir puis filtrer la solution. Laver le bécher avec un peu de H 2 SO 42 mol.L
- 1 . Verser sur le filtre de manière à laver le zinc résiduel. Titrer le filtrat avec la solution de permanganate. On note le volume V 42 - Interprétation
Au début à froid,
MnO 4 - oxyde Fe 2 + en Fe 3 + puis à chaud (pour accélérer la réaction) H 2 C 2 O 4 en CO 2 qui se dégage. (Voir B12 pour la justification). Ainsi on dose l"ensemble Fe 2 + + H 2 C 2 Oquotesdbs_dbs35.pdfusesText_40[PDF] dosage potentiométrique fer cerium
[PDF] dosage potentiométrique des ions chlorure par nitrate d'argent
[PDF] dosage volumétrique mot fleche
[PDF] analyse volumétrique définition
[PDF] causer sa ruine
[PDF] dosage volumétrique acido-basique
[PDF] dosage gravimétrique
[PDF] dosage volumétrique principe
[PDF] doseur poudre industriel
[PDF] dose équivalente
[PDF] dose engagée
[PDF] dose efficace formule
[PDF] dose efficace définition
[PDF] dose efficace radiologie
