 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
ne peuvent plus réduire les ions MnO4- en Mn2+ . On relève la chute de burette dès que la coloration rose persiste. Dans la burette : -
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Pour éviter ce problème on utilisera le sel de Mohr
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
– Ajouter la totalité de cette solution à celle de sel de Mohr et chauffer • Titrer avec une solution de permanganate de potassium KMnO4. (C = 00200 mol.L– 1) ...
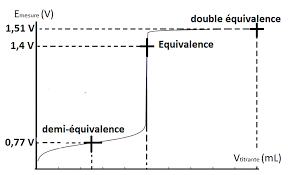 Dosage potentiométrique
Dosage potentiométrique
Etudions l'exemple du dosage des ions fer Fe2+ par les ions permanganate MnO4. - ions ferreux Fe2+ en solution mais le sel de Mohr est moins facilement ...
 Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en
solution de sel de Mohr connaissant la concentration d'une solution de permanganate de potassium acidifiée constituée d'ions permanganate MnO4. -. S Maret.
 Méthodes de titrage en électrochimie
Méthodes de titrage en électrochimie
2 mai 2020 d'une des méthodes présentées dans ce cours. Exemple de TP : titrages potentiométriques du fer (II) dans le sel de Mohr par. KMnO4. Introduction.
 Analyse physique-chimique des eaux destinées à la consommation
Analyse physique-chimique des eaux destinées à la consommation
Oxydation de sel de MOHR par le KMnO4 : L'équation de la réaction de titrage Pour cela avant tout dosage on doit comparer la solution de sel de MOHR à la ...
 - est réduit en MnO2 insoluble de couleur brune qui empêche la
- est réduit en MnO2 insoluble de couleur brune qui empêche la
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR. I- PRÉPARATION de la • Préparer la burette la remplir de la solution de permanganate de potassium.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
(V ) = volume de solution de permanganate de potassium verséàl'équivalence. avancement. 8H+. + 5 Fe2+ + MnO4. -. ? 5 Fe.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié
 TRAVAUX PRATIQUES DE CHIMIE
TRAVAUX PRATIQUES DE CHIMIE
solution oxydante le permanganate de potassium KMnO4. Mesure 2 : Doser 10mL de sel de Mohr par la solution de permanganate en.
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
calcul de la concentration de la solution à doser se fait comme dans le Le sel de Mohr est un sulfate double d'ammonium et de fer II hexahydraté se ...
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de. K2Cr2O7. Les équations bilans en milieu acide
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
1- Principe du dosage. On dose une solution de fer (II) de concentration (C2) par une solution de permanganate de potassium de concentration (C1 = 002 mol.
 Les éléments chimiques liés à la potabilité de leau
Les éléments chimiques liés à la potabilité de leau
Les chlorures sont dosés en milieu neutre par une solution titrée de nitrate Soit n0 le volume de KMnO4 qui a servi au dosage de l'excès de sel de MOHR.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol.L– 1. Entre V = 0 et V1 la réaction de dosage est : MnO4.
 [PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
[PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR OBJECTIFS: ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
[DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
Le titrage de la solution de sel de Mohr (Fe2+) se fait par potentiométrie à intensité nulle à l'aide des ions permanganate (
 [PDF] dosage-de-sel-de-mohrpdf - WordPresscom
[PDF] dosage-de-sel-de-mohrpdf - WordPresscom
Dosage d'oxydoréduction - Suivi potentiométrique Objectif : ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO46H2O)
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
2) Pourquoi acidifier le sel de Mohr ? L'ion permanganate appartient à différents couples selon l'acidité du milieu Pour que ce soit le couple MnO4
 [PDF] Dosage dune solution de sel de Mohr (Fe
[PDF] Dosage dune solution de sel de Mohr (Fe
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de K2Cr2O7 Les équations bilans en milieu acide
 [PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
[PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
Le sel de Mohr a pour formule FeSO4(NH4)2SO4 x H2O Le but du dosage est de déterminer la L'équation de la réaction support du dosage est : MnO4
 tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
TP 13 OBJECTIFS: DOSAGE des IONS FER (II) contenus dans le SEL de MOHR Raliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [PDF] universite paris 12 val de marne
[PDF] universite paris 12 val de marne
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié est un oxydant fort capable d'oxyder en solution aqueuse les ions Fe2+
 [PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
[PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
Préparer une solution contenant une quantité (pesée avec précision) de l'ordre de 07g d'orthophénanthroline (M = 19823) et 14 g de sel de Mohr (M = 39213)
 [PDF] Le but du dosage à réaliser est de déterminer la concentration en
[PDF] Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en ions Fe2+dans une solution de sel de Mohr connaissant la concentration d'une solution de
UNIVERSITE PARIS 12
VAL DE MARNE
Concours externe d'accès au corps des Adjoints Techniques de Recherche et Formation BAP B : Sciences Chimiques et Sciences des MatériauxSpécialité : Préparateur en Chimie
Session 2004
Epreuve professionnelle : Durée 1 heure 30
Coefficient 3
Mercredi 17 novembre
Aucun document n'est autorisé.
L'usage de la calculatrice de poche est autorisé.Ce dossier comprend 4 pages y compris la page de garde. Les résultats de la première partie sont à inscrire
sur la feuille de résultats page 4.Le sujet de cette épreuve se compose au total de 2 parties. La première concerne la préparation d'une
solution étalon et un dosage, la deuxième concerne un montage de distillation.Nom : Prénom :
1 Première partie : préparation d'une solution étalon de Fe 2+ et dosage d'une solution de permanganate de potassium diluée.1. Principe
Le permanganate de potassium KMnO
4 , sel soluble et totalement dissocié, est un oxydant fort capable d'oxyder en solution aqueuse les ions Fe 2+ . La réaction de titrage est une oxydoréduction, lepoint équivalent est mis en évidence par l'apparition d'une couleur violette persistante due à la
présence du permanganate en excès.Les ions Fe
2+ constituent le réducteur. Ils sont facilement oxydables par de dioxygène de l'air. Pour éviter ce problème, on utilisera le sel de Mohr, sel dans lequel les ions Fe 2+ sont stabilisés. C'est un solide cristallisé vert pale, de formule FeSO 4 , (NH 4 2 SO 4 , 6 H 2O, soluble dans l'eau et
totalement dissocié en ses ions, de masse molaire M = 392,14 g.mol -1 La réaction de titrage, réalisée en milieu acide, est la suivante : MnO 4 + 5 Fe 2+ + 8 H Mn 2+ + 5 Fe 3+ + 4 H 2 O La concentration de la solution de permanganate de potassium à doser est de l'ordre de 2.10 -2 mol.L -12. Préparation de 100 ml de solution étalon de sel de Mohr
Pour cela peser exactement une masse d'environ 3 grammes de sel de Mohr. Soit m Fe cette masse.3. Dosage volumétrique
Prélever avec précision un volume V
Fe = 10 ml de la solution étalon préparée de sel de Mohr. Verser ces 10 ml dans un bécher propre. Ajouter 10 ml d'acide sulfurique 2 mol.L -1Remplir la burette graduée avec la solution à titrer, agiter la solution et lancer le dosage jusqu'à
persistance de la coloration violette. Noter le volume V KMnO4 correspondant au point équivalent. Refaire le dosage de façon à obtenir deux volumes concordants.4. Résultats
Reporter sur la feuille jointe les valeurs qui vous sont demandées et donner la concentration exacte
de la solution de permanganate de potassium avec une précision de 0,5 %. 2 Deuxième partie : Montage d'un poste de distillationL'épreuve consiste à réaliser un montage de verrerie utilisable pour purifier un liquide par une
technique de distillation fractionnée sous pression atmosphérique.La température d'ébullition du liquide est au maximum de 150 °C, le volume maximum prévu à
purifier est de 50 ml.Un thermomètre en haut de colonne sera positionné grâce à une tête de colonne avec joint torique
coulissant SVL.Le distillat sera recueilli dans un enlenmeyer.
Le dispositif de chauffage sera constitué d'un agitateur magnétique chauffant posé sur un élévateur
et d'un valet en aluminium pour assurer le contact thermique entre la plaque de l'agitateur et leballon. Un barreau aimanté tournant de forme ovoïde assurera la régulation de l'ébullition.
Vous disposez sur la paillasse et dans un bac de tout le matériel dont vous avez besoin (verrerie,
tuyaux, thermomètres, etc).Chaque pièce de verre sera solidement fixée par des pinces à un statif et maintenue entre elles
lorsque cela se justifie, par des " clips ». 3 4FEUILLE DE RESULTATS
NOM : Prénom :
Préparation de la solution étalon de sel de Mohr Masse de sel de Mohr introduite dans la fiole jaugée : m Fe = ...............grammesVolume de la fiole jaugée : 100 ml
Concentration de la solution étalon de sel de Mohr : C Fe = ...............mol.L -1 Dosage de la solution de permanganate de potassium Volume prélevé de la solution de sel de Mohr : V Fe = 10 ml Premier essai Volume observé au point équivalent V1KMnO4
= ...............ml Deuxième essai Volume observé au point équivalent V2KMnO4
= ...............mlVolume moyen versé au point équivalent :
V KMnO4 = (V1KMnO4
+ V2KMnO4
)/2 = ...............ml Concentration de la solution de permanganate de potassium : C KMnO4 = ............... ..........................mol.L -1quotesdbs_dbs35.pdfusesText_40[PDF] dosage potentiométrique fer cerium
[PDF] dosage potentiométrique des ions chlorure par nitrate d'argent
[PDF] dosage volumétrique mot fleche
[PDF] analyse volumétrique définition
[PDF] causer sa ruine
[PDF] dosage volumétrique acido-basique
[PDF] dosage gravimétrique
[PDF] dosage volumétrique principe
[PDF] doseur poudre industriel
[PDF] dose équivalente
[PDF] dose engagée
[PDF] dose efficace formule
[PDF] dose efficace définition
[PDF] dose efficace radiologie
