 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
ne peuvent plus réduire les ions MnO4- en Mn2+ . On relève la chute de burette dès que la coloration rose persiste. Dans la burette : -
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Pour éviter ce problème on utilisera le sel de Mohr
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
– Ajouter la totalité de cette solution à celle de sel de Mohr et chauffer • Titrer avec une solution de permanganate de potassium KMnO4. (C = 00200 mol.L– 1) ...
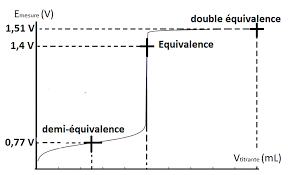 Dosage potentiométrique
Dosage potentiométrique
Etudions l'exemple du dosage des ions fer Fe2+ par les ions permanganate MnO4. - ions ferreux Fe2+ en solution mais le sel de Mohr est moins facilement ...
 Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en
solution de sel de Mohr connaissant la concentration d'une solution de permanganate de potassium acidifiée constituée d'ions permanganate MnO4. -. S Maret.
 Méthodes de titrage en électrochimie
Méthodes de titrage en électrochimie
2 mai 2020 d'une des méthodes présentées dans ce cours. Exemple de TP : titrages potentiométriques du fer (II) dans le sel de Mohr par. KMnO4. Introduction.
 Analyse physique-chimique des eaux destinées à la consommation
Analyse physique-chimique des eaux destinées à la consommation
Oxydation de sel de MOHR par le KMnO4 : L'équation de la réaction de titrage Pour cela avant tout dosage on doit comparer la solution de sel de MOHR à la ...
 - est réduit en MnO2 insoluble de couleur brune qui empêche la
- est réduit en MnO2 insoluble de couleur brune qui empêche la
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR. I- PRÉPARATION de la • Préparer la burette la remplir de la solution de permanganate de potassium.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
(V ) = volume de solution de permanganate de potassium verséàl'équivalence. avancement. 8H+. + 5 Fe2+ + MnO4. -. ? 5 Fe.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié
 TRAVAUX PRATIQUES DE CHIMIE
TRAVAUX PRATIQUES DE CHIMIE
solution oxydante le permanganate de potassium KMnO4. Mesure 2 : Doser 10mL de sel de Mohr par la solution de permanganate en.
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
calcul de la concentration de la solution à doser se fait comme dans le Le sel de Mohr est un sulfate double d'ammonium et de fer II hexahydraté se ...
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de. K2Cr2O7. Les équations bilans en milieu acide
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
1- Principe du dosage. On dose une solution de fer (II) de concentration (C2) par une solution de permanganate de potassium de concentration (C1 = 002 mol.
 Les éléments chimiques liés à la potabilité de leau
Les éléments chimiques liés à la potabilité de leau
Les chlorures sont dosés en milieu neutre par une solution titrée de nitrate Soit n0 le volume de KMnO4 qui a servi au dosage de l'excès de sel de MOHR.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol.L– 1. Entre V = 0 et V1 la réaction de dosage est : MnO4.
 [PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
[PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR OBJECTIFS: ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
[DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
Le titrage de la solution de sel de Mohr (Fe2+) se fait par potentiométrie à intensité nulle à l'aide des ions permanganate (
 [PDF] dosage-de-sel-de-mohrpdf - WordPresscom
[PDF] dosage-de-sel-de-mohrpdf - WordPresscom
Dosage d'oxydoréduction - Suivi potentiométrique Objectif : ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO46H2O)
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
2) Pourquoi acidifier le sel de Mohr ? L'ion permanganate appartient à différents couples selon l'acidité du milieu Pour que ce soit le couple MnO4
 [PDF] Dosage dune solution de sel de Mohr (Fe
[PDF] Dosage dune solution de sel de Mohr (Fe
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de K2Cr2O7 Les équations bilans en milieu acide
 [PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
[PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
Le sel de Mohr a pour formule FeSO4(NH4)2SO4 x H2O Le but du dosage est de déterminer la L'équation de la réaction support du dosage est : MnO4
 tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
TP 13 OBJECTIFS: DOSAGE des IONS FER (II) contenus dans le SEL de MOHR Raliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [PDF] universite paris 12 val de marne
[PDF] universite paris 12 val de marne
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié est un oxydant fort capable d'oxyder en solution aqueuse les ions Fe2+
 [PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
[PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
Préparer une solution contenant une quantité (pesée avec précision) de l'ordre de 07g d'orthophénanthroline (M = 19823) et 14 g de sel de Mohr (M = 39213)
 [PDF] Le but du dosage à réaliser est de déterminer la concentration en
[PDF] Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en ions Fe2+dans une solution de sel de Mohr connaissant la concentration d'une solution de
Étude d'une réactionÉtude d'une réaction : titrage des ions fer II par les ions permanganate: titrage des ions fer II par les ions permanganate
I - Généralités sur les titrages
1) Objectif d'un titrage
Il permet, à l'équivalence, de déterminer la concentration inconnue d'une solution à partir d'une
solution de concentration connue. Pour cela, il faut déterminer le volume équivalent, c'est-à-dire le
volume versé de solution titrante (en général mais parfois, c'est l'inverse) pour lequel les réactifs sont
dans les conditions stoechiométriques. La connaissance de ce volume permet de déterminer la valeur
de xéq.2) Comment repérer l'équivalence ?
Il existe deux types de titrages étudiés cette année : - colorimétrique ; - conductimétrique.Dans un titrage colorimétrique, l'équivalence est repérée par un changement de coloration au sein du
mélange réactionnel (virage coloré). Le volume versé de solution titrante au moment du changement
de coloration, lue sur la burette, correspond au volume équivalent.Dans un titrage conductimétrique, la valeur de la conductance est relevée pour chaque mL du réactif
titrant versé, vous notez qu'elle diminue puis augmente. La courbe G = f(V) est tracée et l'équivalence
se situe à la cassure de la courbe et il est possible de déterminer le volume équivalent graphiquement.
3) Matériel utilisé
- une burette graduée contenant le réactif titrant ; - un agitateur magnétique (boîtier et aimant) - un bécher de garde ;- un bécher contenant la solution à titrer (prélevée par une pipette jaugée dans un bécher) ;
Il faut également une pissette d'eau distillée pour rincer le bécher entre les deux dosages.
Exemple :
Solution de permanganate de potassium
K+(aq) + MnO4-(aq)
Concentration [MnO4-]
Volume équivalent Véq à déterminer ?
Solution acidifiée de sel de Mohr
Concentration inconnue [Fe2+] ?
Volume V
II - Étude de la réaction chimique
1) Pourquoi un virage coloré à l'équivalence ?
Les ions permanganate MnO4-, violet, et les ions fer II Fe2+ réagissent ensemble pour donner des ions
manganèse Mn2+, incolores, et des ions fer III Fe3+, jaune pâle presque incolores.Tant qu'il reste des ions fer II dans le mélange réactionnel, les ions permanganate versés deviennent
des ions manganèse incolores et le mélange réactionnel reste incolore.Au moment où tous les ions fer II ont réagi, la première goutte versée contenant des ions
permanganate ne se décolore plus - les ions permanganate ne réagissent plus - et donne une teinte
rose au mélange réactionnel, c'est l'équivalence.2) Pourquoi acidifier le sel de Mohr ?
L'ion permanganate appartient à différents couples selon l'acidité du milieu. Pour que ce soit le couple
MnO4-(aq) / Mn2+(aq) qui interviennent, le mélange réactionnel doit être acide d'où l'ajout d'acide dans
la solution à titrer.3) Couples en présence et demi-équations de couple
MnO4-(aq) / Mn2+(aq)MnO4-(aq) + 8 H+ + 5 e - = Mn2+(aq) + 4 H2O(l) Fe3+(aq) / Fe2+(aq) Fe3+(aq) + e- = Fe2+(aq)4) Demi-équations de réaction et équation de réaction
MnO4-(aq) + 8 H+ + 5 e- → Mn2+(aq) + 4 H2O(l) ( Fe2+(aq) → Fe3+(aq) + e- )x 5 MnO4-(aq) + 8 H+ + 5 Fe2+(aq) → 5 Fe3+(aq) + Mn2+(aq) + 4 H2O(l)5) Bilan des grandeurs et quantités de matière accessibles
De quelles grandeurs disposons-nous ?
- de la concentration en ions MnO4- [MnO4-] ; - du volume de la solution contenant les ions fer II dans le bécher V ; - et du volume versé Véq, à l'équivalence, de la solution contenant les ions MnO4-. Nous recherchons la concentration en ions fer II [Fe2+]. Quantité de matière initiale d'ions fer II dans le bécher ni(Fe2+) = [Fe2+] x V Quantité de matière d'ions permanganate versée à l'équivalence nv(MnO4-) = [MnO4-] x Véq6) Relation entre les quantités de matière à l'équivalence
Les ions fer II ont réagi avec la totalité des ions permanganate versés. Leurs quantités à l'équivalence
sont nulles, xéq représente l'avancement à l'équivalence lorsque les conditions sont stoechiométriques.
néq(Fe2+) = ni(Fe2+) - 5 xéq= 0xéq = ni(Fe2+) / 5 néq(MnO4-) = nv(MnO4-) - xéq= 0xéq = nv(MnO4-) Vous en déduisez la relation suivante : xéq = ni(Fe2+) / 5 = nv(MnO4-) qui peut s'écrire encore : [Fe2+] x V / 5 = [MnO4-] x VéqIl reste à exprimer la concentration en ion fer II: [Fe2+] = 5 [MnO4-] x Véq / V
Toutes les grandeurs sont connues (concentration en ions permanganate, volume équivalent, volume de la solution contenant les ions fer II), la concentration en ions fer II est donc déterminable.quotesdbs_dbs6.pdfusesText_12[PDF] dosage potentiométrique fer cerium
[PDF] dosage potentiométrique des ions chlorure par nitrate d'argent
[PDF] dosage volumétrique mot fleche
[PDF] analyse volumétrique définition
[PDF] causer sa ruine
[PDF] dosage volumétrique acido-basique
[PDF] dosage gravimétrique
[PDF] dosage volumétrique principe
[PDF] doseur poudre industriel
[PDF] dose équivalente
[PDF] dose engagée
[PDF] dose efficace formule
[PDF] dose efficace définition
[PDF] dose efficace radiologie
