 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
ne peuvent plus réduire les ions MnO4- en Mn2+ . On relève la chute de burette dès que la coloration rose persiste. Dans la burette : -
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Pour éviter ce problème on utilisera le sel de Mohr
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
– Ajouter la totalité de cette solution à celle de sel de Mohr et chauffer • Titrer avec une solution de permanganate de potassium KMnO4. (C = 00200 mol.L– 1) ...
 Dosage potentiométrique
Dosage potentiométrique
Etudions l'exemple du dosage des ions fer Fe2+ par les ions permanganate MnO4. - ions ferreux Fe2+ en solution mais le sel de Mohr est moins facilement ...
 Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en
solution de sel de Mohr connaissant la concentration d'une solution de permanganate de potassium acidifiée constituée d'ions permanganate MnO4. -. S Maret.
 Méthodes de titrage en électrochimie
Méthodes de titrage en électrochimie
2 mai 2020 d'une des méthodes présentées dans ce cours. Exemple de TP : titrages potentiométriques du fer (II) dans le sel de Mohr par. KMnO4. Introduction.
 Analyse physique-chimique des eaux destinées à la consommation
Analyse physique-chimique des eaux destinées à la consommation
Oxydation de sel de MOHR par le KMnO4 : L'équation de la réaction de titrage Pour cela avant tout dosage on doit comparer la solution de sel de MOHR à la ...
 - est réduit en MnO2 insoluble de couleur brune qui empêche la
- est réduit en MnO2 insoluble de couleur brune qui empêche la
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR. I- PRÉPARATION de la • Préparer la burette la remplir de la solution de permanganate de potassium.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
(V ) = volume de solution de permanganate de potassium verséàl'équivalence. avancement. 8H+. + 5 Fe2+ + MnO4. -. ? 5 Fe.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié
 TRAVAUX PRATIQUES DE CHIMIE
TRAVAUX PRATIQUES DE CHIMIE
solution oxydante le permanganate de potassium KMnO4. Mesure 2 : Doser 10mL de sel de Mohr par la solution de permanganate en.
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
calcul de la concentration de la solution à doser se fait comme dans le Le sel de Mohr est un sulfate double d'ammonium et de fer II hexahydraté se ...
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de. K2Cr2O7. Les équations bilans en milieu acide
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
1- Principe du dosage. On dose une solution de fer (II) de concentration (C2) par une solution de permanganate de potassium de concentration (C1 = 002 mol.
 Les éléments chimiques liés à la potabilité de leau
Les éléments chimiques liés à la potabilité de leau
Les chlorures sont dosés en milieu neutre par une solution titrée de nitrate Soit n0 le volume de KMnO4 qui a servi au dosage de l'excès de sel de MOHR.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol.L– 1. Entre V = 0 et V1 la réaction de dosage est : MnO4.
 [PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
[PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR OBJECTIFS: ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
[DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
Le titrage de la solution de sel de Mohr (Fe2+) se fait par potentiométrie à intensité nulle à l'aide des ions permanganate (
 [PDF] dosage-de-sel-de-mohrpdf - WordPresscom
[PDF] dosage-de-sel-de-mohrpdf - WordPresscom
Dosage d'oxydoréduction - Suivi potentiométrique Objectif : ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO46H2O)
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
2) Pourquoi acidifier le sel de Mohr ? L'ion permanganate appartient à différents couples selon l'acidité du milieu Pour que ce soit le couple MnO4
 [PDF] Dosage dune solution de sel de Mohr (Fe
[PDF] Dosage dune solution de sel de Mohr (Fe
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de K2Cr2O7 Les équations bilans en milieu acide
 [PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
[PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
Le sel de Mohr a pour formule FeSO4(NH4)2SO4 x H2O Le but du dosage est de déterminer la L'équation de la réaction support du dosage est : MnO4
 tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
TP 13 OBJECTIFS: DOSAGE des IONS FER (II) contenus dans le SEL de MOHR Raliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [PDF] universite paris 12 val de marne
[PDF] universite paris 12 val de marne
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié est un oxydant fort capable d'oxyder en solution aqueuse les ions Fe2+
 [PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
[PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
Préparer une solution contenant une quantité (pesée avec précision) de l'ordre de 07g d'orthophénanthroline (M = 19823) et 14 g de sel de Mohr (M = 39213)
 [PDF] Le but du dosage à réaliser est de déterminer la concentration en
[PDF] Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en ions Fe2+dans une solution de sel de Mohr connaissant la concentration d'une solution de

TP-Chimie de solution 2017-2018
TP N.04
Dosage d'oxydoreduction - Suivi potentiometrique
Objectif :
IRealiser par dissolution dusel de Mohr(solide ionique de formuleFeSO4;(NH4)2SO4;6H2O), une solution aqueuse de concentration connueen ion fer (II) IVerier la concentration de la solution obtenue en dosant les ionsFe2+ (aq)par oxydoreduction.ISavoir mesurer le potentiel d'une solution
1 Comment reperer l'equivalence :
Materiel utilise :
u nebu rettegr adueecon tenantl er eactift itrant; u nagi tateurmagn etique( bo^tieret ai mant) u nb ^echerd egar de; u nb ^echerc ontenantl asol ution at itrer( preleveepar u nepi pettej augeed ansu nb ^echer);Il faut egalement une pissette d'eau distillee pour rincer le becher entre les deux dosages.2 Preparation de la solution aqueuse :
On souhaite preparer de facon precise 100,0 mL d'une solution aqueuseS1de concentrationC1=1;50:101mol:L1en sel de Mohr.
D eterminerl amas sem de sel d eM ohr ad issoudre?Donnees :Masse molaireFeSONH
en [g:mol1]55,832,116,014,01,0 Ecrire l'equation de dissolution du sel de Mohr; preciser les especes presentes dans la solution? D ecrirel es etapesde la p reparationpu isl ar ealiser? Etude de la reaction chimique :(Dosage des ions de Fer(II) dans la solution)On realise le dosage des ionsFe2+
(aq)deS1par une solution acidiee de permanganate de potassium(K+ (aq)+ MnO4(aq)) de concentrationC2= 2;00:102mol:L1.MPSI 1 http ://prepanouar.sup.fr
TP-Chimie de solution 2017-2018
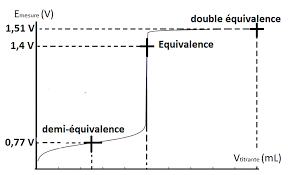
P ourquoid oit-onac idierla s olutionde p ermanganated ep otassium? D eterminerl escou plesen p resenceet l esde mi-equationsde cou ple, ainsil ar eactionbi lan? l 'equivalencees td etecteep aru nc hangementde t eintequ id oit^ etren etet f acilementd etectable. Expliquer comment va varier la couleur de la solution a doser? D eterminerl ac onstantede l ar eaction,sac hantq ueEMnO4=Mn2+= 1;51VetEFe3+=Fe2+=
0;77V.Conclure.
D eterminerl acon centrationd el asol utiond eF er(II)?Sachant que le tableau d'avancement de la reaction de dosage s'ecrit :6.D eterminerle v olumeV2pour calculer le potentiel standard du coupleFe3+=Fe2+:EFe3+=Fe2+
Cal culerl ep otentiels tandardd ucou pleMnO4=Mn2+:EMnO4=Mn2+
4 Protocole experimental :
4.1 Protocole :
IPreparer avec soinV1= 10;0mLde la solution de sel de Mohr dans l'erlenmeyer puis ajouter environ 25 mL d'eau et 25 mL de la solution deH2SO4depH'0. IPreparer la burette, la remplir de la solution de permanganate de potassium. IPlacer une feuille blanche sous l'erlenmeyer, preparer l'agitateur magnetique. IEectuer un premier dosage pour determiner l'ordre de grandeur (au mL pres) du volume (V2)eq. IEectuer un second dosage pour determiner le volume (V2)eqa la goutte pres. IAppeler le professeur pour qu'il verie au second dosage la lecture de (V2)eq.4.2 Dosage colorimetrique :
Determiner rapidement le volume equivalent de permanganate.4.3 Dosage potentiometrique :
IRaccorder l'electrode potentiometrique combinee au millivoltmetre et la plonger dans la solution. Ne pas oublier de rincer l'electrode avant et apres le dosage.Imaintenir une agitation reguliere.
INoter les valeurs de la d.d.p. U en versant la solution de permanganate (ralentir a l'approche de l'equivalence);U[mV]V[mL]012345
MPSI 2 http ://prepanouar.sup.fr
TP-Chimie de solution 2017-2018
Remarque :
U=EPtErefou U est la f.e.m de la pile constituee de l'electrode de platine indiquant le potentiel de la solutionEPt, qui depend des concentrations des dierentes especes redox presentes (note E dans le TP); et de l'electrode de reference au calomel de potentiel constant ref= 0;244Va 25°C. Par consequent, pour obtenir le potentiel de la solution E, il faut ajouter a la f.e.mEPtle potentiel de referenceErefsoit :EPt=E=U+Eref. IJeter la solution du b^echer des la n du dosage. Pourquoi? ITracer avecLatis-prosla courbeE(V2) :V2volume de permanganate de potassium verse.IPlacer le volume equivalent. Imprimer la courbe.
5 Exploitation des resultats :
D eterminerl acon centrationC1de la solution de sel de Mohr. Comp arer al av aleurt heorique( c alculerl 'ecartr elatif) et con clure D eterminerl escon centrationse ectivesd esdi erentese specesc himiquespr esentesd ansl em ilieu reactionnel a l'equivalence. M esurerl ep otentield uc oupleFe3+=Fe2+en expliquant la methode. Attention, on ne trouve pas 0,77 V car les deux ions ont ete complexes par le sulfate. Me surerl ep otentield ucou pleMnO4=Mn2+en expliquant la methode.MPSI 3 http ://prepanouar.sup.frquotesdbs_dbs2.pdfusesText_4[PDF] dosage potentiométrique fer cerium
[PDF] dosage potentiométrique des ions chlorure par nitrate d'argent
[PDF] dosage volumétrique mot fleche
[PDF] analyse volumétrique définition
[PDF] causer sa ruine
[PDF] dosage volumétrique acido-basique
[PDF] dosage gravimétrique
[PDF] dosage volumétrique principe
[PDF] doseur poudre industriel
[PDF] dose équivalente
[PDF] dose engagée
[PDF] dose efficace formule
[PDF] dose efficace définition
[PDF] dose efficace radiologie
