 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
ne peuvent plus réduire les ions MnO4- en Mn2+ . On relève la chute de burette dès que la coloration rose persiste. Dans la burette : -
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Pour éviter ce problème on utilisera le sel de Mohr
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
– Ajouter la totalité de cette solution à celle de sel de Mohr et chauffer • Titrer avec une solution de permanganate de potassium KMnO4. (C = 00200 mol.L– 1) ...
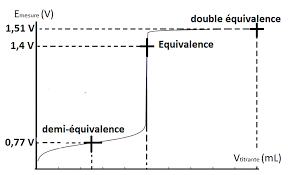 Dosage potentiométrique
Dosage potentiométrique
Etudions l'exemple du dosage des ions fer Fe2+ par les ions permanganate MnO4. - ions ferreux Fe2+ en solution mais le sel de Mohr est moins facilement ...
 Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en
solution de sel de Mohr connaissant la concentration d'une solution de permanganate de potassium acidifiée constituée d'ions permanganate MnO4. -. S Maret.
 Méthodes de titrage en électrochimie
Méthodes de titrage en électrochimie
2 mai 2020 d'une des méthodes présentées dans ce cours. Exemple de TP : titrages potentiométriques du fer (II) dans le sel de Mohr par. KMnO4. Introduction.
 Analyse physique-chimique des eaux destinées à la consommation
Analyse physique-chimique des eaux destinées à la consommation
Oxydation de sel de MOHR par le KMnO4 : L'équation de la réaction de titrage Pour cela avant tout dosage on doit comparer la solution de sel de MOHR à la ...
 - est réduit en MnO2 insoluble de couleur brune qui empêche la
- est réduit en MnO2 insoluble de couleur brune qui empêche la
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR. I- PRÉPARATION de la • Préparer la burette la remplir de la solution de permanganate de potassium.
 TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
(V ) = volume de solution de permanganate de potassium verséàl'équivalence. avancement. 8H+. + 5 Fe2+ + MnO4. -. ? 5 Fe.
 Étude dune réaction : titrage des ions fer II par les ions permanganate
Étude dune réaction : titrage des ions fer II par les ions permanganate
Solution de permanganate de potassium. K+(aq) + MnO4. -(aq). Concentration [MnO4. -]. Volume équivalent Véq à déterminer ? Solution acidifiée de sel de Mohr.
 UNIVERSITE PARIS 12
UNIVERSITE PARIS 12
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié
 TRAVAUX PRATIQUES DE CHIMIE
TRAVAUX PRATIQUES DE CHIMIE
solution oxydante le permanganate de potassium KMnO4. Mesure 2 : Doser 10mL de sel de Mohr par la solution de permanganate en.
 E 1 FICHE GENERALE
E 1 FICHE GENERALE
calcul de la concentration de la solution à doser se fait comme dans le Le sel de Mohr est un sulfate double d'ammonium et de fer II hexahydraté se ...
 Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
Dosage dune solution de sel de Mohr (Fe ) 1. Principe 1
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de. K2Cr2O7. Les équations bilans en milieu acide
 TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
TP N.04 Dosage doxydoréduction - Suivi potentiométrique 1
On souhaite préparer de façon précise 1000 mL d'une solution aqueuse S1 de concentration C1 = 1
 DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
DOSAGE DU FER (II) DANS LE SEL DE MOHR PAR LE
1- Principe du dosage. On dose une solution de fer (II) de concentration (C2) par une solution de permanganate de potassium de concentration (C1 = 002 mol.
 Les éléments chimiques liés à la potabilité de leau
Les éléments chimiques liés à la potabilité de leau
Les chlorures sont dosés en milieu neutre par une solution titrée de nitrate Soit n0 le volume de KMnO4 qui a servi au dosage de l'excès de sel de MOHR.
 Synthèse et analyse dun complexe : loxalate de fer II
Synthèse et analyse dun complexe : loxalate de fer II
Dissoudre 8 g de sel de Mohr dans 25 mL d'eau acidifiée par 1 mL d'H2SO4 2 mol.L– 1. Entre V = 0 et V1 la réaction de dosage est : MnO4.
 [PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
[PDF] TP 13 DOSAGE des IONS FER (II) contenus dans le SEL de MOHR
DOSAGE des IONS FER (II) contenus dans le SEL de MOHR OBJECTIFS: ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
[DOC] TP n°3 : Titrage dune solution de sel de Mohr par du permanganate
Le titrage de la solution de sel de Mohr (Fe2+) se fait par potentiométrie à intensité nulle à l'aide des ions permanganate (
 [PDF] dosage-de-sel-de-mohrpdf - WordPresscom
[PDF] dosage-de-sel-de-mohrpdf - WordPresscom
Dosage d'oxydoréduction - Suivi potentiométrique Objectif : ? Réaliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO46H2O)
 [PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
[PDF] Étude dune réaction : titrage des ions fer II par les ions permanganate
2) Pourquoi acidifier le sel de Mohr ? L'ion permanganate appartient à différents couples selon l'acidité du milieu Pour que ce soit le couple MnO4
 [PDF] Dosage dune solution de sel de Mohr (Fe
[PDF] Dosage dune solution de sel de Mohr (Fe
On veut doser succesivemnt une solution sel de Mohr (Fe2+) par une solution de KMnO4 et par une solution de K2Cr2O7 Les équations bilans en milieu acide
 [PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
[PDF] Détermination de la formule du sel de Mohr - AC Nancy Metz
Le sel de Mohr a pour formule FeSO4(NH4)2SO4 x H2O Le but du dosage est de déterminer la L'équation de la réaction support du dosage est : MnO4
 tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
tp13 Dosage Sel de Mohr Corrige 2010-2011 PDF Fer - Scribd
TP 13 OBJECTIFS: DOSAGE des IONS FER (II) contenus dans le SEL de MOHR Raliser par dissolution du sel de Mohr (solide ionique de formule FeSO4(NH4)2SO4
 [PDF] universite paris 12 val de marne
[PDF] universite paris 12 val de marne
Le permanganate de potassium KMnO4 sel soluble et totalement dissocié est un oxydant fort capable d'oxyder en solution aqueuse les ions Fe2+
 [PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
[PDF] 53 COURBE DE DOSAGE POTENTIOMETRIQUE DE Fe** PAR MNO
Préparer une solution contenant une quantité (pesée avec précision) de l'ordre de 07g d'orthophénanthroline (M = 19823) et 14 g de sel de Mohr (M = 39213)
 [PDF] Le but du dosage à réaliser est de déterminer la concentration en
[PDF] Le but du dosage à réaliser est de déterminer la concentration en
Le but du dosage à réaliser est de déterminer la concentration en ions Fe2+dans une solution de sel de Mohr connaissant la concentration d'une solution de
Préparé par Dr. A.Hadji
[Cl-] = n . 35.5 mg Cl-/L [Cl-] = n . 58.5 mg NaCl/L [Cl-] = n mEq/LIntroduction
Une eau de bonne qualité est
facile deI. Les Chlorures
- Dissolution des dépôts de selInfiltration des eaux usées vannes.
Rejets industriels, exemple
Entretien des routes par le sel gemme.
2Méthode de MOHR
Principe
présence de chromate de potassium. La fin de la réa teinte rouge caractéristiqueMode Opératoire
o o o Une pincée de carbonate de chaux o II teinte rougeâtre, qui doit persister 1 à 3 minutes.Résultats
Principe
excèsMode Opératoire
o o 3. o e nitrique concentré. o persistante, en agitant après chaque addition de réactif.Résultat
[Cl-] = (10-/L -] = (10 -] = (10 La concentration maximale admissible est fixée à 500 mg de Cl-/ - DécompositionRejets industriels et domestiques.
2Principe
alcalin réduction p végétale contenues dans une eau. alcalinet 4 de MOHR non Oxydé est titré en double retour par une solution de KMnO4Mode Opératoire
20 ml de KMnO4
5 ml de H2SO4
Ajouter 20 ml de sel de MOHR à N/80, la solution se décolore. la coloration rose. 0 4 2 ml de solution saturée de NaHCO3.
20 ml de KMnO4
Acidifier par 5 ml de H2SO4 diluée au demi. Ajouter 20 ml de sel de MOHR à N/80, se décolore. on rose pale. 41-0) correspond au volume réel de KMnO4
Résultat
IP = (n1-0
1-0)/16 meq / L
IILessivage des terrains gypseux et pyriteux.
Origine agricole.
Origine atmosphérique.
2Méthode
Principe
Expression des résultats
Pour une prise
M .10 . 0,41donne la teneur en sulfates exprimée en mg de SO4 .B Méthode néphélométrique
Principe
Expression des résultats
4 3IV Les dérivés du
Origine
- Rejets industriels (industrie agroalimentaire) - Rejets domestiques (adjuvants actifs ajoutés aux détergents) - Origine agricole (engrais phosphatés et pesticides)2 Dérivés phosphorés
Phosphates inorganiques
- Les orthophosphatessont les sels 3PO4. Le radical 4 Les orthophosphates acides, comme Na2HPO4 2PO4, sont soluble. Par contre, les 4)23(PO4)2.
Les polyphosphates-
ou linéaires.Phosphates organiques
Le phosphore intervient dans
3 Dosage
Principe
complexe mère2PO4 2O5.Expression des résultats
2O5 3Principe
Les polyphosphates tel que le pyro
3Principe
le dosage des ortho phosphates. 32SO4 refroidir et on
4 Norme
La concentration maximale
V¾ Diverses formes
Formule chimique Exemples
Azote organique N -III
Azote ammoniacal NH3/NH4+ -III NH4Cl
Azote moléculaire N2 0
Azote des nitrites NO2- +III NaNO2
Azote des nitrates NO3- +V KNO3
IV9 Eaux de surface
9 Eaux profondes
2Principe
(iodomercurate de coloration-Réactions mise
HgI2 ļ 4)2 +
2 (HgI4)2 3 ļ 3HgI2 -
2NH3HgI2ļ 2Hg2I3+ NH4I-
Expression des résultats :
La teneur en ammoniaque exprimée en mg de NH4
IVOrigine
Oxydation partielle
Nitrosomonas.
2 Dosage
Principe
ammonium et de phénol est proportionnel à la concentration en nitrites roportionnel à la concentration des nitritesExpression des résultats
2 2Principe
se forme un sel de diazonium qui est ensuite couplé avec une amine (réaction avec le Į- Ex IVOrigine
- Rejets des collectivités. - Eau2 Dosage (méthode de grandval et lajoux)
Principe
Les nitrates sont dosés par colorimétrie, après réaction avec le réactif sulfophénolique de
solution étalon.Expression des résultats
¾ Normes
Ammoniaque CMA = 0,5 mg de NH4+/L
Nitrites 0,2 mg de NO2-/L
Nitrates 50mg de NO3-/L
quotesdbs_dbs35.pdfusesText_40[PDF] dosage potentiométrique fer cerium
[PDF] dosage potentiométrique des ions chlorure par nitrate d'argent
[PDF] dosage volumétrique mot fleche
[PDF] analyse volumétrique définition
[PDF] causer sa ruine
[PDF] dosage volumétrique acido-basique
[PDF] dosage gravimétrique
[PDF] dosage volumétrique principe
[PDF] doseur poudre industriel
[PDF] dose équivalente
[PDF] dose engagée
[PDF] dose efficace formule
[PDF] dose efficace définition
[PDF] dose efficace radiologie
