 Biochimie en 24 fiches
Biochimie en 24 fiches
I L'ordre de priorité des principales fonctions chimiques. FICHE 1. Fonction Prendre 110 Da comme masse molaire moyenne d'un acide aminé. Solution. 1. La ...
 BIOCHIMIE
BIOCHIMIE
L'ordre de priorité des principales fonctions chimiques. Fonction. Nom. Préfixe. Suffixe. R––CO––OH. Acide carboxylique. Carboxy. Acide… – oïque. R––CO––OR'.
 Schéma national du maintien de lordre
Schéma national du maintien de lordre
ordre et des moyens techniques spécialisés. Afin de garantir durablement l ... de produits chimiques inflammables ou explosifs interdiction de stationnement
 Conduite à tenir en médecine de premier recours devant un enfant
Conduite à tenir en médecine de premier recours devant un enfant
• Utilisation de moyens mnémotechniques ;. • Choisir des activités d'apprentissage Appels (numéroter par ordre de priorité) : ❑ Parents ou tuteur Tél ...
 Pré-rentrée PASS 2021/2022 Louise GILLET & Adrien RAULT
Pré-rentrée PASS 2021/2022 Louise GILLET & Adrien RAULT
Moyen mnémotechnique : Flore Oblige Claude à de NomBreuses Idioties Les autres fonctions avec comme ordre de priorité : R < X < N < S. < O c. les ...
 SDIS 03
SDIS 03
22 mai 2019 ... ordre initial et les ordres de conduite suivants. Ils sont formalisés grâce au moyen mnémotechnique suivant : Signification. Ordre initial.
 GDO Exercice du commandement
GDO Exercice du commandement
ordre initial et les ordres de conduite suivants. Ils sont formalisés grâce au moyen mnémotechnique suivant : Signification. Ordre initial / de conduite. S ...
 Présentation PowerPoint
Présentation PowerPoint
conscience de l'enfant en fonction de l'âge du développement. L'utilisation de l'acronyme AVPU est un moyen mnémotechnique pour déterminer le niveau de
 LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
On appelle groupement fonctionnel ou fonction chimique l'atome ou le groupe d'atomes Le classement des groupements fonctionnels par ordre de priorité ...
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
n : nombre quantique principale n>0 il détermine la distance moyenne entre Tableau 2 : Nomenclature des fonctions classées par ordre de priorité.
 BIOCHIMIE
BIOCHIMIE
1. L'ordre de priorité des principales fonctions chimiques. Fonction Un moyen mnémotechnique pour les retenir : Le Très Lyrique Tristan.
 Biochimie en 24 fiches
Biochimie en 24 fiches
I L'ordre de priorité des principales fonctions chimiques. FICHE 1. Fonction Un moyen mnémotechnique pour les retenir : Le Très Lyrique Tristan.
 polycopie C
polycopie C
(Autre moyen mnémotechnique : en regardant la molécule selon l'axe de la chaîne qui donne son nom à la molécule est choisi selon un ordre de priorité :.
 Urgences
Urgences
Trier les urgences en fonction de la gravité produits chimiques. ... de 5 ans de l'ordre de 1 à 15 % (moyenne de 10 %) liée probablement à la souplesse ...
 Nomenclature des carbo- et hétérocycles
Nomenclature des carbo- et hétérocycles
priorité des radicaux ? fonction de la taille (nombre de C de chaque radical) Si 2 séquences ? même total ? ordre alphabétique des substituants ...
 SDIS 03
SDIS 03
22?/05?/2019 d'appréciation intégré à la fonction de commandement et inhérent à la ... Ils sont formalisés grâce au moyen mnémotechnique suivant :.
 Pr. Séraphin
Pr. Séraphin
Moyen mnémotechnique : Il faut donc déterminer l'ordre de priorité des différents substituants. La fonction des propriétés chimiques identiques.
 LES GLUCIDES
LES GLUCIDES
Les oses qui possèdent une fonction aldéhyde sont appelés des aldoses et ceux numérotés selon un ordre de priorité (du numéro atomique le plus élevé :.
 Ordre de priorité des fonctions chimiques - JeRetiens
Ordre de priorité des fonctions chimiques - JeRetiens
26 jui 2016 · L'ordre de priorité des fonctions est une convention définie par l'IUPAC Malheureusement la seule façon de ne pas se tromper est
 [PDF] Pr Séraphin - 2ATP
[PDF] Pr Séraphin - 2ATP
Moyen mnémotechnique : Il faut donc déterminer l'ordre de priorité des différents substituants La préséance va à l'atome avec le plus fort numéro atomique
 [PDF] Chimie Organique - univ-ustodz
[PDF] Chimie Organique - univ-ustodz
Fonction chimique ou groupement fonctionnel I 3 Le classement des groupements fonctionnels par ordre de priorité décroissante
 Moyen mnémotechnique - Innovations Pédagogiques
Moyen mnémotechnique - Innovations Pédagogiques
En chimie organique en nomenclature pour l'ordre de priorité des fonctions c'est "L' acide et (ether) l'amidon (amide) neutralisent
 Nomenclature (chimie)/Fonctions - Wikiversité
Nomenclature (chimie)/Fonctions - Wikiversité
20 mai 2021 · Tous les composés organiques pour pouvoir être identifiés rapidement sont nommés suivant la fonction à laquelle ils appartiennent
 [PDF] Chapitre 2 - Chimie organique
[PDF] Chapitre 2 - Chimie organique
(Autre moyen mnémotechnique : en regardant la molécule selon l'axe de la chaîne qui donne son nom à la molécule est choisi selon un ordre de priorité :
 [PDF] Chapitre 3: Nomenclature en chimie organique
[PDF] Chapitre 3: Nomenclature en chimie organique
De groupes fonctionnels caractéristiques des fonctions chimiques (alcool acide dans ce tableau sont rangés dans l'ordre décroissant de priorité
 [PDF] Rappels de chimie théorique
[PDF] Rappels de chimie théorique
moyenne de l'électron au noyau ; celle-ci augmente avec n On parle alors de fonctions diffuses (par opposition aux fonctions contractées)
 [PDF] Un moyen mnémotechnique simple pour vérifier les notations
[PDF] Un moyen mnémotechnique simple pour vérifier les notations
– Le dividende (a) est le nombre total d'électrons de valence de tous les atomes A et X du système chimique étudié – Le diviseur (b) est égal à 8 – Le
Comment retenir les fonctions chimiques ?
Phrase mnémotechnique pour retrouver l' ordre de priorité : Ah si Carbo (acide carboxylique) était(ester) amie(amide) notre(nitrile) alors(aldéhyde) ces(cétone) alcools(alcool) tiendraient(thiol) nos amis(amine).20 mai 2021Comment savoir si une fonction est prioritaire ?
- La fonction prioritaire est désignée par un suffixe et on numérote la chaîne principale de façon à attribuer à cette fonction l'indice le plus petit possible. - Les autres fonctions sont désignées par des préfixes.Comment nommer les fonctions chimiques ?
La nomenclature suit les mêmes règles. Les fonctions sont caractérisées par un suf- fixe (éventuellement précédé d'un numéro de position). Les hydrocarbures possédant une (ou plus) double liaison C = C appartiennent aux alcènes ; ceux possédant une triple liaison C ? C appartiennent aux alcynes.- Les fonctions chimiques sont classées selon leur valence. Une fonction est dite principale lorsqu'elle a la valence la plus élevée.
Chapitre 2
Chimie organique
2.1 Molécules organiques
2.1.1 Représentation des molécules
Il existe plusieurs manières de représenter une molécule. Prenons l"exemple d"une mo- lécule organique, l"acide acétique (ou acide éthanoïque) : C2H4O2CH3COOHH
3CCO OHformule brute formule structurale formule semi-développée HCH HCO OHCH H HCO OHO OH formule développée formule développée formule topologique (repésentation de Cram) Seules les formules semi-développée, développée, et topologique montrent les liaisons covalentes. La formule topologique omet les atomes de carbone et les atomes d"hydrogène liés aux atomes de carbone. La représentation de Cram (montrant aussi Remarque :ce sont les appellations françaises. Les appellations anglo-saxonnes montrent des différences, notamment : form ulebrute : general form ulaou molecular form ula; form uledév eloppée: structural form ula; form uletop ologique: sk eletalfor mula; form ulestructurale : condensed form ula; aussi très pro chede la form ulestructurale : la form ule"SMILES" (Simplified Mo- lecular Input Line Entry Specification). 1516CHAPITRE 2. CHIMIE ORGANIQUE
Deuxième exemple, un peu plus com-
plexe : la caféine. C8H10N4O2
general formula CN1C --NC2--C1C(--O)N(C(--O)N2C)CSMILESNO
N ONN skeletal formula2.1.2 Isomérie
Des composés ayant la même formule brute mais des structures différentes sont appe- léesisomères. On distingue plusieurs type de stéréoisomérie :la s étéréoisomériede conformation : un conformère est obten uà partir de l"autre par
rotation d"une partie de la molécule autour d"une liaison simple. Ceci ne nécessite pas de réaction chimique mais un apport d"énergie, car certaines conformations sont plus stables que d"autres;la stéréoisomérie de configuration : p ourobtenir u nstéréoisomère à partir de l"autre
il faut rompre une liaison covalente, i.e. une réaction chimique est nécessaire. Les stéréoisomères présentent souvent des caractéristiques physiques et/ou chimiques différentes.Stéréoisomères de conformation :C
CH 3HH CCH3 H HC HCH 3H CCH3 H HStéréoisomères de configuration :
1. Énantiomères : 2.a. Diastéréoisomères Z/E :
(D)RCHNH2CO
2H (E)-but-2-ène (L)RC H NH2 CO2H(molécules chirales) (Z)-but-2-ène
2.b. Diastéréosimères à 2 C*:C
CH 2OH H OHC CHOH OH Le symbole C*représente un atome de carbone asymétrique, i.e. lié à 4 groupes de natures différentes, ce qui présente une possibilité de diastéréoisomérie.2.1. MOLÉCULES ORGANIQUES17
Deux énantiomères sont symétriques l"un de l"autre dans un miroir plan, et non-superposables. Une molécule chirale peut se présenter sous la forme de deux énantiomères.
Les acides-aminés, chiraux, sont notés
"L" (lévogyre) et "D" (dextrogyre), selon la position du groupe amino NH2en projec-
tion de Fisher, où le groupe carboyle est en haut.CCOOHCH3H2NHCCOOH
CH3NH2H
(L)-alanine (D)-alanine (Autre moyen mnémotechnique : en regardant la molécule selon l"axe de la chaîne carbonée, le sens L (gauche) ou D (droite) est celui de la rotation amino!carboxyle). Remarque :un moyen mnémotechnique concernant la stéréoisomérie Z/E, pour les germanistes : "zusammen" (Z) signifie "ensemble", "entgegen" (E) signifie "en opposition". Pour les diastéréoisomères de molécules cycliques on utilise la notation "cis"/ "trans" plutôt que "Z"/ "E" :(cis)-1,4-diméthylcyclohexane (trans)-1,4-diméthylcyclohexane2.1.3 Classes fonctionnelles
Il existe de nombreuses fonctions organiques, comprenant des atomes de carbone, oxygène, azote, soufre, tellure, etc. Le tableau en fin de chapitre en regroupe quelques- unes, avec des exemples. Quelques règles sont à respecter en nomenclature. En présence d"un groupe fonctionnel, le carbone portant le groupe a le numéro 1 dans la chaîne carbonée principale, qu"on choisit comme la plus longue chaîne carbonée partant de cet atome. Le groupe fonctionnel "principal" qui donne son nom à la molécule, est choisi selon un ordre de priorité : 1) fo nctionà double liaison C --O (acide, ester, aldéhyde, cétone, amide); 2) fo nctionamine ; 3) a lcool; 4) c haînecarb onée. Remarques - exemples du tableau :Le diméthyléthanamide, ou diméthylformamide de son nom usuel, est un solvant. L"éthanoate de butyle est un additif alimentaire. Le cyclohexane est un solvant organique, couramment utilisé du fait de sa faible toxicité. L"octane est un alcane au fort pouvoir calorifique utilisé dans les carburants de moteurs àessence : un indice d"octane élevé est généralement recherché (95 ou 98 pour les voitures,
100 ou 110 pour les avions).
18CHAPITRE 2. CHIMIE ORGANIQUE
2.2 Spectroscopie UV et visible
2.2.1 Spectre d"absorption et couleur apparente
Nous avons vu quelques exemples de spectres d"émission montrant des raies d"absorp- tion dans le chapitre 3 de l"UV PS 80 (spectres d"atmosphères d"étoiles, absorption par l"atmosphère de la Terre). Les longueurs d"onde absorbées dans le domaine UV-visiblecorrespondent à des transitions énergétiques permises aux électrons périphériques (ou
électrons de valence) des molécules absorbant ces radiations. Les spectres d"absorption représentent l"absorbanceA(définition au paragraphe sui- vant) d"une substance chimique en fonction de la longueur d"onde, sur une certaine plage du spectre EM, ici le domaine UV et visible. Le spectre d"absorption (a) ci-dessous est celui du bleu de méthylène, une substance d"un bleu profond entrant dans la composition des "gouttes bleues R ". On observe princi- palement une large bande d"absorption dont le maximum se situe àmax= 660nm. (a)(b)La lumière apparente d"une substance
colorée est la couleur complémentaire (à l"opposé sur la roue des couleurs ci-contre) de la couleur la plus absorbée (mcor- respondant au maximum d"absorbance). La longueur d"onde majoritairement absorbée par le bleu de méthylène est le rouge, d"où sa couleur apparente bleue.Si le spectre présente plusieurs bandes
d"absorption (par ex. teinte sensible d"un in- dicateur coloré de pH), la couleur apparente sera la superposition des couleurs complé- mentaires des longueurs d"onde principale-ment absorbées.Le spectre d"absorption (b) ci-dessus est celui du paracétamol, qui se présente sous
forme de cristaux blancs : aucune partie du spectre visible n"est absorbée, les bandes d"absorption se situent dans le domaine UV. Remarque :nous nous intéressons essentiellement ax molécules organiques dans ce chapitre. Cependant, plusieurs substances minérales absorbent en partie le rayonnement visible et présentent une coloration, par ex. permanganate, diiode ou cuivre II, et toute cette section sur la spectrométrie UV-visible s"y applique de la même manière.2.2. SPECTROSCOPIE UV ET VISIBLE19
2.2.2 Spectrophotomètre
On mesure un spectre d"absorption UV-visible à l"aide d"un spectrophotomètre (cf. schéma de principe ci-dessous). En balayant le spectre EM de 200 à 800 nm, on mesure l"absorbance à chaque longueur d"onde de ce domaine.LampeUV-visible
R´eseau
I0S´eparateur
Cuve IAnalyse
AλL"absorbance à la longueur d"ondes"écrit : A = logII 0oùI0est l"intensité de la lumière incidente etIl"intensité de la lumière transmise, ou
encore : A =log(T) oùTest la transmittance mesurée à la longueur d"onde.2.2.3 Loi de Beer-Lambert
L"absorbance est proportionnelle à la quantité de substance colorée traversée, donc à la concentration molaire en solution, c"est la Loi de Beer-Lambert : A=kc La constantek(mesurée enL:mol1) dépend de l"épaisseur de substance colorée tra-versée par la lumière, i.e. de la largeur de la cuve, on en déduit une autre forme de la Loi
de Beer-Lambert : A max="maxc` où`est la largeur de la cuve (encm),cest la concentration molaire de l"espèce colorée, et"est son coefficient d"extinction molaire (mesuré enL:mol1:cm1). Cette relation est vraie à toutes les longueurs d"onde, mais elle est généralement plus utilisée au maximum d"absorbanceAmax, car le coefficient d"extinction molaire maximale"maxest une grandeur tabulée. On classe les substances colorées selon leur degré d"absorption : fortemen tabsorban tes,ou in tensémentcolorées : "max>103mol:L1:cm1; p euabsorban tes,ou p eucolorées : "max<102mol:L1:cm1. Le bleu de méthylène a un coefficient d"extinction molaire maximale"max= 5;6:104L:mol1:cm1, c"est donc une substance très absorbante. On met en application la loi de Beer-Lambert dans des dosages par étalonnage spec- trophotométrique (cf. TP 1 CM 11 et TD2b).20CHAPITRE 2. CHIMIE ORGANIQUE
2.2.4 Groupes chromophores et effet bathochrome
On nomme "effet bathochrome" la tendance empirique suivante : la longueur d"onde de maximum d"absorption des alcènes conjugués se déplace vers le rouge à mesure quela chaîne carbonée (conjuguée) s"allonge. Typiquement, un alcène présentant au moins 7
doubles liaisons conjuguées est le plus souvent une espèce colorée.Alcène max(nm)160 220250
300
-carotène450
où la formule topologique du-carotène est la suivante :Les groupes fonctionnels des molécules organiques sont dits "chromophores" car ils
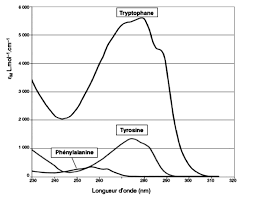
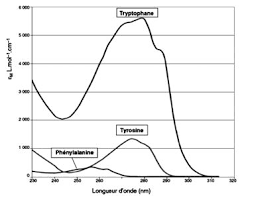
sont à l"origine de certaines bandes d"absorption - le décalage vers le rouge de ces bandes d"absorption suit également la tendance de l"effet bathochrome avec l"allongement de la chaîne carbonée. Voici quelques exemples :ClasseExemple max(nm)AlcèneCH 3CHCH 2170AromatiqueC
6H6200 & 260
AldéhydeCH
3CHO180 & 290
CétoneCH
3COCH3190 & 280
Acide carboxyliqueCH
3COOH200
AmideCH
3CONH 2210AmineCH
3NH 22102.3. SPECTROSCOPIE IR21
2.3 Spectroscopie IR
2.3.1 Spectre d"absorption
Dans le domaine IR, une substance moléculaire présente des bandes d"absorption cor- respondant aux transitions entre des niveaux d"énergie dits vibrationnels et rotationnels. Les états vibrationnels correspondent à différents positionnements des atomes autour des longueurs et des angles idéaux des liaisons covalentes : élongation-contraction des liaisons, synchronisation des vibrations des différentes liaisons, torsion autour des liaisons simples, bascule d"un groupe (carboné ou fonctionnel) autour du point d"attache à la chaîne carbonée, etc. La spectroscopie IR que nous étudions dans ce chapitre repose sur ces transitions énergétiques, de l"ordre de101eV. Les écarts entre états rotationnels sont de l"ordre de103eV. Ces transitions ne font pas intervenir de modification de géométrie d"une molécule, mais une mise en rotation de l"ensemble de la molécule autour d"un de ses axes de symétrie. Elles sont utilisées en spectroscopie Raman et spectroscopie micro-ondes, qui ne sont pas abordées dans ce cours.Le spectre d"absorption ci-contre est ce- lui de la propanone (en phase gazeuse). Le nombre d"onde= 1=(mesuré encm1) est représenté en abscisse. La transmittance T =I=I0est représentée en ordonnée, où I0est l"intensité du rayon lumineux inci-
dent, etIest l"intensité du rayon trans- mis par l"échantillon (cf. schéma du spec- tromètre plus bas). Le domaine représenté dans un spectre IR va de900à4000cm1. La partie du spectre aux nombres d"onde inférieurs à1500cm1est appelée empreintede la molécule : il s"agit des bandes d"absorption des liaisons covalentes simples de la chaîne
carbonée. Celles-ci forment un motif complexe généralement comparées directement à des
spectres de références. La partie du spectre aux nombres d"onde supérieurs à1500cm1présente moins de bandes d"absorption. Celles-ci sont caractéristiques des liaisons covalentes (autres que C-C) constituant la molécule. L"allure et la position exacte de ces bandes d"absorption caractéristiques dépend notamment des masses des atomes mis en jeu, de la force de la liaison (simple ou multiple), de la conjugaison au système de doubles liaisons, et de la phase de la substance étudiée (voir paragraphe suivant). Les position, largeur et intensité de la bande d"absorption correspondant à un type de liaison sont tabulées (cf. extrait de table de référence à la fin de ce chapitre). Dans le spectre ci-contre, la bande large et intense vers3000cm1est due aux liaisons C-H, et la bande fine et intense vers1700cm1, à la liaison C--O.
L"analyse du spectre IR, en plus d"au moins un autre élément (par ex. la formule brute du composé, ou la réaction chimique dont il est issu) permet de reconstituer la structure moléculaire, voire d"identifier la molécule.22CHAPITRE 2. CHIMIE ORGANIQUE
2.3.2 Liaison hydrogène
En phase condensée (liquide ou solide),
la densité de matière plus élevée permet la formation de liaisons entre les molécules, appelées "liaisons hydrogène". Il s"agit d"in- teraction électrostatique entre les atomes d"hydrogène d"une molécule et les dou- blets électroniques d"une molécule voisine, par exemple ceux des atomes d"oxygène ou d"azote.Cette liaison intermoléculaire ajoute une
bande d"absorption, large et intense, aux alentours de3200à3500cm1(cf. spectres du butanol ci-contre, en phase gazeuse (en haut) et en phase condensée (en bas)).2.3.3 Spectromètre IR Le spectromètre IR fonctionne sur un principe semblable au spectrophotomètre UV- visible. La substance étudiée peut être introduite sous forme gazeuse (dans une ampouleadaptée), liquide, ou solide (broyée et en couche mince entre deux plaques). La référence
est soit le solvant (si la substance étudiée a été diluée pour la mesure) soit une substance
dont le spectre sert à étalonner de l"appareil. Le spectromètre balaie les longueurs d"onde allant de 2,5 à 16m.Source IR´EchantillonR´ef´erence
S´eparateurD´etecteurAnalyse
Tλ2.4. SPECTROSCOPIE RMN DU PROTON23
2.4 Spectroscopie RMN du proton
2.4.1 Résonance magnétique nucléaire
Découverte en 1945 par Bloch et Purcell (qui leur valut un Prix Nobel en 1952), ce phénomène consiste en l"interaction du spin du noyau atomique avec un fort champ magnétique ambiant. Un champ magnétique variable (i.e. une onde électromagnétique, du domaine des micro-ondes) induit un déplacement des électrons du cortège électronique (variable aussi). Ce champ local variable provoque un changement d"état : entre spin alignéet spin anti-aligné avec le champ magnétique. Ceci corespond à une transition énergétique
de faible amplitude (cf. raie à 21 cm de l"hydrogène en astrophysique qu"on a mentionnée dans le chapitre 2 PS80). Un spectre de résonance magnétique montre des pics aux fréquences auxquelles les atomes interagissent de façon maximale avec le champ variable. Les atomes d"hydrogène sont les plus présents dans la matière organique et ceux qui interagissent le plus visible- ment. L"environnement d"un proton (noyau d"hydrogène) donné, dans une molécule, c"est-à-dire les atomes auxquels il est lié et la répartition du nuage électronique, définit le
champ magnétique local vu par ce proton. La fréquence de résonance d"un proton dans une molécule dépend donc de son environnement. En analysant le spectre de résonance du proton d"une molécule on peut donc en déduire sa structure. La RMN du proton est utilisée en biologie et en chimie : imagerie médicale (IRM ouImagerie à Résonance Magnétique), détermination de la structure développée de molécules
(par ex. des protéines qui n"ont pas encore été totalement caractérisées), identification de
produits formés lors de nouvelles réactions.2.4.2 Déplacement chimique
La figure ci-contre présente le spectre
RMN de la molécule d"actétate d"éthyle.
L"axe des ordonnées n"est pas représenté car seules les amplitudes relatives des signaux sont prises en compte. Plutôt que la fré- quence, c"est le déplacement chimique (noté et mesurée en parties par million ou ppm)qui apparaît en abscisse.Le déplacement chimique est défini par-rapport à la fréquence de résonance d"une
molécule de référence dans l"appareil utilisé (le plus souvent en RMN du proton, il s"agit
du tétraméthylsilane Si(CH3)4). Ainsi, si la fréquence exacte de résonance d"un proton
dépend de l"appareil utilisé, le déplacement chimique correspondant à cette résonance n"en dépend pas.2.4.3 Analyse d"un spectre RMN
Chaque groupe de pics de résonance, appelé signal, correspond à un groupe de pro- tons équivalents, i.e. ayant le même environnement. Dans notre exemple, les 3 signaux correspondent aux 3 groupes suivants : group e1 : ( H3CCOOC);
24CHAPITRE 2. CHIMIE ORGANIQUE
group e2 : ( OCH 2C); group e3 : ( H 2CCH 3). L"aire sous chaque signal est proportionnel au nombre de proton dans le groupe de pro- tons équivalents produisant ce signal. On représente souvent la courbe d"intégration (entotalité, ou juste la variation due à chaque signal). L"aire sous le signal est égale à l"aug-
mentation de la valeur de l"intégrale, i.e. à la hauteur du saut de la courbe d"intégration.
Dans notre exemple :
group e1 : 3 protons ; group e2 : 2 protons ; group e3 : 2 protons. Et la courbe d"intégration du spectre montre 2 sauts de même hauteur, et un qui est 1,5 fois plus haut. Ce dernier correspond donc au groupe de 3 protons. La multiplicité de chaque signal (i.e. le nombre de pics) est égal au nombre de protons voisins de ce groupe, plus un. Les protons voisins sont ceux liés au(x) carbone(s) adjacentsde celui auquel sont liés les protons du groupe, les protons liés à un atome d"oxygène ou
d"azote (groupes hydroxyle, carboxyle, amino) sont ainsi "isolés" du reste de la molécule et n"ont pas de voisins. Les différents pics correspondent aux couplages possibles entre l"interaction avec le champ magnétique d"une part, et l"interaction avec les protons voisinsquotesdbs_dbs16.pdfusesText_22[PDF] comment reconnaitre un adjectif dans une phrase
[PDF] comment reconnaitre un nom commun
[PDF] trouver les noms dans un texte ce1
[PDF] comment reconnaitre un nom dans une phrase
[PDF] reconnaitre le nom ce1
[PDF] trouver le nom dans une phrase ce1
[PDF] comment reconnaitre un déterminant
[PDF] syndic judiciaire cout
[PDF] syndic judiciaire désignation
[PDF] nomination syndic provisoire
[PDF] requête en désignation d'un syndic provisoire
[PDF] désignation administrateur provisoire
[PDF] nomenclature des amines exercices corrigés
[PDF] comment nommer un ester
