 Biochimie en 24 fiches
Biochimie en 24 fiches
I L'ordre de priorité des principales fonctions chimiques. FICHE 1. Fonction Prendre 110 Da comme masse molaire moyenne d'un acide aminé. Solution. 1. La ...
 polycopie C
polycopie C
ordre de priorité : 1) fonction à double liaison C––O (acide ester
 BIOCHIMIE
BIOCHIMIE
L'ordre de priorité des principales fonctions chimiques. Fonction. Nom. Préfixe. Suffixe. R––CO––OH. Acide carboxylique. Carboxy. Acide… – oïque. R––CO––OR'.
 Schéma national du maintien de lordre
Schéma national du maintien de lordre
ordre et des moyens techniques spécialisés. Afin de garantir durablement l ... de produits chimiques inflammables ou explosifs interdiction de stationnement
 Conduite à tenir en médecine de premier recours devant un enfant
Conduite à tenir en médecine de premier recours devant un enfant
• Utilisation de moyens mnémotechniques ;. • Choisir des activités d'apprentissage Appels (numéroter par ordre de priorité) : ❑ Parents ou tuteur Tél ...
 Pré-rentrée PASS 2021/2022 Louise GILLET & Adrien RAULT
Pré-rentrée PASS 2021/2022 Louise GILLET & Adrien RAULT
Moyen mnémotechnique : Flore Oblige Claude à de NomBreuses Idioties Les autres fonctions avec comme ordre de priorité : R < X < N < S. < O c. les ...
 SDIS 03
SDIS 03
22 mai 2019 ... ordre initial et les ordres de conduite suivants. Ils sont formalisés grâce au moyen mnémotechnique suivant : Signification. Ordre initial.
 GDO Exercice du commandement
GDO Exercice du commandement
ordre initial et les ordres de conduite suivants. Ils sont formalisés grâce au moyen mnémotechnique suivant : Signification. Ordre initial / de conduite. S ...
 Présentation PowerPoint
Présentation PowerPoint
conscience de l'enfant en fonction de l'âge du développement. L'utilisation de l'acronyme AVPU est un moyen mnémotechnique pour déterminer le niveau de
 LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
On appelle groupement fonctionnel ou fonction chimique l'atome ou le groupe d'atomes Le classement des groupements fonctionnels par ordre de priorité ...
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
n : nombre quantique principale n>0 il détermine la distance moyenne entre Tableau 2 : Nomenclature des fonctions classées par ordre de priorité.
 BIOCHIMIE
BIOCHIMIE
1. L'ordre de priorité des principales fonctions chimiques. Fonction Un moyen mnémotechnique pour les retenir : Le Très Lyrique Tristan.
 Biochimie en 24 fiches
Biochimie en 24 fiches
I L'ordre de priorité des principales fonctions chimiques. FICHE 1. Fonction Un moyen mnémotechnique pour les retenir : Le Très Lyrique Tristan.
 polycopie C
polycopie C
(Autre moyen mnémotechnique : en regardant la molécule selon l'axe de la chaîne qui donne son nom à la molécule est choisi selon un ordre de priorité :.
 Urgences
Urgences
Trier les urgences en fonction de la gravité produits chimiques. ... de 5 ans de l'ordre de 1 à 15 % (moyenne de 10 %) liée probablement à la souplesse ...
 Nomenclature des carbo- et hétérocycles
Nomenclature des carbo- et hétérocycles
priorité des radicaux ? fonction de la taille (nombre de C de chaque radical) Si 2 séquences ? même total ? ordre alphabétique des substituants ...
 SDIS 03
SDIS 03
22?/05?/2019 d'appréciation intégré à la fonction de commandement et inhérent à la ... Ils sont formalisés grâce au moyen mnémotechnique suivant :.
 Pr. Séraphin
Pr. Séraphin
Moyen mnémotechnique : Il faut donc déterminer l'ordre de priorité des différents substituants. La fonction des propriétés chimiques identiques.
 LES GLUCIDES
LES GLUCIDES
Les oses qui possèdent une fonction aldéhyde sont appelés des aldoses et ceux numérotés selon un ordre de priorité (du numéro atomique le plus élevé :.
 Ordre de priorité des fonctions chimiques - JeRetiens
Ordre de priorité des fonctions chimiques - JeRetiens
26 jui 2016 · L'ordre de priorité des fonctions est une convention définie par l'IUPAC Malheureusement la seule façon de ne pas se tromper est
 [PDF] Pr Séraphin - 2ATP
[PDF] Pr Séraphin - 2ATP
Moyen mnémotechnique : Il faut donc déterminer l'ordre de priorité des différents substituants La préséance va à l'atome avec le plus fort numéro atomique
 [PDF] Chimie Organique - univ-ustodz
[PDF] Chimie Organique - univ-ustodz
Fonction chimique ou groupement fonctionnel I 3 Le classement des groupements fonctionnels par ordre de priorité décroissante
 Moyen mnémotechnique - Innovations Pédagogiques
Moyen mnémotechnique - Innovations Pédagogiques
En chimie organique en nomenclature pour l'ordre de priorité des fonctions c'est "L' acide et (ether) l'amidon (amide) neutralisent
 Nomenclature (chimie)/Fonctions - Wikiversité
Nomenclature (chimie)/Fonctions - Wikiversité
20 mai 2021 · Tous les composés organiques pour pouvoir être identifiés rapidement sont nommés suivant la fonction à laquelle ils appartiennent
 [PDF] Chapitre 2 - Chimie organique
[PDF] Chapitre 2 - Chimie organique
(Autre moyen mnémotechnique : en regardant la molécule selon l'axe de la chaîne qui donne son nom à la molécule est choisi selon un ordre de priorité :
 [PDF] Chapitre 3: Nomenclature en chimie organique
[PDF] Chapitre 3: Nomenclature en chimie organique
De groupes fonctionnels caractéristiques des fonctions chimiques (alcool acide dans ce tableau sont rangés dans l'ordre décroissant de priorité
 [PDF] Rappels de chimie théorique
[PDF] Rappels de chimie théorique
moyenne de l'électron au noyau ; celle-ci augmente avec n On parle alors de fonctions diffuses (par opposition aux fonctions contractées)
 [PDF] Un moyen mnémotechnique simple pour vérifier les notations
[PDF] Un moyen mnémotechnique simple pour vérifier les notations
– Le dividende (a) est le nombre total d'électrons de valence de tous les atomes A et X du système chimique étudié – Le diviseur (b) est égal à 8 – Le
Comment retenir les fonctions chimiques ?
Phrase mnémotechnique pour retrouver l' ordre de priorité : Ah si Carbo (acide carboxylique) était(ester) amie(amide) notre(nitrile) alors(aldéhyde) ces(cétone) alcools(alcool) tiendraient(thiol) nos amis(amine).20 mai 2021Comment savoir si une fonction est prioritaire ?
- La fonction prioritaire est désignée par un suffixe et on numérote la chaîne principale de façon à attribuer à cette fonction l'indice le plus petit possible. - Les autres fonctions sont désignées par des préfixes.Comment nommer les fonctions chimiques ?
La nomenclature suit les mêmes règles. Les fonctions sont caractérisées par un suf- fixe (éventuellement précédé d'un numéro de position). Les hydrocarbures possédant une (ou plus) double liaison C = C appartiennent aux alcènes ; ceux possédant une triple liaison C ? C appartiennent aux alcynes.- Les fonctions chimiques sont classées selon leur valence. Une fonction est dite principale lorsqu'elle a la valence la plus élevée.
ǯ- département PluriPASS
Année universitaire 2020-2021
Pr. Séraphin
Pour toutes vos questions : ue4@asso2atp.fr
Association Angevine du Tutorat PASS
ǯǡn cas de relecture par ces derniers.
Seuls les enseignements dispensés par les enseignants feront foi pour les examens. 2ATP. 1Faculté de Santé
Département PluriPASS
Pr. Séraphin
1Faculté de Santé
Département PluriPASS
Pr. Séraphin
CHIMIE ORGANIQUE .................................................................................3 CHAPITRE N°1 : ASPECTS FONDAMENTAUX DE LA STRUCTURE ..........3 I. GENERALITES CONCERNANT LES MOLECULES ORGANIQUES ............................. 3II. CONFORMATION ..................................................................................................... 9
III. ISOMERIE ............................................................................................................... 12
Récapitulatif ..................................................................................... 22
Entrainements .................................................................................. 25Corrections ....................................................................................... 28
Notes ................................................................................................ 32
CHAPITRE N°2 : REACTIVITE DES MOLECULES ORGANIQUES ............ 33 I. BASE DE REACTIVITE - EFFETS ELECTRONIQUES ................................................. 33II. ALCOOLS ................................................................................................................ 39
III. AMINES .................................................................................................................. 41
IV. ALDEHYDES ET CETONES .................................................................................... 46
V. ACIDES CARBOXYLIQUES ..................................................................................... 50
VI. THIOLS .................................................................................................................. 55
Récapitulatif ..................................................................................... 58
Entrainements .................................................................................. 61 CORRECTIONS ................................................................................. 64Notes ................................................................................................ 67
Faculté de Santé
Département PluriPASS
2Pr. Séraphin
3Faculté de Santé
Département PluriPASS
Pr. Séraphin
CHAPITRE N°1 : ASPECTS FONDAMENTAUX DE LA STRUCTURE I. GENERALITES CONCERNANT LES MOLECULES ORGANIQUES A) Les représentations des molécules organiquesLes représentations les plus simples des molécules organiques ont pour intérêt de préciser la nature des
prendre en compte le nombre de liaisons usuelles que chaque atome peut établir : - 4 pour le carbone (C) Il faut aussi savoir que les différents ǯ impliquent des géométries ǡǯ faut intégrer pour reconnaître les bonnes représentations spatiales de chaque molécule : - Le carbone sp3 (engagé seulement dans des liaisons simples) est au ǯ - Le carbone sp2 est engagé dans une liaison double plane - Le carbone sp engagé dans une triple liaison est aligné avec ses substituants a) Représentations planesDans la représentation développée plane, tous les atomes et toutes les liaisons de la molécule sont
représentées : (méthane) (éthylamine) liaisons CH ne sont pas représentées est alors utilisée : La représentation topologique ǯ : seulement les liaisons deentre plusieurs segments correspondent à un carbone. Implicitement, ce carbone est relié au nombre
ǯspecter sa tétravalence. Ainsi : correspond ànécessaire de les écrire. Ce mode de représentation simplifie la description des molécules cycliques ou
ǯǯnt uniquement sur la
nature des atomes et des liaisons de la molécule. Ainsi, elles ǯǯ spatiale de chaque atome.Faculté de Santé
Département PluriPASS
4Pr. Séraphin
b) ǯ- Par différenciation des liaisons Les représentations dans l'espace permettent de donner des informations sur ǯ tridimensionnelle de la molécule.Dans la représentation dite en coin volant ou de Cram, on dispose de 3 types de représentation des liaisons qui
est représentée en trait pointillé. Une liaison en traǯ plan : (bromochlorométhane) c) Représentation dans l'espace - Projections planes de Newman ou celle de Fischer. La représentation selon Newman peut être utilisée pour examinǯǯ hybridation sp3 du carbone. Ainsi correspond donc àCette représentation de Newman est aussi utilisée pour définir précisément la posiǯ
ǯ qui masque le second carbone. Seuls les substituants de ce dernier sont apparents. La
on obtient cette représentation :Pour les molécules plus complexes, cette limitation est conservée. Par exemple, dans la molécule à côté,
Dans la représentation de Fischer, il est convenu de représenter les liaisons uniquement horizontalement
5Faculté de Santé
Département PluriPASS
Pr. Séraphin
Ainsi, on a les correspondances suivantes :
La représentation de Fischer est fréquemment utilisée pour représenter les biomolécules (oses), avec la chaine
carbonée positionnée verticalement et la fonction la plus oxydée de la chaine carbonée en haut. En raison de
ǯe.
B) Notion de fonction
Les propriétés physiques ou de réactivité chimique des molécules organiques sont à mettre en relation
ǯ ǯ fonctions chimiques (ou groupes
fonctionnels). Ainsi toutes les molécules portant la même fonction auront des propriétés communes.
Par exemple, le méthanol (CH3OH) et le propranolol réagissent de la même manière avec Na pour former H2. Ils
présentent aussi le même comportement vis à vis de rayoǦǯ à des nombres appelé fonction alcool. a) Les hydrocarbures ǯions des molécules organiques. On peut doncǯǣhydrocarbures.
Parmi ceux-ci on trouve différents sous-groupes. Tǯǡalcanesǡǯliaisons multiples et donc uniquement constitués de carbones sp3. Parmi les hydrocarbures insaturés (présentant
des liaisons multiples), on trouve les alcènes comportant au moins 2 carbones sp2 (et donc une double liaison
C=C), et les alcynes avec au moins de carbones sp (et une triple liaison carbone/carbone). Certains hydrocarbures
ǡǯarènes (ou composés aromatiques), dérivant du benzène C6H6.Point clé : Chaque représentation informe sur les substituants et la conformation de la molécule. Il
identiques.Faculté de Santé
Département PluriPASS
6Pr. Séraphin
b) ǯLes alcools sont des dérivés comportant un hydroxyle (OH) substituant un carbone hybridé sp3. Selon
ǯǯǡprimaires (2H lié au C), secondaires "ol», comme pour le méthanol CH3Ǧǡǯ3CH2OH. (alcool primaire) (alcool secondaire) (alcool tertiaire)Les phénols ne sont pas des alcools, et présentent un groupement hydroxyle qui ne substitue pas un
carbone sp3, mais un cycle benzénique. La fonction phénol est par exemple présente dans la structure de la
morphine, un antalgique majeur. (phénol) La fonction éther ȋǦȌǦǦǯȋǯȌLes aldéhydes et les cétones sont des fonctions qui présentent en commun la présence ǯ,
La structure des aldéhydes et des cétones est donc respectivement : RCHO et RCORǯȋǯsubstituants commençant par un carbone et ne peuvent pas correspondre à un hétéroatome tel que N ou O). Le
plus simple des aldéhydes HCHO est le méthanal (ou formol). La plus simple des céton ǯ
CH3COCH3. La désignation des aldéhydes est marquée par une terminaison " al », tandis que pour les cétones,
la terminaison est " one ». (propanal) (butanone) Les acides carboxyliques, dont la structure correspond à RCO2H, sont caractǯcarboxyle (CO2H) qui peut être lié à un hydrogène, un groupement carboné de type alkyle (R) ou aryle (Ar).
(acide formique) (acide acétique) (acide benzoïque) Les esters sont caractérisés par un enchaînement correspondant à : 7Faculté de Santé
Département PluriPASS
Pr. Séraphin
ȋ ǯȌ(lactone : lovastatine)
c) ǯ Les amines ǯǯ impliqué dans 3 liaisons simplesréalisées avec des substituants carbonés de type alkyle ou aryle. De la même façon que les alcools, selon le degré
ǯǡ primaires (RNH2), secondaires (ǦǦǯ) et tertiairesLa dénomination chimique des amines consiste à rajouter un suffixe amine à la désignation des groupes R.
CH3NH est ainsi dénommé méthylamine (CH3 est un radical méthyle). Pour les amines polysubstituées, les
différents groupements sont présentés en préfixe : méthyléthylamine pour CH3NHCH2CH3. Si des substituants
sont identiques, un préfixe multiplicatif est utilisé (di pour 2, tr'ǥȌǣnsi le triméthylamine correspond à
N(CH3)3. La plus simple des amines portant un substituant aromatique est appelée aniline (C6H5NH2).
(éthylamine) (éthylpropylamine)Les nitriles sont des dérivés organiques comportant une triple liaison carbone/azote, dont la structure
utiliǯses chromatographiques. Les amides sont des dérivés comportant un azote sp3 ǯ. Cette fonctionamide qui caractérise aussi les peptides et les protéines est, dans ce cas, dénommée liaison peptidique. Tout
comme on retrouve des esters cycliques (lactone), les amides qui constituent un cycle sont appelés lactames.
(structure des amides) (lactame) Les dérivés nitrés, de structure RȂNO, comportent ǯǯ(représentée par la flèche, elle peut être assimilée à une double liaison). Dans le domaine de
ǡǯrbide pour lequel NO2 est lié à un oxygène est utilisé pour traiter des pathologies vasculaires. (composé nitré) (nitǯȌFaculté de Santé
Département PluriPASS
8Pr. Séraphin
d) Composés organiques comportant du soufre Les thiols, de structure RSHǡ ǯ ols, avec du soufre qui remplaceLes thioéthers, de structure R-S-ǯ, sont des équivalents des éthers, le soufre remplaçant également
Il existe également les acides sulfoniques, de structure R-SO3H. e) Composés organiques comportant du fluor, chlore, brome ou iode Ces atomes monovalents (F, Cl, Br, I) sont reǯǯ, et représentés de manière indifférenciée par un X. Les dérivés halogénés, de structure RX (ǯ) comportent donc un halogène lié au ǯ, tandis que les dérivés halogénés aromatiques (ou ǯ) sont de typeArX. Certains dérivés halogénés (CHCl3 ou chloroforme, CH2Cl2 ou chlorure de méthylène ou dichlorométhane)
sont utilisés comme solvants. (dichlorométhane) Point clé : Nomenclature des molécules organiques.Pour nommer une molécule organique, il faut identifier la chaîne principale (celle qui
ǯȌ : on trouve ainsi le radical " méth- » (1C), " éth- » (2C), " prop- », " but- », " pent- ǽǥfonction principale ȋǯ plus oxydée dans la molécule) : on nomme alors le suffixe ǯindiquant sa position dans la chaîne carbonée. Enfin, il faut identifier les autres fonctions ou autres
substituants de la chaîne carbonée : on trouve ainsi les préfixes, précédés également de leur
Nom de la fonction Suffixe Préfixe
Acide carboxylique Acide -oïque Carboxy-
Ester -oate de -yle Alkyloxycarbonyle-
Amide -amide Alcanamido-
Aldéhyde -al Formyle-
Cétone -one Oxo-
Alcool -ol Hydroxy-
Thiol -thiol Mercapto-
Amine -amine Amino-
Ether -éther Alkoxy-
Oxydation
++ oxydé -- oxydé 9Faculté de Santé
Département PluriPASS
Pr. Séraphin
II. CONFORMATION
A) Introduction
Dans ce chapitre, nous aborderons une caractéristique importante de toutes les molécules organiques,
leur capacité à se déformer : cela revient à considérer que diffǯ de la molécule peuvent rendre compte de sa structure.Les différentes représentations des molécules abordées lors du premier chapitre laissent penser que celles-ci sont
figées. En fait, seules les liaisons multiples (double et triple) bloquent la molécule dans une géométrie bien définie
avec 6 atomes ȋǯγȌ͜ȋ carbonecarbone) ǣǯpas les déformations.Cependant, la liaison simple CC permet des modifications de la position des 6 substituants de deux carbones sp3
voisins : on parle de la libre rotation de la liaison simple. Les molécules organiques comportent généralement
de nombreuses liaisons simples, il existe donc une infinité de dispositions spatiales des atomes ǯ
molécule est appelée conformation. Le paǯ molécule se fait ǡǯ simples. (deux conformations ǯȌB) Conformations des alcanes
ǯǡǣconformation décalée qui éloigne au maximum lessubstituants des 2 carbones, et la conformation éclipsée pour laquelle au contraire les hydrogènes sont le plus
niveaux extrêmes, appelée barrière de rotation, est toutefois faible : une dizaine de KJ.mol-1.
Le passage de la conformation décalée de plus bas niveau énergétique à la conformation éclipsée de plus
haut niveau énergétique nécessite que ǯ. La mêmeǯe dans le milieu lors du passage de la conformation éclipsée à celle décalée. Il faut
100 fois plus fréquente.
(conformation éclipsée) (conformation décalée)Faculté de Santé
Département PluriPASS
10Pr. Séraphin
Le même principe se retrouve pour des hydrocarbures plus complexes. La conformation privilégiée est
celle de plus bas niveau énergétique qui éloigne au maximum les substituants les plus volumineux de deux
carbones voisins. Elle correspond en fait à une chaine carbonée en zigzag.C) Conformations du cyclohexane
Le cyclohexane est pris en exemple dans la mesure où ce système cyclique est retrouvé dans des
privilégiées, les conformations chaise et bateau. (conformation chaise) (conformation bateau)Dans les deux cas, seulement 4 atomes de carbone de la molécule sont coplanaires. Dans la conformation chaise,
la conformation bateau. Les conformations chaise et bateau ne sont pas énergétiquement équivalentes, mais le
conformation chaise est privilégiée, elle est de plus bas niveau énergétique. 11Faculté de Santé
Département PluriPASS
Pr. Séraphin
D) Conclusion
Les molécules organiques comportant de nombreuses liaisons simples trouvent en fait suffisammentǮ des
conformations énergétiques moins favorables, de niveau énergétique supérieur. La transition inverse est aussi
organiques ne sont pas figées, et se déforment constamment. Ces déformations se réalisent uniquement par
des rotations au niveau de liaisons simples, sans aucune cassure de liaisons. ǡǯǯ réaction chimique.Ces possibles déformations des molécules organiques sont très importantes, et nous prendrons deux
ǯ ne permet pas la réaction. Pour que la cyclisation se réalise, une déformation par rotation au niveau de la liaison simple C2C3 est nécessaire.La molécule doit donc adopter une conformation particulière, énergétiquement défavorable, pour réagir :
Cette idée est en fait transposable à un grand nombre de réactions chimiques. On peut même dire
ǯsement que les molécules organiques donnent lieu à des équilibres conformationnels, sinon les
réactions chimiques seraient en nombre très limité !Cette déformation des molécules organiques par équilibre conformationnel est aussi importante pour
ǯu récepteur. Là encore, heureusement que la molécule peut se déformer !Faculté de Santé
Département PluriPASS
12Pr. Séraphin
III. ISOMERIE
A) Isomérie plane
pas de préciser uniquement la nature des atomes qui la constitue. Ainsi, il existe trois molécules différentes de
formule brute C5H12. Ces trois molécules différentes, mais avec la même formule brute, sont appelées isomères.
Nous étudierons dans la suite de ce chapitre les différences plus ou moins marquées entre isomères et la
ǯanté.
ǯisomérie plane est la plus simple à repérer. Elle concerne, dans le cas le plus simple, des molécules
ayant uniquement en commun la formule brute, et qui diffèrent donc, par exemple, par la nature des fonctions.
ǡǯȋ3CH2OH) et le diméthyléther (CH3OCH3) sont des isomères de constitution.comportent les mêmes fonctions sur des squelettes carbonés différents. Dans le second, les isomères diffèrent
par ǯ. Ces isomères sont bien des moléculesȋǯu C4H10O)
B) Stéréoisomérie
ǯformule développée identique. Pour ces
ǡǯt identique, la différence se situant au niveau de ǯ liaisons, et le carbone asymétrique. a) Isomérie des doubles liaisons.La formule développée CH3CH=CHCH3 est en fait commune à deux stéréoisomères. En effet,
contrairement à la liaison simple, la liaison double C=C ǯ. Les 2 alcènes ci-dessous sont donc des molécules distinctes et différentes, qui ne sont donc pas en équilibre. (stéréo-isomères du but-2-ène)ȌǡǯE (entgegen signifiant opposer).
Afin de déterminer la nature Z ǯ ǡ donner une priorité aux 2substituants des 2 carbones de la liaison double. Si R1 est prioritaire par rapport à R2, et que R3 est prioritaire
sur R4, alors dans l'exemple ci-dessous, à gauche, les deux groupes prioritaires (R1 et R3) sont du même côté de
ǯǯ. On dit aussi que la configuration de la double liaison est Z. 13Faculté de Santé
Département PluriPASS
Pr. Séraphin
ȋǯȌǡ1 et R4ǡǯu
même côté de la double liaison mais étant ǯǯǡ la liaison double est E. ǯ liaisons doubles, C=N et N=N. ǯest défini selon les règles de Cahn, Inglod etPrelog.
La première de ces règles consiste à donner ǯ numéro atomique le plus élevé. On a
donc sans être exhaustif Cl > O > N > C > H.Si des isotopes sont comparés, la priorité est donnée à ǯ : T (tritium) > D (deutérium) > H.
Si la comparaison porte sur des groupements qui commencent par le même atome, il convient alors ǯ
les substituants de rang suivants. Selon cette règle, les groupements méthyle (CH3) et éthyle (CH2CH3) qui
commencent tous les deux par un carbone sont départagés grâce aux substituants suivants : il y a alors priorité
Les liaisons multiples sont donc considérées comme autant de liaisons simples : un carbone relié par une
ǡǡǯnir
la priorité.C=N et N=N
(neuroprotecteur, utilisé dans les maladies neurodégénératives) Moyen mnémotechnique : Il faǯiorité des différents substituants. LaI > Br > Cl > S > P > F > O > N > C > H
Igor Brise Clément Sans Prendre Froid, Officiellement Nathalie Cherche Harry.Faculté de Santé
Département PluriPASS
14Pr. Séraphin
Les isomères au niveau des doubles liaisons sont donc des molécules distinctes qui ne sont pas en
équilibre. Ils peuvent présenter des propriétés et une réactivité nettement différente. Ainsi, les acides maléique
ǯ ǯlubilité. De plus, des conditions fumarique. ǡǯǯe E peut aussi grandement différer. 15Faculté de Santé
Département PluriPASS
Pr. Séraphin
La configuration des doubles liaisons joue aussi un rôle important dans la vision des couleurs. En effet, la
configuration ne se fait pas spontanément (les isomères Z et E ne sont pas en équilibre) mais nécessite un process
b) Isomérie liée à la chiralitépharmaceutiques Quinimax® et Longacor® dont les molécules actives ont la même formule brute C20H24N2O2
et avec les mêmes groupes fonctionnels (éther, alcool secondaire, amine tertiaire, alcène) et cycles (quinoléine
et quinuclidine) et retrouvés avec la même connectivité (enchainement).Ces spécialités présentǣǯǡ
spatiale de substituants de certains carbones sp3. On parle ǯ car ces deux molécules sont dites
optiquement actives, elles interagissent avec la lumière polarisée.La lumière est une onde électromagnétique caractérisée par deux vecteurs électrique E et magnétique B
prendre toutes les orientations possibles de 0 à 360°. Un dispositif optique (polariseur) transforme la lumière
Faculté de Santé
Département PluriPASS
16Pr. Séraphin
Les principes actifs des spécialités Quinimax® et Longacor® présentent une activité optique. Cette propriété est
ǯpolarimètreǡǯǡǯui
Cette déviation de la lumière polarisée mesurée au polarimètre est définie par la loi de Biot. Elle est
proportionnelle à la concentration de la molécule à analyser dans la cuve, à la longueur de la cuve et à une
Remarquons que ce pouvoir rotatoire spécifique est une constante qui caractérise une molécule optiquement
La plupart des polarimètres utilisant, comme source lumineuse, une lampe à sodium générant une lumière
On constate que certaines molécules placées dans un polarimètre dévient la lumière polarisée vers la droite, elles
déviée vers la gauche : elles sont lévogyres, avec un pouvoir rotatoire spécifique négatif.
c) Chiralité avec carbone asymétriquedéterminer si une molécule sera ou non optiquement active ǯsa structure. Par exemple CH2Cl2,
CH4, CH3CH3, CH2=C2, C6H6 ... ne sont pas optiquement actifs. En effet, toutes ces molécules présentent au moins
ǯǡǡpas de plan de symétrie sont optiquement actives. Nousverrons aussi que ces molécules chirales optiquement actives ne sont pas superposables à leur image dans un
miroir (contrairement aux molécules non chirales). 17Faculté de Santé
Département PluriPASS
Pr. Séraphin
Pour illustrer cette notion, il est possible de se référer à des objets qui sont chiraux : les hélices de bateaux, les
ǯ ǡ ǡ ǡǯcentre
asymétrique (ou plusieurs), bien souvent un carbone hybridé sp3 et portant quatre substituants distincts
dénommé carbone asymétrique. Ainsi, à cettǯȋ-dessous) vont correspondre 2 molécules distinctes appelées énantiomères qui vont uniquement di ǯ ǯ substituants du carbone asymétrique. Ces énantiomères soǯǯCes énantiomères sont des isomères très similaires, qui présenteront de nombreuses caractéristiques
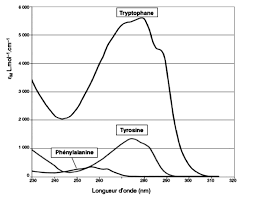
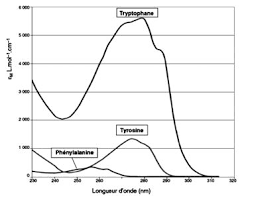
communes ǣ ǡ ǯǡ ǡ ǡrayonnements UV (ultraviolet) ou IR (infrarouge). Ils se distinguent donc essentiellement par leur activité
optique.Afin de nommer deux énantiomères, ǯ
énantiomères sera ǯ (rectusȌǯǯ (sinister). ǯrègles de Cahn, Inglod et Prelog qui permettent de classer les quatre substituantssubstituant le moins prioritaire) en arrière du carbone asymétrique. La configuration du carbone asymétrique
sera R si le sens de rotation pour passer des substituants classés 1 puis 2 puis 3 est le sens horaire. Si le sens de
rotation est antihoraire, la configuration est dite S.Faculté de Santé
Département PluriPASS
18Pr. Séraphin
méfloquine, un antipaludéen. On identifie la présence de 2 centres asymétriques notés 1 et 2. Ces deux centres
quotesdbs_dbs41.pdfusesText_41[PDF] comment reconnaitre un adjectif dans une phrase
[PDF] comment reconnaitre un nom commun
[PDF] trouver les noms dans un texte ce1
[PDF] comment reconnaitre un nom dans une phrase
[PDF] reconnaitre le nom ce1
[PDF] trouver le nom dans une phrase ce1
[PDF] comment reconnaitre un déterminant
[PDF] syndic judiciaire cout
[PDF] syndic judiciaire désignation
[PDF] nomination syndic provisoire
[PDF] requête en désignation d'un syndic provisoire
[PDF] désignation administrateur provisoire
[PDF] nomenclature des amines exercices corrigés
[PDF] comment nommer un ester
