 Biochimie en 24 fiches
Biochimie en 24 fiches
I L'ordre de priorité des principales fonctions chimiques. FICHE 1. Fonction Prendre 110 Da comme masse molaire moyenne d'un acide aminé. Solution. 1. La ...
 polycopie C
polycopie C
ordre de priorité : 1) fonction à double liaison C––O (acide ester
 BIOCHIMIE
BIOCHIMIE
L'ordre de priorité des principales fonctions chimiques. Fonction. Nom. Préfixe. Suffixe. R––CO––OH. Acide carboxylique. Carboxy. Acide… – oïque. R––CO––OR'.
 Schéma national du maintien de lordre
Schéma national du maintien de lordre
ordre et des moyens techniques spécialisés. Afin de garantir durablement l ... de produits chimiques inflammables ou explosifs interdiction de stationnement
 Conduite à tenir en médecine de premier recours devant un enfant
Conduite à tenir en médecine de premier recours devant un enfant
• Utilisation de moyens mnémotechniques ;. • Choisir des activités d'apprentissage Appels (numéroter par ordre de priorité) : ❑ Parents ou tuteur Tél ...
 Pré-rentrée PASS 2021/2022 Louise GILLET & Adrien RAULT
Pré-rentrée PASS 2021/2022 Louise GILLET & Adrien RAULT
Moyen mnémotechnique : Flore Oblige Claude à de NomBreuses Idioties Les autres fonctions avec comme ordre de priorité : R < X < N < S. < O c. les ...
 SDIS 03
SDIS 03
22 mai 2019 ... ordre initial et les ordres de conduite suivants. Ils sont formalisés grâce au moyen mnémotechnique suivant : Signification. Ordre initial.
 GDO Exercice du commandement
GDO Exercice du commandement
ordre initial et les ordres de conduite suivants. Ils sont formalisés grâce au moyen mnémotechnique suivant : Signification. Ordre initial / de conduite. S ...
 Présentation PowerPoint
Présentation PowerPoint
conscience de l'enfant en fonction de l'âge du développement. L'utilisation de l'acronyme AVPU est un moyen mnémotechnique pour déterminer le niveau de
 LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
LES COMPOSÉS FONCTIONNELS 1- Définitions 1-1- Fonction
On appelle groupement fonctionnel ou fonction chimique l'atome ou le groupe d'atomes Le classement des groupements fonctionnels par ordre de priorité ...
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
n : nombre quantique principale n>0 il détermine la distance moyenne entre Tableau 2 : Nomenclature des fonctions classées par ordre de priorité.
 BIOCHIMIE
BIOCHIMIE
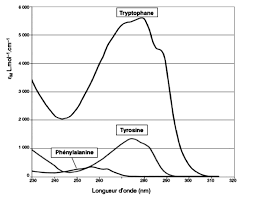
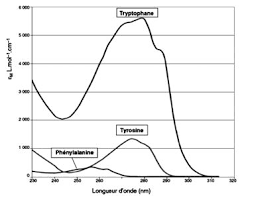
1. L'ordre de priorité des principales fonctions chimiques. Fonction Un moyen mnémotechnique pour les retenir : Le Très Lyrique Tristan.
 Biochimie en 24 fiches
Biochimie en 24 fiches
I L'ordre de priorité des principales fonctions chimiques. FICHE 1. Fonction Un moyen mnémotechnique pour les retenir : Le Très Lyrique Tristan.
 polycopie C
polycopie C
(Autre moyen mnémotechnique : en regardant la molécule selon l'axe de la chaîne qui donne son nom à la molécule est choisi selon un ordre de priorité :.
 Urgences
Urgences
Trier les urgences en fonction de la gravité produits chimiques. ... de 5 ans de l'ordre de 1 à 15 % (moyenne de 10 %) liée probablement à la souplesse ...
 Nomenclature des carbo- et hétérocycles
Nomenclature des carbo- et hétérocycles
priorité des radicaux ? fonction de la taille (nombre de C de chaque radical) Si 2 séquences ? même total ? ordre alphabétique des substituants ...
 SDIS 03
SDIS 03
22?/05?/2019 d'appréciation intégré à la fonction de commandement et inhérent à la ... Ils sont formalisés grâce au moyen mnémotechnique suivant :.
 Pr. Séraphin
Pr. Séraphin
Moyen mnémotechnique : Il faut donc déterminer l'ordre de priorité des différents substituants. La fonction des propriétés chimiques identiques.
 LES GLUCIDES
LES GLUCIDES
Les oses qui possèdent une fonction aldéhyde sont appelés des aldoses et ceux numérotés selon un ordre de priorité (du numéro atomique le plus élevé :.
 Ordre de priorité des fonctions chimiques - JeRetiens
Ordre de priorité des fonctions chimiques - JeRetiens
26 jui 2016 · L'ordre de priorité des fonctions est une convention définie par l'IUPAC Malheureusement la seule façon de ne pas se tromper est
 [PDF] Pr Séraphin - 2ATP
[PDF] Pr Séraphin - 2ATP
Moyen mnémotechnique : Il faut donc déterminer l'ordre de priorité des différents substituants La préséance va à l'atome avec le plus fort numéro atomique
 [PDF] Chimie Organique - univ-ustodz
[PDF] Chimie Organique - univ-ustodz
Fonction chimique ou groupement fonctionnel I 3 Le classement des groupements fonctionnels par ordre de priorité décroissante
 Moyen mnémotechnique - Innovations Pédagogiques
Moyen mnémotechnique - Innovations Pédagogiques
En chimie organique en nomenclature pour l'ordre de priorité des fonctions c'est "L' acide et (ether) l'amidon (amide) neutralisent
 Nomenclature (chimie)/Fonctions - Wikiversité
Nomenclature (chimie)/Fonctions - Wikiversité
20 mai 2021 · Tous les composés organiques pour pouvoir être identifiés rapidement sont nommés suivant la fonction à laquelle ils appartiennent
 [PDF] Chapitre 2 - Chimie organique
[PDF] Chapitre 2 - Chimie organique
(Autre moyen mnémotechnique : en regardant la molécule selon l'axe de la chaîne qui donne son nom à la molécule est choisi selon un ordre de priorité :
 [PDF] Chapitre 3: Nomenclature en chimie organique
[PDF] Chapitre 3: Nomenclature en chimie organique
De groupes fonctionnels caractéristiques des fonctions chimiques (alcool acide dans ce tableau sont rangés dans l'ordre décroissant de priorité
 [PDF] Rappels de chimie théorique
[PDF] Rappels de chimie théorique
moyenne de l'électron au noyau ; celle-ci augmente avec n On parle alors de fonctions diffuses (par opposition aux fonctions contractées)
 [PDF] Un moyen mnémotechnique simple pour vérifier les notations
[PDF] Un moyen mnémotechnique simple pour vérifier les notations
– Le dividende (a) est le nombre total d'électrons de valence de tous les atomes A et X du système chimique étudié – Le diviseur (b) est égal à 8 – Le
Comment retenir les fonctions chimiques ?
Phrase mnémotechnique pour retrouver l' ordre de priorité : Ah si Carbo (acide carboxylique) était(ester) amie(amide) notre(nitrile) alors(aldéhyde) ces(cétone) alcools(alcool) tiendraient(thiol) nos amis(amine).20 mai 2021Comment savoir si une fonction est prioritaire ?
- La fonction prioritaire est désignée par un suffixe et on numérote la chaîne principale de façon à attribuer à cette fonction l'indice le plus petit possible. - Les autres fonctions sont désignées par des préfixes.Comment nommer les fonctions chimiques ?
La nomenclature suit les mêmes règles. Les fonctions sont caractérisées par un suf- fixe (éventuellement précédé d'un numéro de position). Les hydrocarbures possédant une (ou plus) double liaison C = C appartiennent aux alcènes ; ceux possédant une triple liaison C ? C appartiennent aux alcynes.- Les fonctions chimiques sont classées selon leur valence. Une fonction est dite principale lorsqu'elle a la valence la plus élevée.
UNIVERSITE CADI AYYAD
Faculté Polydisciplinaire
SafiDépartement de Chimie
COURS DE CHIMIE ORGANIQUE
Semestre 2
SVIPréparé par :
Moulay Rachid LAAMARI
2016-2017
SOMMAIRE
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUEII-1- Orbitales atomiques (OA)
II-2- Valence du carbone
II-3- Hybridation du carbone
II-4- Liaisons covalentes
II-5- Comparaison entre sp3, sp2 et sp du carbone
II-6-Chapitre II : ECRITURE DES FORMULES ET FONCTIONS
EN CHIMIE ORGANIQUE
I/ ECRITURE DES FORMULES
I-1- Formule brute
I-2- Formule développée plane (FDP)
I-3- Formule semi-développée (FSD)
I-4- Formule simplifiée (FS)
II/ DIVERSES FONCTIONS ET GROUPEMENT FONCTIONNELS
II-1-II-2- Principales fonctions organiques
II-2-4- Fonctions tétravalentes
Chapitre III : PRINCIPALES REGLES DE NOMENCLATURE
DES COMPOSES ORGANIQUES
I/ NOMENCLATURE DES ALCANES ACYCLIQUES
I-1- Alcanes à chaîne linéaire
I-2- Alcanes à chaîne ramifiée
II/ NOMENCLATURE DES HYDROCARBURES ACYCLIQUES INSATURESII-1- Les alcènes : CnH2n
II-2- les alcynes : CnH2n-2
III/ NOMENCLATURE DES DERIVES HALOGENES (R-X)
IV/ NOMENCLATURE DES COMPOSES CYCLIQUES
IV-1- Les homocycles
IV-2- Les cycles aromatiques
IV-3- Les hétérocycles
V/ NOMENCLATURE DES FONCTIONS SIMPLES ET MULTIPLESV-1- Les alcools : R-OH
V-2- Les éthers (oxydes) : R-O-
V-3- Les amines
V-4- Les cétones : R-COR' avec R et R'
HV-5- Les aldéhydes : R-CHO
V-6- Acides carboxyliques : R-COOH
V-7- Dérivées des acides carboxyliques
VI/ NOMENCLATURE DES COMPOSES A PLUSIEURS FONCTIONSChapitre IV : ISOMERIE PLANE
I/ ISOMERIE DE CONSTITUTION
I-1-I-2- Isomérie de position
I-3- Isomérie de fonction
II/ ISOMERIE TAUTOMERIE
II-1-Tautomérie des aldéhydes et des cétonesII-2-Tautomérie des amides
II-3-Tautomérie des imines
Chapitre V : STEREOCHIMIE ISOMERIE CONFORMATIONNELLEI/ REPRESENTATION DES MOLECULES ACYCLIQUES
I-1- Molécule contenant un carbone sp3
I-2- Molécule contenant deux carbones sp3
I-3- Analyse conformationnelle des chaînes saturées aliphatiques II/ REPRESENTATON DES MOLECULES CYCLIQUES SATUREESII-1- Cyclopropane
II-2- Cyclobutane
II-3- cyclopentane
II-4- Cyclohexane
Chapitre VI : ISOMERIE OPTIQUE
I/ CHIRALITE
II/ MOLECULES CONTENANT UN SEUL CARBONE ASYMETRIQUEIII/ CONFIGURATIONS ABSOLUES R ET S
III-1- Règles de Cahn-Ingold et Prelog
III-2- Examen de la molécule
III-3- Projection de Fischer
IV/ Composés CONTENANT deux carbones asymétriques IV-1- Molécules possédant deux *C différents IV-2- Molécules possédant deux *C identiques CHAPITRE VII : ISOMERIE GEOMETRIQUE CISTRANS OU Z-EI/ ISOMERIE GEOMETRIQUE POUR LES ALCENES
I-1- ISOMERIE CIS-TRANS
I-2- ISOMERIE Z-E
II/ ISOMERIE GEOMETRIQUE CIS-TRANS POUR LES CYCLOALCANESII-1-DIMETHYLCYCLOBUTANE
II-2- DIMETHYLCYCLOHEXANE
CHAPITRE VIII : EFFETS ELECTRONIQUES
I/ EFFET INDUCTIF
I-1- E-I)
I-2-I-3- CONSEQUENCES DES EFFETS INDUCTIFS
II/ CONJUGAISON ET AROMATICITE
II-1- CONJUGAISON
II-2- AROMATICITE
III/ EFET MESOMERE
III-1- EFFET MESOMERE ATTRACTEUR (-M)
III-2- EFFET MESOMERE DONNEUR (+M)
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
Les composés organiques sont des composés qui contiennent essentiellement du carbone sauf le monoxyde de carbone (CO), le dioxyde de carbone (CO2), les carbonates (K2CO3, Na2CO3, NaHCO3), les cyanures (KCN, NaCN), le dissulfure (CS2) et les carbures (CaC2) qui sont des composés inorganiques. Les composés organiques sont formés de liaisons covalentes. Ils sont rarement soluble dans l'eau et se décomposent facilement par la chaleur.Leurs densités sont voisines de l'unité.
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUE Pour décrire la nature des liaisons C-C et/ou C-H, on utilise la notion dépendent des nombres quantiques n, l et m (voir cours de chimie généraleI S1).
n : nombre quantique principale n>0, il détermine la distance moyenne entre l : 0< l < n, nombre quantique secondaire ou azimutal, il définit la sous couche, l = 0 orbitale s l = 1 orbitale p, etc. m : -l < m < l, nombre quantique magnétique, il définit la case quantique, à un niveau l correspond (2l + 1) valeurs (cases) de m.II-1- Orbitales atomiques (OA)
y a une grande proba organique sont s et p.II-1-1-
de la classification périodique des éléments. Il a sa couche externe à moitié remplie. Pour compléter sa couche périphérique, il pourra se lier à lui mêmeH He
Li Be B 6C N O F Ne
Na Mg Al Si P S Cl Ar
Le numéro atomique du carbone est 6 par conséquent sa structureélectroniques est 1s22s22p2.
II-1-2- Formes des OA du carbone
O. s y z x -1, 0, 1) correspond à 3 orbitales px, py et pz. Ces dernières ont chacune deux lobes et leurs axes de symétrie respectifs Ox, Oy et Oz sont perpendiculaires entre eux.Remarque: Le noyau se tr
II-2- Valence du carbone
r avec La configuration électronique externe du carbone à l'état fondamental est 2s22p2.2p22s2
Cette valence (VC = 2) permet la formation des molécules instables car la couche périphérique du carbone est incomplète (6e-, il faut 8e-).Exemple : CCl2
Octet (8e- sur la couche externe), le carbone
doit faire 4 liaisons donc il doit avoir 4 électrons célibataires sur sa couche externe (VC = 4). Pour cela, le carbone doit être dans un état excité c-à-d un électron de la sous couche 2s passe à la sous couche 2p.2p22s22p32s1
Excitation
Etat fondamentalEtat excité
Exemple : CH4 (8e- autour du carbone donc sa couche périphérique est saturée).Cette hypothèse tétravalence du
carbone (VC = 4) mais non pas sa géométrie qui se traduit parII-3- Hybridation du carbone
Une combinaison linéaire des OA conduit aux orbitales dites orbitales hydrides (OH) spatialement et énergétiquement équivalentes entre elles.2px 2py 2pz2s1
Etat excité
Par des différentes combinaisons linéaires des OA du carbone, on peut avoir3, sp2 et sp.
II-3-1- Hybridation sp3
re que les quatre liaisons C-H du méthane (CH4) sont identiques et indiscernables. Chacune forme avec les trois autres le même 2py et 2pz) du carbone subissent une combinaison linéaire pour donner 4 orbitales hybrides (OH). Cette combinaison met en jeu une orbitale s et 3 orbitales p pour conduire à quatre orbitales hybrides sp3 équivalentes.1 s+3 p4 sp3(4 OH)
px y z x pypz109°28'
sp3sp3 sp3 sp3 s Le carbone hybridé sp3 possède une géométrie tétraédrique.Remarque
II-3-2- Hybridation sp2
La combinaison linéaire met en jeu une orbitale s et deux orbitales p pour conduire à trois orbitales hybrides sp2 équivalentes dont leurs axes de inchangée et son axe de symétrie est perpendiculaire au plan des axes des orbitales hybrides sp2.1 s+2 p3 sp2(3 OH)
z pz120°
sp2 sp2 sp2 Le carbone hybridé sp2 possède une géométrie triangulaire.II-3-3- Hybridation sp
Elle met en jeu une orbitale s et une orbitale p pour conduire à deux orbitales hybrides sp dont les axes forment un angle de 180° et sont confondus. Les deux autres orbitales atomiques p (py et pz) restent naturelles et sont perpendiculaires aux deux orbitales hybrides sp.1 s+1 p2 sp(2 OH)
py pz spsp Le carbone hybridé sp possède une géométrie linéaire.II-4- Liaisons covalentes
Le carbone, situé sur la colonne centrale de la classification périodique, peut se lier à peut se lier à lui même, aux éléments de la mê des liaisons covalentes et . Une liaison covalente vient du recouvrement axial de deux orbitales hybrides (sp, sp2, sp3) dans le cas de la liaison C- et une orbitale s dans le cas de la liaison C-H. Une liaison covalente vient du recouvrement latéralII-4-1- Recouvrement axial
par rapport à ce même axe. Il aboutit à la formation de liaison covalente .Exemple 1 : méthane CH4 (4)
sp3sp3 sp3 sp3 s Csp3H HH H109°28'
La géométrie de CH4est tétraédrique
C H H H H +4H Conclusion : Un atome de carbone entouré de 4 liaisons est hybridé en sp3.Exemple 2 : éthane CH3-CH3
Chaque carbone est entouré de 3 liaisons (C-H) et une liaison (C-C). HH HH HHRecouvrement axial
Csp3Csp3
6H Le recouvrement axial C-C ié par rotation de la molécule autour de la liaison C-C; il y a la libre rotation autour de la liaisonII-4-2- Recouvrement latéral
Exemple 1 : éthylène CH2=CH2
pz' sp2sp2 sp2 pz sp2 sp2 sp2Recouvrement axial
Recouvrement latéral
H H H H 4H pour former une orbitale moléculaire (OM) correspondant à une liaison de type lèles. la liaison bloque la rotation autour de la liaison C-C. Conclusion : Un carbone hybridé sp2 est entouré de 3 liaisons et une liaison . Le carbone sp2 se trouve dans les molécules insaturés (doubles liaisons :C=O, C=S, C=N, C=C).
Exemple 2 : acétylène HCCH
conduire respectivement à deux liaisons perpendiculaires entre elles. Les trois liaisons Conclusion Un carbone hybridé sp est entouré de 2 et 2 . Il se trouve dans les molécules avec triple liaison et des molécules du genre C=C=C, C=C=O,C=C=N-, C=C=S.
II-5- Comparaison entre sp3, sp2 et sp du carbone
L'orbitale hybride sp3 est constituée de 25% de caractère s et de 75% de caractère p. Lorsque le caractère s de l'OH augmente on constate : - Aspect énergétiqueOA ns est plus faible que
- Aspect géométrique180°.
II-6-Le tableau ci-dessous rassemble les différe
sp3 sp2 spC 4 3 + 1 2 + 2
N 3 + 1 doublet libre 2 + 1 + 1 doublet libre 1 + 2 + 1 doublet libreO 2 + 2 doublets
libres1 + 1 + 2 doublets
libresChapitre II : ECRITURE DES FORMULES ET FONCTIONS
EN CHIMIE ORGANIQUE
Pour écrire une molécule organique, il faut respecter la valence des atomes qui constitue cette molécule. VC = 4, VN = 3, VO = 2, VH = V(F, Cl, Br, I) = 1.I/ ECRITURE DES FORMULES
En c - Formule brute, - Formule développée plane, - Formule semi-développée, - Formule simplifiée.I-1- Formule brute
que contient la molécule, elle est de la forme CxHyOzNtXw avec X = Cl, Br, I, F.Exemple :
- CH4N2O, elle contient (1C, 4H, 2N, 1O). - C3H6O, elle contient 3C, 6H et 1O. ne indication sur la façon dont les atomes sont disposés entre eux. En fait, il rapport aux autres.I-2- Formule développée plane (FDP)
Tous les atomes et toutes les liaisons sont représentés sur la surface plane d'une feuille. HCC H C H Cl H H H Cl HCN H C H H H H HHCO H H H ces atomes dans une molécule, mais non pas leur orientation réelle dansI-3- Formule semi-développée (FSD)
Dans cette écriture, on élimine les liaisons C-H, N-H et O-H.Exemples: CH3-CH3, CH3CH2-CH2-NH2, CH3-CH2-OH
Si en plus, on élimine les liaisons C-C, C-N, C- deviennent des formules compactes. Exemples: CH3CH2CH2CH3, CH3CH2OH, CH3NHOHI-4- Formule simplifiée (FS)
Du point de vue pratique et de simplification des écritures, on utilise pour les chaînes carbonées et les cycles des formules simplifiées. Dans ces formules, on ne garde que le squelette carboné sans nt porter. Par contre, on représente les hétéroatomes (N, O, S), les hydrogènes liés aux hétéroatomes et les halogènes (Cl, Br, I, F). Chaque extrémité et intersection du squelette correspondent à un carbone. Dans ces représentations, on respecte les angles de valence.CH3CH2CHCH2CH2C
O OHOH OCH2CHCHCHCH2C
NH2 CH ClCl NH2 H2CH2CCH2
CH2 CH2 H2C CH3 FSDFSExemple :
H2C NCH2 N CH H2C CH2CH3H3CNN
O CH3 CH3 OCH3 FSDFSII/ DIVERSES FONCTIONS ET GROUPEMENT FONCTIONNELS
Dans un composé organique saturé (CnH2n+2 hydrogène par un groupement fonctionnel comportant un ou plusieurs hétéroatomes définit une fonction.Exemple :
RHROHH3CCH3H3CCH2OH
Fonction alcool
carbone fonctionnel remplacer H par OH remplacer H par OHII-1- Valen
mplacés par un ou plusieurs hétéroatomes.II-2- Principales fonctions organiques
II-2-1- fonctions monovalentes
COH Thiol CN Amine COEther-Oxyde
CCSHAlcool
II-2-2- Fonctions bivalentes
C O H RAldéhydeCétone
CR'R O NH R1 R2 N R1 R2 NH2N R1 R2quotesdbs_dbs41.pdfusesText_41[PDF] comment reconnaitre un adjectif dans une phrase
[PDF] comment reconnaitre un nom commun
[PDF] trouver les noms dans un texte ce1
[PDF] comment reconnaitre un nom dans une phrase
[PDF] reconnaitre le nom ce1
[PDF] trouver le nom dans une phrase ce1
[PDF] comment reconnaitre un déterminant
[PDF] syndic judiciaire cout
[PDF] syndic judiciaire désignation
[PDF] nomination syndic provisoire
[PDF] requête en désignation d'un syndic provisoire
[PDF] désignation administrateur provisoire
[PDF] nomenclature des amines exercices corrigés
[PDF] comment nommer un ester
