Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
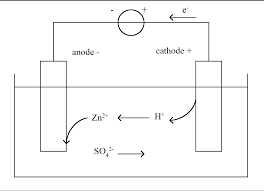
Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) // Fe2+ (0
 Exercices de la séquence n°4 - Piles
Exercices de la séquence n°4 - Piles
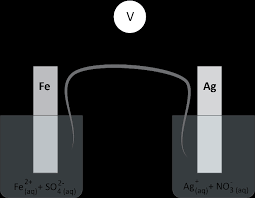
de la pile comme indiqué sur le schéma et obtiennent une tension de + 12 V. Données : Couples Oxydant / Réducteur : Fe2+ (aq) / Fe (s) et Ag+ (aq) / Ag (s).
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Les solutions électrolytiques dans chaque demi-pile ont été respectivement réalisées par dissolution de nitrate d'argent AgNO3(s)
 Chimie et développement durable Partie 1
Chimie et développement durable Partie 1
CORRECTION EXERCICES. Partie 1/ Chimie minérale. Fiche 10 : Les piles électrochimiques. Exercice 1. Pile (1). Cu2+/Cu : E0 = 034 V ; Fe2+/Fe : E0 = - 0
 Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Correction Exercice : L'accumulateur au plomb et le démarrage automobile. 1. A l'extérieur de la pile ce sont les électrons qui sont responsables du passage
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Exercices. ▻ Exercice n°1. On réalise une pile avec les couples Ni2+. (aq)/Ni(s) et Al3+. (aq)/Al(s). La lame de nickel trempe dans 150 mL d'une solution
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Cette épreuve est constituée de trois exercices. Elle comporte 2 pages Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique ...
 Sans titre
Sans titre
Les piles électrochimiques. Profs: Abdelmoula et Zribi. I) On considère la pile (P1) symbolisée par : Pt
 Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques. 1. La pile au citron. 1.1.1. La tension à vide d'une pile se nomme également force électromotrice
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Réactions d'oxydo-réduction et piles électrochimiques. (Exercices de révision). Exercice I Corrigé. Exercice I. On considère la pile symbolisée par:.
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. Thème : Piles et électrolyses Exercice n°1 ... 5) Dans une pile l'anode s'enrichit en électrons
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 2 (7 points). Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique en énergie électrique. Différents types de métaux.
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Piles électrochimiques. Exercice n°1. On réalise une pile cadmium-argent contenant les couples oxydant/réducteur suivants : Ag+. (aq)/Ag(s).
 Table des matières
Table des matières
Exercices corrigés ……………………………………………………………………………102. Chapitre 7 Les piles électrochimiques…………………………………………………………111. Synthèse de cours …
 Liaisons chimiques (65 points) Deuxième exercice
Liaisons chimiques (65 points) Deuxième exercice
Deuxième exercice : Fonctionnement d'une pile électrochimique (65 points) Corrigé. Barème. Premier exercice : Liaisons chimiques (6
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 demi-piles par un pont électrochimique. 2.1. Fém de la pile : E = E°
 3 2 3 2 Cu A Cu A + +
3 2 3 2 Cu A Cu A + +
Série d'exercices – Piles électrochimiques. Exercice n°1/. La pile de la figure ci-contre représente la pile Aluminium – Cuivre le volume de chaque
 TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
Qri < K. Le système évolue spontanément dans le sens direct de l'équation. 3. Cd donne des électrons à Ag+. Les électrons circulent donc de l'électrode de
 ??????? ???? ??? ???? ??????? ???????? ??????? ??????
??????? ???? ??? ???? ??????? ???????? ??????? ??????
Deuxième exercice (7 points). Anode ou cathode ! Pour savoir si un métal est l'anode ou la cathode d'une pile électrochimique on compare sa tendance à.
En partenariat avec :
Fiche téléchargée sur www.studyrama.com
LE TALENT C'EST D'AVOIR ENVIE
CHIMIESérie SNº : 37004
Fiche Corrigés
1) 2) Ni (s) = Ni2+(aq)
+ 2 e (× 3) Al3+(aq)
+ 3 e = Al (s) (× 2) __________________________ 3 Ni (s) + 2 Al3+(aq)
= 3 Ni2+(aq)
+ 2 Al (s) 3)Il faut calculer [Ni2+]i et [Al3+]i
A.N. :
12 3 - i2Lmol 0 18,610 115016,0) 432,1(58,70 0,2 ][Ni
VMm 2 Vn 2Vn ][Al
3423423423
)(SOlA )(SOlA )(SOlA lA i3A.N. :
12 3 - i3 Lmol 0 17,790 115016,0)) 432,1(327,02 (0 0,22 ][Al 2 i33 i2 ir, ][Al][Ni QA.N. : 1,11)0 19 7,7()0 11 6,8( Q
2232ir, Q donc la réaction avance spontanément dans le sens indirect de l'équation. 4)
On en déduit qu'il y a oxydation de l'aluminium et réduction des ions nickel. Ainsi la lame d'aluminium est l'anode et la lame de
nickel est la cathode. 2En partenariat avec :
Fiche téléchargée sur www.studyrama.com
LE TALENT C'EST D'AVOIR ENVIE
CHIMIESérie SNº : 37004
Fiche Corrigés
5) Dans une pile, l'anode s'enrichit en électrons, ici par la réaction Al (s) = Al3+(aq)
+ 3 e , donc il s'agit de la borne -. La cathode s'appauvrit en électrons, ici par la réaction Ni2+(aq)
+ 2 e = Ni (s) , donc il s'agit de la borne +. 6)Hors de la pile, le courant électrique circule de la borne + vers la borne -, donc de la demi pile au nickel vers la demi pile à
l'aluminium. Les électrons circulent en sens inverse : de la demi pile à l'aluminium vers la demi pile au nickel. Dans la pile, les cations
circulent de la demi pile à l'aluminium vers la demi pile au nickel et les anions en sens inverse.
1)Les électrons circulent dans le sens contraire du courant électrique, donc de la demi pile au cuivre vers la demi pile à l'or. Dans
la pile les anions vont de la demi pile à l'or vers la demi pile au cuivre et les cations dans l'autre sens.
2)Les électrons arrivent sur l'électrode d'or, ils y sont donc transformés, il y a réduction :
Au3+(aq)
+ 3 e = Au (s) Les électrons sont libérés sur l'électrode de cuivre, donc il y a oxydation : Cu (s) = Cu2+(aq)
+ 2 e L'équation de fonctionnement de la pile dans le sens direct est : 3 Cu (s) + 2 Au3+(aq)
= 3 Cu2+(aq)
+ 2 Au (s) L'anode est l'électrode de cuivre et la cathode est l'électrode d'or. 3) 2 i33 i2 ir, ][Au][Cu QA.N. :
2- 2131ir,
0 18,9)0 10,3()0 10,2( Q
Q par conséquent la réaction de fonctionnement avance bien dans le sens direct. 1)Les couples sont Zn
2+ /Zn et MnO 2 /MnO(OH). A l'anode Zn = Zn 2+ + 2e et à la cathode MnO 2 + H 3 O + e = MnO(OH) + H 2 O.Pour le fonctionnement de la pile :
Zn + 2 MnO
2 + 2 H 3 O = Zn 2+ + 2 MnO(OH) avec le nombre stoechiométrique d'échange d'électrons z = 2. 2) Q max = z · x max· F donc
FzQ x
max maxOr dans la situation considquotesdbs_dbs1.pdfusesText_1
[PDF] exercices corrigés sur les series doubles en statistique
[PDF] exercices corrigés sur les vecteurs 2nde
[PDF] exercices corrigés sur sn1 sn2 e1 et e2
[PDF] exercices corrigés sur travail et puissance pdf
[PDF] exercices corrigés svt 3ème pdf
[PDF] exercices corrigés svt première s
[PDF] exercices corrigés svt seconde biodiversité
[PDF] exercices corrigés synthese des proteines
[PDF] exercices corrigés systeme d'information de gestion
[PDF] exercices corrigés système d'information pdf
[PDF] exercices corrigés tableau financement
[PDF] exercices corrigés thermodynamique gaz parfait
[PDF] exercices corrigés titrage acide base
[PDF] exercices corrigés travaux dinventaire pdf