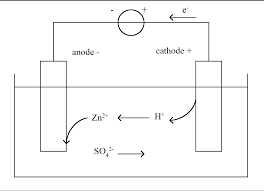
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. 4) Les ions oxonium proviennent des ions ammonium acide du couple NH4. +/NH3. ▻ Exercice n°4. 1) Dans le cas de la solution de bromure de
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) // Fe2+ (0
 Exercices de la séquence n°4 - Piles
Exercices de la séquence n°4 - Piles
de la pile comme indiqué sur le schéma et obtiennent une tension de + 12 V. Données : Couples Oxydant / Réducteur : Fe2+ (aq) / Fe (s) et Ag+ (aq) / Ag (s).
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Les solutions électrolytiques dans chaque demi-pile ont été respectivement réalisées par dissolution de nitrate d'argent AgNO3(s)
 Chimie et développement durable Partie 1
Chimie et développement durable Partie 1
CORRECTION EXERCICES. Partie 1/ Chimie minérale. Fiche 10 : Les piles électrochimiques. Exercice 1. Pile (1). Cu2+/Cu : E0 = 034 V ; Fe2+/Fe : E0 = - 0
 Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Correction Exercice : L'accumulateur au plomb et le démarrage automobile. 1. A l'extérieur de la pile ce sont les électrons qui sont responsables du passage
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Exercices. ▻ Exercice n°1. On réalise une pile avec les couples Ni2+. (aq)/Ni(s) et Al3+. (aq)/Al(s). La lame de nickel trempe dans 150 mL d'une solution
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Cette épreuve est constituée de trois exercices. Elle comporte 2 pages Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique ...
 Sans titre
Sans titre
Les piles électrochimiques. Profs: Abdelmoula et Zribi. I) On considère la pile (P1) symbolisée par : Pt
 Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques. 1. La pile au citron. 1.1.1. La tension à vide d'une pile se nomme également force électromotrice
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Réactions d'oxydo-réduction et piles électrochimiques. (Exercices de révision). Exercice I Corrigé. Exercice I. On considère la pile symbolisée par:.
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. Thème : Piles et électrolyses Exercice n°1 ... 5) Dans une pile l'anode s'enrichit en électrons
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 2 (7 points). Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique en énergie électrique. Différents types de métaux.
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Piles électrochimiques. Exercice n°1. On réalise une pile cadmium-argent contenant les couples oxydant/réducteur suivants : Ag+. (aq)/Ag(s).
 Table des matières
Table des matières
Exercices corrigés ……………………………………………………………………………102. Chapitre 7 Les piles électrochimiques…………………………………………………………111. Synthèse de cours …
 Liaisons chimiques (65 points) Deuxième exercice
Liaisons chimiques (65 points) Deuxième exercice
Deuxième exercice : Fonctionnement d'une pile électrochimique (65 points) Corrigé. Barème. Premier exercice : Liaisons chimiques (6
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 demi-piles par un pont électrochimique. 2.1. Fém de la pile : E = E°
 3 2 3 2 Cu A Cu A + +
3 2 3 2 Cu A Cu A + +
Série d'exercices – Piles électrochimiques. Exercice n°1/. La pile de la figure ci-contre représente la pile Aluminium – Cuivre le volume de chaque
 TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
Qri < K. Le système évolue spontanément dans le sens direct de l'équation. 3. Cd donne des électrons à Ag+. Les électrons circulent donc de l'électrode de
 ??????? ???? ??? ???? ??????? ???????? ??????? ??????
??????? ???? ??? ???? ??????? ???????? ??????? ??????
Deuxième exercice (7 points). Anode ou cathode ! Pour savoir si un métal est l'anode ou la cathode d'une pile électrochimique on compare sa tendance à.
TS2 Piles électrochimiques
Exercice n°1
On réalise une pile cadmium-argent contenant les couples oxydant/réducteur suivants : Ag+(aq)/Ag(s)
et Cd2+(aq)/Cd(s).Les solutions électrolytiques dans chaque demi-pile ont été respectivement réalisées par
dissolution de nitrate d'argent, AgNO3(s), et de nitrate de cadmium, Cd(NO3)2(s), dans l'eau
distillée. Chaque solution a un volume V = 100 mL. Pour chacune des solutions, la concentration apportée en soluté est : C = 0,200 mol.L-1. L'électrode métallique qui est consommée est en large excès.On donne la constante d'équilibre associée à l'équation de cette réaction : K = 5×1040 à 25 °C
pour :2 Ag+(aq) + Cd(s) = 2 Ag(s) + Cd2+(aq).
1. Exprimer et calculer le quotient de réaction à l'état initial.
Qr,i = [] Cd2+i
[] Ag+2i ї Qr,i = CC² = 1
C[] ї Qr,i = 1
0,200= 5,00
2. Quel est le sens d'évolution spontanée de ce système ?
3. En déduire le sens du
mouvement des porteurs de charges.4. Quelle est la borne positive ?
Cd(s) = Cd2+(aq) + 2e-.
L'Ġlectrode de cadmium fournit
négative de la pile. La borne positiǀe est donc l'Ġlectrode5. Donner l'écriture
conventionnelle de cette pile.Cd(s)|Cd2+(aq)||Ag+(aq)|Ag(s)
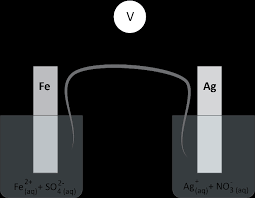
Exercice n°2.
On réalise la pile suivante.
La solution aqueuse de chlorure
d'argent a un volume de 50,0 mL et [Ag+(aq)] = 0,20 mol.L-1 ; la solution de chlorure de fer (II) a un volume de50,0 mL et [Fe2+(aq)] = 0,10 mol.L-1. Le
pont salin est constitué d'une solution aqueuse gélifiée de nitrate de potassium, K+(aq) + NO3-(aq).Le voltmètre indique une tension
négative.Lame de
cadmium LameSolution de nitrate de cadmium
I e- IK+ NO3- + -
e- ICl- NO3-
Fe2+ Ag+
TS2 Piles électrochimiques
1. Donner l'écriture conventionnelle de cette pile.
Le voltmètre mesure UV/COM = UFe/Ag = VFe - VAg< 0 donc VFe < VAg. L'Ġlectrode de fer constitue
la borne négative de la pile.Fe(s)|Fe2+(aq)||Ag+(aq)|Ag(s)
2. a) Écrire les équations des réactions aux électrodes. Les électrons sortent par la borne négative. Le métal fer est donc oxydé :Fe(s) = Fe2+(aq) + 2e-
L'ion argent est réduit
Ag+(aq) + e- = Ag(s)
b) En déduire l'équation d'oxydoréduction de la pile.Fe(s) + 2Ag+(aq) = 2Ag(s) + Fe2+(aq)
3. Indiquer le mouvement des porteurs de charges.(Voir schéma de la pile)
Préciser le (ou les) rôle(s) du pont salin.
Il ferme le circuit électrique et permet le passage du courant.Il assure l'ĠlectroneutralitĠ des solutions
4. a) Lorsque la pile débite, comment varie la concentration en ions argent ? Ag+ est un réactif, il est consommé donc [Ag+] diminue. b) Comment varie la masse de l'électrode de fer ? Le métal Fer est aussi un réactif, il est consommĠ donc la masse de l'Ġlectrode de fer diminue égalementExercice n°3.
On considère une pile cuivre-argent réalisée à partir de deux lames de masse m = 10,00 g. Les solutions
aqueuses de nitrate d'argent et de sulfate de cuivre utilisées sont des solutions de concentration
apportée C = 0,100 mol.L-1. Leur volume individuel est V = 50,0 mL.Données :
1. Faire le schéma de cette pile.
2. Un voltmètre placé aux bornes de cette pile indique : UCu/Ag = - 0,46 V.
a) Quel est le pôle + de cette pile ? Schématiser le voltmètre avec sa borne V et sa borne com.
UV/COM = UCu/Ag = VCu - VAg< 0 donc VCu < VAg. L'Ġlectrode de cuivre constitue la borneb) Indiquer sur le schéma, le sens du courant et celui de déplacement des électrons dans les fils de
connexion. c) Schématiser en une ligne cette pile par une écriture symbolique.Cu(s)|Cu2+(aq)||Ag+(aq)|Ag(s)
TS2 Piles électrochimiques
3. a) Déduire du 2 les demi-équationsélectroniques des réactions qui
modélisent les transformations ayant lieu aux interfaces métal-solution.Les électrons sortent par la borne
négative. Le métal cuivre est donc oxydé :Cu(s) = Cu2+(aq) + 2e-
L'ion argent est réduit
Ag+(aq) + e- = Ag(s)
b) En déduire l'équation globale de réaction.Cu(s) + 2Ag+(aq) = 2Ag(s) + Cu2+(aq)
4. Compléter le tableau d'évolution des espèces chimiques de cette pile en calculant toutes les
quantités de matière initiales et finales si la réaction était totale (on précisera le réactif limitant).
Pour les lignes intermédiaires, on utilisera x et xéq.Avancement 2 Ag+(aq) + Cu(s) = 2 Ag(s) + Cu2+(aq) ne-
échangée
E.I. 0 n0(Ag+) = CV n0(Cu) = m
M(Cu) n0(Ag) = m
M(Ag) n0(Cu2+) = CV 0
En cours x n(Ag+) = CV - 2x n(Cu) = n0(Cu) - x n(Ag) = n0(Ag) + 2x n(Cu2+) = CV+ x 2xE.F. xéq néq(Ag+) = CV - 2xéq néq(Cu) = n0(Cu) - xéq néq(Ag) = n0(Ag) + 2xéq néq(Cu2+) = CV+ xéq 2xéq
E.F. si
totale xmax xmax nr(Ag+) = CV - 2xmax nr(Ag+) = 0 nr(Cu) = n0(Cu) - xmax nr(Cu) = 156 mmol nmax(Ag) = n0(Ag) + 2xmax nmax(Ag) = 97,68 mmol nmax(Cu2+) = CV+ xmax nmax(Cu2+) = 7,50 mmol 2xmax (r = restant) n0(Ag+) = n0(Cu2+) = CV ї n0(Ag+) = n0(Cu2+) = 0,100×50,0×10-3 = 5,00 mmol. n0(Cu) = mM(Cu) ї n0(Cu) = 10,00
63,5= 0,158 mol = 158 mmol
n0(Ag) = mM(Ag)ї n0(Ag) = 10,00
107,9 = 92,68 mmol.
Le réactif limitant est donc l'ion argent et xmax = CV2 = 2,50 mmol.
5. On suppose que cette pile débite un courant continu d'intensité constante I = 100 mA pendant
une durée ȴt = 10 min 30 s.a) Déterminer la quantité d'électricité débitée par la pile en 10 min 30 s. Calculer alors
l'avancement de la réaction. COM V LameLame de
cuivre Solution de nitrate Solution de sulfate de cuivre (II)R I e-
TS2 Piles électrochimiques
Y с Iȴt ; Q = n(e-)×f et n(e-) = 2x
x = n(e-) 2= Q2f= Iȴt
2f ї dž с 0,100×630
2×96500 = 0,326 mmol.
b) Calculer la masse de chaque électrode au bout de 10 min 30 s. x est négligeable devant n0(Cu) et n0(Ag) les masses des électrodes sont quasiment les mêmes. c) Calculer la concentration des solutions en Cu2+(aq) et Ag+(aq) au bout de 10 min 30 s. [Cu2+] = n(Cu2+)V= CV+ x
V ї [Cu2+] = 5,00 + 0,33
50,0= 0,107 mol.L-1
[Ag+] = n(Ag+)V= CV- 2x
V ї [Ag+] = 5,00 - 0,66
50,0= 8,68×10-2 mol.L-1
6. La constante d'équilibre associée à la réaction de la pile est égale à K = 2,15×1015. On suppose
cette transformation totale. a) Établir l'expression de K en fonction de xéq et en déduire la valeur de xéq.K = [Cu2+]éq
[Ag+]²éq =CV+ xéq
V quotesdbs_dbs1.pdfusesText_1[PDF] exercices corrigés sur les series doubles en statistique
[PDF] exercices corrigés sur les vecteurs 2nde
[PDF] exercices corrigés sur sn1 sn2 e1 et e2
[PDF] exercices corrigés sur travail et puissance pdf
[PDF] exercices corrigés svt 3ème pdf
[PDF] exercices corrigés svt première s
[PDF] exercices corrigés svt seconde biodiversité
[PDF] exercices corrigés synthese des proteines
[PDF] exercices corrigés systeme d'information de gestion
[PDF] exercices corrigés système d'information pdf
[PDF] exercices corrigés tableau financement
[PDF] exercices corrigés thermodynamique gaz parfait
[PDF] exercices corrigés titrage acide base
[PDF] exercices corrigés travaux dinventaire pdf
