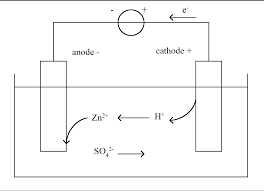
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. 4) Les ions oxonium proviennent des ions ammonium acide du couple NH4. +/NH3. ▻ Exercice n°4. 1) Dans le cas de la solution de bromure de
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) // Fe2+ (0
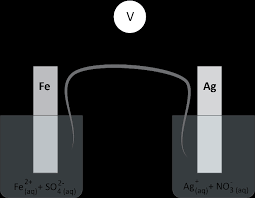 Exercices de la séquence n°4 - Piles
Exercices de la séquence n°4 - Piles
de la pile comme indiqué sur le schéma et obtiennent une tension de + 12 V. Données : Couples Oxydant / Réducteur : Fe2+ (aq) / Fe (s) et Ag+ (aq) / Ag (s).
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Les solutions électrolytiques dans chaque demi-pile ont été respectivement réalisées par dissolution de nitrate d'argent AgNO3(s)
 Chimie et développement durable Partie 1
Chimie et développement durable Partie 1
CORRECTION EXERCICES. Partie 1/ Chimie minérale. Fiche 10 : Les piles électrochimiques. Exercice 1. Pile (1). Cu2+/Cu : E0 = 034 V ; Fe2+/Fe : E0 = - 0
 Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Correction Exercice : L'accumulateur au plomb et le démarrage automobile. 1. A l'extérieur de la pile ce sont les électrons qui sont responsables du passage
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Exercices. ▻ Exercice n°1. On réalise une pile avec les couples Ni2+. (aq)/Ni(s) et Al3+. (aq)/Al(s). La lame de nickel trempe dans 150 mL d'une solution
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Cette épreuve est constituée de trois exercices. Elle comporte 2 pages Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique ...
 Sans titre
Sans titre
Les piles électrochimiques. Profs: Abdelmoula et Zribi. I) On considère la pile (P1) symbolisée par : Pt
 Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques. 1. La pile au citron. 1.1.1. La tension à vide d'une pile se nomme également force électromotrice
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Réactions d'oxydo-réduction et piles électrochimiques. (Exercices de révision). Exercice I Corrigé. Exercice I. On considère la pile symbolisée par:.
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. Thème : Piles et électrolyses Exercice n°1 ... 5) Dans une pile l'anode s'enrichit en électrons
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 2 (7 points). Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique en énergie électrique. Différents types de métaux.
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Piles électrochimiques. Exercice n°1. On réalise une pile cadmium-argent contenant les couples oxydant/réducteur suivants : Ag+. (aq)/Ag(s).
 Table des matières
Table des matières
Exercices corrigés ……………………………………………………………………………102. Chapitre 7 Les piles électrochimiques…………………………………………………………111. Synthèse de cours …
 Liaisons chimiques (65 points) Deuxième exercice
Liaisons chimiques (65 points) Deuxième exercice
Deuxième exercice : Fonctionnement d'une pile électrochimique (65 points) Corrigé. Barème. Premier exercice : Liaisons chimiques (6
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 demi-piles par un pont électrochimique. 2.1. Fém de la pile : E = E°
 3 2 3 2 Cu A Cu A + +
3 2 3 2 Cu A Cu A + +
Série d'exercices – Piles électrochimiques. Exercice n°1/. La pile de la figure ci-contre représente la pile Aluminium – Cuivre le volume de chaque
 TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
Qri < K. Le système évolue spontanément dans le sens direct de l'équation. 3. Cd donne des électrons à Ag+. Les électrons circulent donc de l'électrode de
 ??????? ???? ??? ???? ??????? ???????? ??????? ??????
??????? ???? ??? ???? ??????? ???????? ??????? ??????
Deuxième exercice (7 points). Anode ou cathode ! Pour savoir si un métal est l'anode ou la cathode d'une pile électrochimique on compare sa tendance à.
Professeur Lahsen Madouche
Exercice n°1/
La pile de la figure ci-contre représente la pile Aluminium ± Cuivre , le volume de chaque solution est
V=50mL , la concentration initial en ions aluminium est AǸ3+i=0,010moL/L et la concentration initial des ions Cuivre est Cu2+i=0,10moL/L . les deux solutions ( ) 63,5 /M Cu g moL ( ) 27 /M Al g moLLe Faraday : F = 9,65.104 FBPRǸ-1 .
constante I=-50mA .2-Représenter sur le schéma le sens de chaque porteur de charge au niveau des fils et du pont salin .
fonctionnement de la pile.5- Calculer ¨m(AǸ) et ¨m(Cu) les variations des masses des deux électrodes .
6- Calculer les concentrations finales AǸ3+ et Cu2+ après t=1h de fonctionnement.
Exercice n°2/ (Session Normale 2012 SM)
2Q MYMLP GpŃRXYHUP OM SLOH TXL PHP HQ ȺXYUH OHV ŃRXSOHV GH P\SH HRQ PpPMOC0pPMO j XQH pSRTXH RZ
323 2 3 2s aq aq sCu A Cu A
est : K=10-20 . On réalise la pile Cuivre-Aluminium en reliant deux demi- piles par un de sulfate de cuivre de concentration C0 et de volume V = 50 mL . partiellement immergée dans une solution aqueuse de chlorure On branche entre les pôles de la pile un conducteur Ohmique (D), alors dans le circuit . La courbe de la figure2 représente la variation de la concentration [Cu2+] des ions cuivre existant dans la première demi- pile en fonction du temps .Professeur Lahsen Madouche
constituant la pile .1.2- Donner la représentation conventionnelle de la pile étudiée.
2. 2.1- Exprimer la concentration [Cu2+] à un instant t en fonction de t , C0 , I , V et F.
3- La pile est entièrement usée à une date tc .Déterminer, en fonction de tc , F , I HP 0 OM YMULMPLRQ ¨m
Exercice n°3/ Pile au lithium
Les piles au lithium ont le principal avantage d'avoir une grande durée d'utilisation, elles sont utilisées
dans un certain nombre d'appareils électroniques et répandues dans l'industrie . Une pile au lithium est
Les couples en présence sont SOCl2 /S et Li+ / Li. Au cours du fonctionnement de la pile, Li s'oxyde et SOCl2 se réduit et il se formeS , SO2, Li+ et Cl-.
Données : -le Faraday : F = 96500 C.mol-1 - Masses molaires atomiques en g.mol-1: M(O) = 16,0 ; M(S) = 32,1 ; M(Cl) = 35,5 ; M(Li) = 6,92- Calculer le volume de la pile en dm3 ?
4- Quelles sont les masses minimales des réactifs nécessaires pour produire cette quantité d'électricité ?
Exercice n°4/ Pile à combustible (Session normale 2010 PC )La pile à combustible est formée de deux parties séparées par un électrolyte qui joue le rôle du pont salin
et deux électrodes A et B (figure). La pile au cours de son fonctionnement consomme le dioxygène et du
méthanol liquide . Données : - Constante de Faraday : 1F = 9,65.104 C.mol-1 . - La masse molaire du méthanol : M(CH3OH) = 32 g.mol-1 . - Les deux couples (ox/red) qui interviennent dans cette transformation sont : O2(g)/ H2O(Ǹ) et CO2(g)/ CH3OH(Ǹ.1- Déterminer les coefficients a et b . (0,5 pt)
noms des électrodes A et B . (0,75 pt)ɌP= 1h45min de fonctionnement . Trouver le volume V de métOMQRO ŃRQVRPPp SHQGMQP ɌP B (1 pt)
quotesdbs_dbs1.pdfusesText_1[PDF] exercices corrigés sur les series doubles en statistique
[PDF] exercices corrigés sur les vecteurs 2nde
[PDF] exercices corrigés sur sn1 sn2 e1 et e2
[PDF] exercices corrigés sur travail et puissance pdf
[PDF] exercices corrigés svt 3ème pdf
[PDF] exercices corrigés svt première s
[PDF] exercices corrigés svt seconde biodiversité
[PDF] exercices corrigés synthese des proteines
[PDF] exercices corrigés systeme d'information de gestion
[PDF] exercices corrigés système d'information pdf
[PDF] exercices corrigés tableau financement
[PDF] exercices corrigés thermodynamique gaz parfait
[PDF] exercices corrigés titrage acide base
[PDF] exercices corrigés travaux dinventaire pdf
