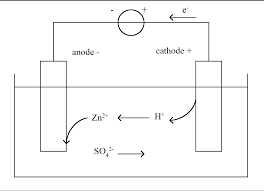
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. 4) Les ions oxonium proviennent des ions ammonium acide du couple NH4. +/NH3. ▻ Exercice n°4. 1) Dans le cas de la solution de bromure de
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) // Fe2+ (0
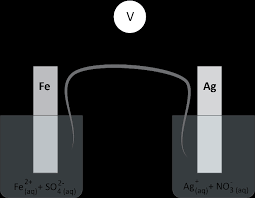 Exercices de la séquence n°4 - Piles
Exercices de la séquence n°4 - Piles
de la pile comme indiqué sur le schéma et obtiennent une tension de + 12 V. Données : Couples Oxydant / Réducteur : Fe2+ (aq) / Fe (s) et Ag+ (aq) / Ag (s).
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Les solutions électrolytiques dans chaque demi-pile ont été respectivement réalisées par dissolution de nitrate d'argent AgNO3(s)
 Chimie et développement durable Partie 1
Chimie et développement durable Partie 1
CORRECTION EXERCICES. Partie 1/ Chimie minérale. Fiche 10 : Les piles électrochimiques. Exercice 1. Pile (1). Cu2+/Cu : E0 = 034 V ; Fe2+/Fe : E0 = - 0
 Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Correction Exercice : L'accumulateur au plomb et le démarrage automobile. 1. A l'extérieur de la pile ce sont les électrons qui sont responsables du passage
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Exercices. ▻ Exercice n°1. On réalise une pile avec les couples Ni2+. (aq)/Ni(s) et Al3+. (aq)/Al(s). La lame de nickel trempe dans 150 mL d'une solution
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Cette épreuve est constituée de trois exercices. Elle comporte 2 pages Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique ...
 Sans titre
Sans titre
Les piles électrochimiques. Profs: Abdelmoula et Zribi. I) On considère la pile (P1) symbolisée par : Pt
 Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques. 1. La pile au citron. 1.1.1. La tension à vide d'une pile se nomme également force électromotrice
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Réactions d'oxydo-réduction et piles électrochimiques. (Exercices de révision). Exercice I Corrigé. Exercice I. On considère la pile symbolisée par:.
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. Thème : Piles et électrolyses Exercice n°1 ... 5) Dans une pile l'anode s'enrichit en électrons
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 2 (7 points). Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique en énergie électrique. Différents types de métaux.
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Piles électrochimiques. Exercice n°1. On réalise une pile cadmium-argent contenant les couples oxydant/réducteur suivants : Ag+. (aq)/Ag(s).
 Table des matières
Table des matières
Exercices corrigés ……………………………………………………………………………102. Chapitre 7 Les piles électrochimiques…………………………………………………………111. Synthèse de cours …
 Liaisons chimiques (65 points) Deuxième exercice
Liaisons chimiques (65 points) Deuxième exercice
Deuxième exercice : Fonctionnement d'une pile électrochimique (65 points) Corrigé. Barème. Premier exercice : Liaisons chimiques (6
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 demi-piles par un pont électrochimique. 2.1. Fém de la pile : E = E°
 3 2 3 2 Cu A Cu A + +
3 2 3 2 Cu A Cu A + +
Série d'exercices – Piles électrochimiques. Exercice n°1/. La pile de la figure ci-contre représente la pile Aluminium – Cuivre le volume de chaque
 TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
Qri < K. Le système évolue spontanément dans le sens direct de l'équation. 3. Cd donne des électrons à Ag+. Les électrons circulent donc de l'électrode de
 ??????? ???? ??? ???? ??????? ???????? ??????? ??????
??????? ???? ??? ???? ??????? ???????? ??????? ??????
Deuxième exercice (7 points). Anode ou cathode ! Pour savoir si un métal est l'anode ou la cathode d'une pile électrochimique on compare sa tendance à.
Épreuve de Chimie
Nom : N o : Série : E1 Date : 26/02/2014Classe : 3
eDurée : 50 minutes
Chimie
Cette épreuve est constituée de trois exercices. Elle comporte deux pages numérotées 1/2 et 2/2.L'usage de la calculatrice n'est pas autorisé.
Premier exercice : Liaisons chimiques (6,5 points)1. L'oxyde de lithium
Le lithium est un métal alcalin de la deuxième période. L'oxygène est casé dans le groupe VI du
tableau périodique. a. Déterminer le numéro atomique du lithium.b. Écrire la représentation de Lewis de l'atome de chacun des éléments : lithium et oxygène.
c. Le lithium et l'oxygène établissent entre eux une liaison ionique. Expliquer la liaisonchimique établie entre ces deux éléments. Donner la formule ionique et la formule statistique
de l'oxyde de lithium.2. L'eau oxygénée
La représentation de Lewis de l'atome d'hydrogène est H. Proposer la formule structurale de la molécule d'eau oxygénée de formule moléculaire H 2 O 23. Calculer la quantité de matière contenue dans 4, d'oxygène. On donne : M(O) = 16 g/mol.
Deuxième exercice : Fonctionnement d'une pile électrochimique (6,5 points) La représentation schématique d'une pile électrochimique est la suivante :Cr / Cr
3+ - pont salin - Cu 2+ / Cu1. Identifier l'anode de la pile.
2. On se propose de construire la pile électrochimique Chrome - Cuivre. Citer le matériel nécessaire
à la construction de cette pile. On signale que le montage comporte un ampèremètre.3. Faire le schéma annoté de la pile Cr - Cu. Indiquer sur le schéma le sens de déplacement des
électrons.
4. Nommer le phénomène qui se déroule au niveau de chaque électrode. Écrire la demi-équation
électronique correspondante. Déduire l'équation-bilan de la réaction de fonctionnemnt de la pile.
1/25. Les ions Cu
2+ colorent la solution en bleu. Au cours du fonctionnement de la pile, la couleur de cette solution varie. Préciser si la couleur de la solution de Cu 2+ devient plus foncée ou plus claire. Troisième exercice : Réactions d'oxydoréduction (7 points) La préparation industrielle de l'acide sulfurique à partir du soufre nécessite plusieurstransformations chimiques. Deux d'entre elles sont représentées par les équations-bilans suivantes :
Équation-bilan A : S + O
2ĺ SO
2Équation-bilan B : SO
3 + H 2O ĺ H
2 SO 41. Déterminer le nombre d'oxydation du soufre dans les espèces chimiques suivantes :
S ; SO
2 ; SO 3 ; H 2 SO 42. Dans l'équation-bilan A :
a. Donner le n.o. de chacun des éléments soufre et oxygène dans les réactifs et dans les produits.
b. Indiquer l'espèce chimique oxydée et l'espèce réduite. c. Nommer l'agent oxydant et l'agent réducteur. d. Préciser si cette équation-bilan représente une réaction d'oxydoréduction.3. Dans l'équation-bilan B :
a. Donner le n.o. de chacun des éléments : soufre, hydrogène et oxygène, dans les réactifs et
dans les produits. b. Préciser si cette équation-bilan représente une réaction d'oxydoréduction.BON TRAVAIL !
2/2Classe de 3
eExamen 1, le 26/02/2014
Chimie
Corrigé Barème
Premier exercice : Liaisons chimiques (6,5 points)1. L'oxyde de lithium
a. Les métaux alcalins appartiennent au groupe I du tableau périodique. Puisque le lithium est un métal alcalin de la 2 e période, on déduit que l'atome de lithium a2 niveaux d'énergie (2
e période) et un seul électron périphérique (groupe I). La configuration électronique de cet atome est K 2 L 1 . L'atome de lithium a donc3 électrons. Étant électriquement neutre, il a également 3 protons. Le numéro
atomique du lithium, qui représente le nombre de protons, est donc : Z = 3. b. Dans la représentation de Lewis d'un atome, le symbole de l'élément est entouré desélectrons externes de l'atome. Ainsi :
- l'atome de lithium a 1 électron externe ; sa représentation de Lewis est Li. - l'atome d'oxygène a 6 électrons externes puisque l'oxygène est casé dans le groupeVI ; sa représentation de Lewis est O .
c. L'atome de lithium répond à la règle du duet ; pour avoir le niveau K saturé à2 électrons, il cède son électron externe et devient un cation Li
. L'atome d'oxygène gagne 2 électrons pour accomplir son octet périphérique et devient un anion O 2- Deux ions lithium et un ion oxyde s'attirent et forment un composé ionique, l'oxyde de lithium, de formule ionique (2 Li ; O 2- ) et de formule statistique Li 2 O.2. L'eau oxygénée
L'atome d'oxygène est bivalent et l'atome d'hydrogène est monovalent. La formule structurale de l'eau oxygénée (H 2 O 2 ) est donc : H - O - O - H .3. Quantité de matière dans 4, d'oxygène
La quantité de matière (n) est le quotient de la masse donnée (m) par la masse molaire (M) : ===168,4 Mmn0,3 mol. Il y a donc 0,3 mol dans 4, d'oxygène.1 ½ pt
½ pt
½ pt
1 pt 1 pt 1 pt 1 pt Deuxième exercice : Fonctionnement d'une pile électrochimique (6,5 points)1. Identification de l'anode de la pile
La représentation schématique de la pile Cr - Cu montre le fonctionnement de cette pile. On constate que le chrome Cr subit une oxydation et devient un ion Cr 3+ . Puisque l'anode de la pile est l'électrode oxydée, on déduit que la lame de chrome est l'anode, représentée par convention à gauche.2. Matériel nécessaire à la construction de la pile Cr - Cu
Deux béchers, une lame de chrome, une lame de cuivre, un pont salin (tube en U rempli d'une solution saline), un ampèremètre, des fils de connexion, une solution contenant des ions Cr 3+ et une solution contenant des ions Cu 2+4. Phénomène se déroulant au niveau de chaque électrode
Au niveau de l'électrode négative ou anode, il y a oxydation des atomes Cr. La demi-équation correspondante est : Cr ĺ Cr
3+ + 3 e ou 2 Cr ĺ 2 Cr 3+ + 6 e Au niveau de l'électrode positive ou cathode, il y a réduction des ions Cu 2+ . La demi-équation correspondante est : Cu
2+ + 2 eĺ Cu ou 3 Cu
2+ + 6 eĺ 3 Cu.
Équation-bilan de la réaction de fonctionnement de la pile :2 Cr + 3 Cu
2+ĺ 2 Cr
3+ + 3 Cu¾ pt
1 pt¾ pt
¾ pt
¾ pt
1/2Corrigé Barème
3. Schéma annoté de la pile Cr - Cu
Fil de connexion
com A AmpèremètrePont salin A
e Lame de chrome Lame de cuivre (anode) (cathode) Solution contenant Solution contenant des ions Cr 3+ des ions Cu 2+5. Variation de la couleur de la solution de Cu
2+ Au cours du fonctionnement de la pile, les ions Cu 2+ sont réduits à la cathode en atomes Cu qui se déposent sur la lame de cuivre. Donc la solution s'appauvrit en ions Cu 2+ et sa couleur devient plus claire.1 ¾ pt
¾ pt
Troisième exercice : Réactions d'oxydoréduction (7 points)1. Calcul du nombre d'oxydation du soufre dans différentes espèces chimiques
Dans une molécule composée : n.o.(H) = +I et n.o.(O) = -II.On pose : n.o.(S) = x.
Dans S
: n.o.(S) = 0.Dans SO
2 : x + 2 (-II) = 0 ; d'où x = 4. Donc n.o.(S) = +IV.Dans SO
3 : x + 3 (-II) = 0 ; d'où x = 6. Donc n.o.(S) = +VI.Dans H
2 SO 4 : 2 (+I) + x + 4 (-II) = 0 ; d'où x = 6. Donc n.o.(S) = +VI.2. Étude de l'équation-bilan A : S + O
2ĺ SO
2 a. Dans les réactifs S et O 2 : n.o.(S) = 0 et n.o.(O) = 0.Dans le produit SO
2 : n.o.(S) = +IV et n.o.(O) = -II. b. Dans cette réaction : - n.o.(S) augmente de 0 à +IV ; S est donc oxydé ; - n.o.(O) diminue de 0 à -II ; O 2 est donc réduit. c. Dans cette réaction : - S est l'agent réducteur puisqu'il est oxydé ; - O 2 est l'agent oxydant puisqu'il est réduit. d. Dans la réaction représentée par l'équation-bilan A, il y a eu simultanément oxydation d'une espèce chimique (S) et réduction d'une autre espèce chimique (O 2 L'équation-bilan A représente donc une réaction d'oxydoréduction.3. Étude de l'équation-bilan B : SO
3 + H 2O ĺ H
2 SO 4 a. Dans les réactifs SO 3 et H 2O : n.o.(S) = +VI, n.o.(H) = +I et n.o.(O) = -II.
Dans le produit H
2 SO 4 : n.o.(S) = +VI, n.o.(H) = +I et n.o.(O) = -II.b. Dans la réaction représentée par l'équation-bilan B, le n.o. de chacun des éléments :
S, H et O reste le même dans les réactifs et dans les produits. Il n'y a donc ni oxydation, ni réduction. On peut dire alors que l'équation-bilan B ne représente pas une réaction d'oxydoréduction.¼ pt
½ pt
½ pt
½ pt
½ pt
½ pt
½ pt
½ pt
quotesdbs_dbs1.pdfusesText_1[PDF] exercices corrigés sur les series doubles en statistique
[PDF] exercices corrigés sur les vecteurs 2nde
[PDF] exercices corrigés sur sn1 sn2 e1 et e2
[PDF] exercices corrigés sur travail et puissance pdf
[PDF] exercices corrigés svt 3ème pdf
[PDF] exercices corrigés svt première s
[PDF] exercices corrigés svt seconde biodiversité
[PDF] exercices corrigés synthese des proteines
[PDF] exercices corrigés systeme d'information de gestion
[PDF] exercices corrigés système d'information pdf
[PDF] exercices corrigés tableau financement
[PDF] exercices corrigés thermodynamique gaz parfait
[PDF] exercices corrigés titrage acide base
[PDF] exercices corrigés travaux dinventaire pdf
