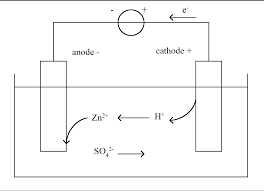
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. 4) Les ions oxonium proviennent des ions ammonium acide du couple NH4. +/NH3. ▻ Exercice n°4. 1) Dans le cas de la solution de bromure de
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercice I. On considère la pile symbolisée par: Cu / Cu2+ (01M) // Fe2+ (0
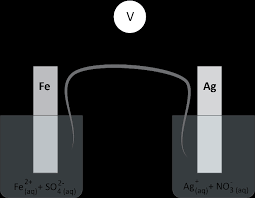 Exercices de la séquence n°4 - Piles
Exercices de la séquence n°4 - Piles
de la pile comme indiqué sur le schéma et obtiennent une tension de + 12 V. Données : Couples Oxydant / Réducteur : Fe2+ (aq) / Fe (s) et Ag+ (aq) / Ag (s).
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Les solutions électrolytiques dans chaque demi-pile ont été respectivement réalisées par dissolution de nitrate d'argent AgNO3(s)
 Chimie et développement durable Partie 1
Chimie et développement durable Partie 1
CORRECTION EXERCICES. Partie 1/ Chimie minérale. Fiche 10 : Les piles électrochimiques. Exercice 1. Pile (1). Cu2+/Cu : E0 = 034 V ; Fe2+/Fe : E0 = - 0
 Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Sentraîner : Piles et oxydoréduction Exercice : Laccumulateur au
Correction Exercice : L'accumulateur au plomb et le démarrage automobile. 1. A l'extérieur de la pile ce sont les électrons qui sont responsables du passage
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Exercices. ▻ Exercice n°1. On réalise une pile avec les couples Ni2+. (aq)/Ni(s) et Al3+. (aq)/Al(s). La lame de nickel trempe dans 150 mL d'une solution
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Cette épreuve est constituée de trois exercices. Elle comporte 2 pages Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique ...
 Sans titre
Sans titre
Les piles électrochimiques. Profs: Abdelmoula et Zribi. I) On considère la pile (P1) symbolisée par : Pt
 Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques ( )
Corrigé Sujet 1 des exercices sur les piles électrochimiques. 1. La pile au citron. 1.1.1. La tension à vide d'une pile se nomme également force électromotrice
 Exercices de révision- Oxydo-réduction et Piles électrochimiques
Exercices de révision- Oxydo-réduction et Piles électrochimiques
Réactions d'oxydo-réduction et piles électrochimiques. (Exercices de révision). Exercice I Corrigé. Exercice I. On considère la pile symbolisée par:.
 Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Thème : Piles et électrolyses Fiche 4 : Piles et électrolyses
Fiche Corrigés. Thème : Piles et électrolyses Exercice n°1 ... 5) Dans une pile l'anode s'enrichit en électrons
 Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 1 (6 points) La fabrication du verre Exercice 2 (7 points
Exercice 2 (7 points). Piles électrochimiques. Une pile électrochimique convertit l'énergie chimique en énergie électrique. Différents types de métaux.
 TS2 Piles électrochimiques Exercice n°1 On réalise une pile
TS2 Piles électrochimiques Exercice n°1 On réalise une pile
Piles électrochimiques. Exercice n°1. On réalise une pile cadmium-argent contenant les couples oxydant/réducteur suivants : Ag+. (aq)/Ag(s).
 Table des matières
Table des matières
Exercices corrigés ……………………………………………………………………………102. Chapitre 7 Les piles électrochimiques…………………………………………………………111. Synthèse de cours …
 Liaisons chimiques (65 points) Deuxième exercice
Liaisons chimiques (65 points) Deuxième exercice
Deuxième exercice : Fonctionnement d'une pile électrochimique (65 points) Corrigé. Barème. Premier exercice : Liaisons chimiques (6
 CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES [ ] [ ]
Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 demi-piles par un pont électrochimique. 2.1. Fém de la pile : E = E°
 3 2 3 2 Cu A Cu A + +
3 2 3 2 Cu A Cu A + +
Série d'exercices – Piles électrochimiques. Exercice n°1/. La pile de la figure ci-contre représente la pile Aluminium – Cuivre le volume de chaque
 TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
TS2 Piles électrochimiques. EXERCICE n°1 : Pile cadmium-argent
Qri < K. Le système évolue spontanément dans le sens direct de l'équation. 3. Cd donne des électrons à Ag+. Les électrons circulent donc de l'électrode de
 ??????? ???? ??? ???? ??????? ???????? ??????? ??????
??????? ???? ??? ???? ??????? ???????? ??????? ??????
Deuxième exercice (7 points). Anode ou cathode ! Pour savoir si un métal est l'anode ou la cathode d'une pile électrochimique on compare sa tendance à.
CORRECTION EXERCICES SUR OXYDO-REDUCTION / PILES
EXERCICE 1 :
Couples en présence : Fe2+/Fe Eo1 = - 0,44 V
Ag+/Ag Eo2 = + 0,80 V
1.) D'après les valeurs des potentiels : Eo1 < Eo2 Þ OX FORT : Ag+
RED FORT : Fe
Fe réagit donc avec la solution d'ions Ag+
Equation de réaction : Fe ¾¾® Fe2+ + 2 e-Ag+ + e- ¾¾® Ag | | x 2
Bilan total : Fe + 2 Ag+ ¾¾® Fe2+ + 2 Ag2.) On realise une pile par l'association de 2 demi-piles :
Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 demi-piles par un pont électrochimique
2.1. Fém de la pile : E = E° (grand) - E° (petit)
E = E°1 - E°2 = + 0,80 - (- 0,44) Þ E = + 1,24 V2.2. Schéma de la pile :
E° le plus grand : borne +
E° le plus petit : borne -
Le courant circule du + vers le - dans le
circuit extérieur au générateur (pile)Les cations circulent comme I
Les anions circulent comme les e-
Electrode en Fe :
Fe ¾¾® Fe2+ + 2 e-
Electrode en Ag :
Ag+ + e- ¾¾® Ag
Le bilan aux électrodes donne les mêmes équations que dans le cas du contact direct, mais dans le cas
d'une pile l'échange d'électrons se fait par le milieu extérieur : ce qui donne un courant électrique
On constate que : [] Fe2+ augmente puisque les ions Fe2+ sont fabriqués [] Ag+ diminue puisque les ions Ag+ sont consommésEXERCICE 2 :
Couples en présence : Cu2+/Cu Eo1 = + 0,34 V
Ag+/Ag Eo2 = + 0,80 V
1.) D'après les valeurs des potentiels : Eo1 < Eo2 Þ OX FORT : Ag+
RED FORT : Cu
Cu réagit donc avec la solution d'ions Ag+
Equation de réaction : Cu ¾¾® Cu2+ + 2 e-Ag+ + e- ¾¾® Ag | | x 2
Bilan total : Cu + 2 Ag+ ¾¾® Cu2+ + 2 Ag Ag + NO 3 - NO 3 - Fe2+ CIRCUIT + - PONT K
+ Cl - Ag Fe I e 2· Equation de réaction
Cu + 2 Ag+ ¾¾® Cu2+ + 2 Ag
· Donnée : solution de nitrate d'argent : (Ag+ + NO3- ) n = c . V avec c = 20 M = 20170 = 0,118 mol.L-1
n = 0,118 . 10 .10 -3 Þ n = 1,18 . .10-3 mol· Tableau d'avancement de la réaction :
EQUATION
CHIMIQUE
Cu 2 Ag+ Cu2+ 2 Ag ETAT du
SYSTEME Avancement
( en mol ) ( en mol ) ( en mol ) ( en mol )( en mol ) t = 0 0 Excès n = 1,18.10-3 0 0 t quelconque x n - 2 x + x + 2 x t final xL 0 = n - 2 xL xL 2 xL
· Réactif limitant xL : ce sont les ions Ag+ puisque le cuivre est en excès :0 = n - 2 xL Þ n = 2 xL Þ xL = n
2 = 5,9 . 10
-4 mol Nous pouvons maintenant répondre à la question posée : nAg = 2 xL = m M Donc m = 2 xL . M = 2 . 5,9 . 10-4 . 108 Þ m = 0,EXERCICE 3 :
Couples en présence : Pb2+/Pb Eo1 = - 0,12 V
Ag+/Ag Eo2 = + 0,80 V
1.) Equations de définition des couples : Ag+ + e- ¾¾®¬¾¾ Ag
Pb2+ + 2 e- ¾¾®¬¾¾ Pb
2.) On réalise une pile par l'association de 2 demi-piles :
Une demi-pile est obtenue en trempant le métal dans sa solution et on relie les 2 demi-piles par un pont électrochimique
Schéma de la pile :
E° le plus grand : borne +
E° le plus petit : borne -
Le courant circule du + vers le - dans le
circuit extérieur au générateur (pile)Les cations circulent comme I
Les anions circulent comme les e-
Fém de la pile :
E = E° (grand) - E° (petit)
E = E°2 - E°1 = + 0,80 - (- 0,12)
Þ E = + 0,92 V
3.) D'après les valeurs des potentiels : Eo1 < Eo2 Þ OX FORT : Ag+
RED FORT : Pb Ag
+ NO 3 - NO 3 - Pb2+ CIRCUIT + - PONT K + Cl - Ag Pb I e 3 Equation de réaction aux électrodes : Pb ¾¾® Pb2+ + 2 e-Ag+ + e- ¾¾® Ag | | x 2
Bilan total : Pb + 2 Ag+ ¾¾® Pb2+ + 2 AgEXERCICE 4 :
1.) Si le pôle négatif de cette pile est le zinc : c'est que le zinc correspond à la valeur du potentiel le plus bas : donc Zn est le réducteur fort
On peut donc écrire la demi-équation correspondante :Zn ¾¾® Zn2+ + 2 e-
1 mole 2 moles
nZn n on en déduit que : n . 1 = 2 nZn Þ nZn = n2 = 0,5 . 10
-2 mol2.) Quantité d'électricité pour 1 mole : 1 Faraday = 1 F = 96500 C
Donc Q
exp = n F = 1 . 10-2 . 96500 Þ Q = 965 COn sait que : Q = I . t Þ t = Q
I = 9651 Þ t = 965 s = 16 min
EXERCICE 5 : Couples en présence : Cu2+/Cu Eo1 = + 0,34 VFe2+/Fe Eo2 = - 0,44 V
D'après les valeurs des potentiels : Eo1 > Eo2 Þ OX FORT : Cu2+RED FORT : Fe
Fe réagit donc avec la solution d'ions Cu2+
Equation de réaction : Cu2+ + 2 e- ¾¾® CuFe ¾¾® Fe2+ + 2 e-
Bilan total : Fe + Cu2+ ¾¾® Fe2+ + Cu· Equation de réaction
Fe + Cu2+ ¾¾® Fe2+ + Cu
· Donnée : solution de sulfate de cuivre (Cu2+ + SO42- ) n = c . V = 0,5 . 0,150 Þ n = 7,5 . 10-2 mol· Tableau d'avancement de la réaction :
EQUATION
CHIMIQUE Fe Cu2+ Fe2+ Cu ETAT du
SYSTEME Avancement
( en mol ) ( en mol ) ( en mol ) ( en mol )( en mol ) t = 0 0 n' : Excès n = 7,5 . 10-2 0 0 t quelconque X n' - x n - x + x + x t final xL n' - xL 0 = n - xL xL xL
· Réactif limitant xL : ce sont les ions Cu2+ puisque l'énoncé dit qu'ils disparaissent totalement.
n - xL = 0 Þ n = xL Þ xL = 7,5 . 10-2 mol Nous pouvons maintenant répondre aux questions posées : 41.) masse de cuivre déposé : nCu = xL = m
M Donc m = xL . M = 7,5 . 10-2 . 63,5 Þ m = 4,2.) Perte de masse subie par le fer : d'après le tableau c'est xL
xL = m' M' Þ m' = xL . M' = 7,5 . 10-2 . 55,8 Þ m = 4,19 gEXERCICE 6 : Acide chlorhydrique : (H3O+ + Cl-)
L'ion oxonium H
3O+ peut aussi s'écrire : H+aq
Les couples en présence sont : H+aq/ H2 Eo1 = 0,00 V référenceZn2+/Zn Eo2 = - 0,76 V
D'après les valeurs des potentiels : Eo1 > Eo2 Þ OX FORT : H+aqRED FORT : Zn
Zn réagit donc avec la solution acide contenant les ions H+aq Equation de réaction : 2 H+aq + 2 e- ¾¾® H2Zn ¾¾® Zn2+ + 2 e-
Bilan total : Zn + 2 H+aq ¾¾® Zn2+ + H2· Equation de réaction
· Zn + 2 H+aq ¾¾® Zn2+ + H2· Donnée : masse de zinc : n = m
M = 264,5 Þ n = 3,1 . 10-2 mol
· Tableau d'avancement de la réaction :
EQUATION
CHIMIQUE
Zn 2 H+aq Zn2+ H2 ETAT du
SYSTEME Avancement
( en mol ) ( en mol ) ( en mol ) ( en mol )( en mol ) t = 0 0 n = 3,1 . 10-2 Excès 0 0 t quelconque X N - x + x + x t final xL 0 = n - xL x
L xL · Réactif limitant xL : c'est le zinc puisque l'acide est en excès : n - xL = 0 Þ n = xL Þ xL = 3,1 . 10-2 mol Nous pouvons maintenant répondre aux questions posées :1.) Volume de dihydrogène libéré : : nH2 = xL = v
VmÞ v = xL . Vm
Donc v = 3,1 . 10-2 . 25 Þ v = 0,775 L
2.) Masse de chlorure de zinc formé : (Zn2+ + 2 Cl-)
xL = m' M' Þ m' = xL . M' = 3,1 . 10-2 . 135,5 Þ m = 4,20 g 5EXERCICE 7 : Acide FORT : H3O+ ou H+aq
Les couples en présence sont : H+aq/ H2 Eo1 = 0,00 V référenceFe2+/Fe Eo2 = - 0,44 V
D'après les valeurs des potentiels : Eo1 > Eo2 Þ OX FORT : H+aqRED FORT : Fe
Fe réagit donc avec la solution acide contenant les ions H+aq Equation de réaction : 2 H+aq + 2 e- ¾¾® H2Fe ¾¾® Fe2+ + 2 e-
Bilan total : Fe + 2 H+aq ¾¾® Fe2+ + H2· Equation de réaction
· Fe + 2 H+aq ¾¾® Fe2+ + H2· Donnée : masse de fer : n = m
M = 0,255,8 Þ n = 3,6 . 10-3 mol
Acide : pH = 1 Þ [] H+aq = 10-pH = 10-1 mol.L-1 n' = c . V = 0,1 . 0,1 Þ n' = 10-2 mol· Tableau d'avancement de la réaction :
EQUATION
CHIMIQUE
Fe 2 H+aq Fe2+ H2 ETAT du
SYSTEME Avancement
( en mol ) ( en mol ) ( en mol ) ( en mol ) ( en mol ) t = 0 0 n = 3,6 . 10-3 N' = 10 -2 0 0 t quelconque X N - x N' - 2 x + x + x t final xL xL xL· Réactif limitant xL : il faur faire les deux calculs et voir quelle la valeur de x la plus petite :
Calcul 1 : n - x = 0 Þ n = x Þ x = 3,6 . 10-3 molCalcul 2 : n' - 2 x' = 0 Þ x' = n'
2Þ x' = 0,5 . 10-2 mol
Conclusion : c'est le fer qui est le réctif limitant : xL = 3,6 . 10-3 mol Nous pouvons maintenant répondre aux questions posées :1.) Il y a donc disparition totale du métal :
2.) Volume de dihydrogène libéré : : nH2 = xL = v
Vm Þ v = xL . Vm
Donc v = 3,6 . 10-3 . 24 Þ v = 86,4 . 10-3 L EXERCICE 8 : solution de chlorure de cuivre : (Cu2+ + 2 Cl-)1.) Couples en présence : Cu2+/Cu Eo1 = + 0,34 V
Sn2+/Sn Eo2 = - 0,11 V
D'après les valeurs des potentiels : Eo1 > Eo2 Þ OX FORT : Cu2+RED FORT : Sn
Sn réagit donc avec la solution d'ions Cu2+
6 Equation de réaction : Cu2+ + 2 e- ¾¾® CuSn ¾¾® Sn2+ + 2 e-
Bilan total : Sn + Cu2+ ¾¾® Sn2+ + Cu2.) Tableau d'avancement :
· Equation de réaction
Sn + Cu2+ ¾¾® Sn2+ + Cu
· Tableau d'avancement de la réaction :
EQUATION
CHIMIQUE
Sn Cu2+ Sn2+ Cu ETAT du
SYSTEME Avancement
( en mol ) ( en mol ) ( en mol ) ( en mol )( en mol ) t = 0 0 n' : Excès ni 0 0 t quelconque X n' - x ni - x + x + x t final xL n' - xL 0 = ni - xL xL xL
· Réactif limitant xL : la solution est totalement décolorée, donc tous les ions Cu2+ ont disparu :
ce sont donc les ions Cu2+ qui sont limitants. La plaque a perdu une masse m = 55 mg d'étain : nSn = xL = m
M =55 . 10-3
118,7 Þ xL = 4,63 . 10-4 mol
Nous pouvons maintenant répondre aux questions posées :2.) masse de cuivre déposé :
nCu = xL = m'
M' Þ m' = xL . M' = 4,63 . 10-4 . 63,5 Þ m' = 2,94 . 10-2 g3.) Concentration de la solution initiale :
d'après le tableau : 0 = ni - xL Þ ni = xLDonc la concentration vaut : ci = ni
V = x
L/V = 4,63 . 10-4/0,5
Þ ci = 9,26 . 10-4 mol.L-1
quotesdbs_dbs1.pdfusesText_1[PDF] exercices corrigés sur les series doubles en statistique
[PDF] exercices corrigés sur les vecteurs 2nde
[PDF] exercices corrigés sur sn1 sn2 e1 et e2
[PDF] exercices corrigés sur travail et puissance pdf
[PDF] exercices corrigés svt 3ème pdf
[PDF] exercices corrigés svt première s
[PDF] exercices corrigés svt seconde biodiversité
[PDF] exercices corrigés synthese des proteines
[PDF] exercices corrigés systeme d'information de gestion
[PDF] exercices corrigés système d'information pdf
[PDF] exercices corrigés tableau financement
[PDF] exercices corrigés thermodynamique gaz parfait
[PDF] exercices corrigés titrage acide base
[PDF] exercices corrigés travaux dinventaire pdf
