 Manuel de prélèvement
Manuel de prélèvement
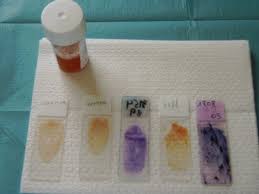
13 avr. 2018 Figure 4 : lames d'étalement avant et après coloration. EXAMEN EXTEMPORANE D'HISTOLOGIE. Type d'échantillon. Tissu ou fragments tissulaires à ...
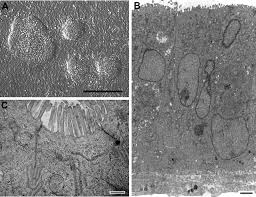 La Plateforme dHistologie et de Microscopie Électronique Services
La Plateforme dHistologie et de Microscopie Électronique Services
coupes histologiques ou de préparations cellulaires par microdissection ... Cette technique solidifie les tissus permettant des coupes très minces. Les ...
 Fiche 1 : Les méthodes dobservation
Fiche 1 : Les méthodes dobservation
Technique simple. Technique complexe i. Les microscopes à sondes locales. Il en Ces deux contraintes identifiées la préparation des coupes histologiques se.
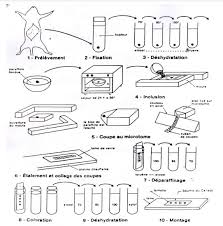
 MODULE 1 – Introduction Comment préparer un prélèvement de
MODULE 1 – Introduction Comment préparer un prélèvement de
Cette coloration est la technique de contraste fondamentale pour tout examen microscopique histologique La dernière étape de la préparation des lames ...
 Contribution a letude dagents pathogenes de lhuitre creuse
Contribution a letude dagents pathogenes de lhuitre creuse
7 mars 2018 Les techniques d'histologie ... technique de préparation des lames (superposition de particules sur les cellules). Les coupes histologiques ...
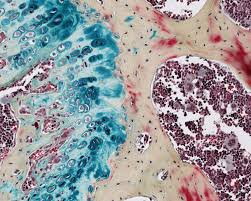 Aperçu des principales colorations histologiques et intérêt pour le
Aperçu des principales colorations histologiques et intérêt pour le
L'inclusion a pour but la réalisation de coupes histologiques. Le milieu d lors de son analyse initiale sur les coupes de technique standard. Les ...
 TP 7 Histologie Les techniques de MO et de ME sont utilisées en
TP 7 Histologie Les techniques de MO et de ME sont utilisées en
ou en ME les coupes examinées sont le fruit de procédures techniques qui requièrent plusieurs étapes successives : fixation
 Les techniques de préparation des coupes pour les microscopies
Les techniques de préparation des coupes pour les microscopies
TECHNIQUE HISTOLOGIQUE EN Les coupes du bloc de paraffine sont réalisées avec un microtome permettant d'obtenir des tranches de section (coupes histologiques).
 Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
Le but de cette technique est d'éliminer l'eau contenue dans les organes par un TD N°2 : Techniques de préparation des coupes histologiques. Page 2 ...
 FICHE TECHNIQUE TP HISTOLOGIE - PREPARATION DUNE
FICHE TECHNIQUE TP HISTOLOGIE - PREPARATION DUNE
la confection des coupes histologiques comporte alors 3 étapes : - L - Le séchage de la préparation : en inclinant les lames et en les séchant au moyen ...
 FICHE TECHNIQUE TP HISTOLOGIE - PREPARATION DUNE
FICHE TECHNIQUE TP HISTOLOGIE - PREPARATION DUNE
Connaître en détail les techniques histologiques de routine et comprendre le rôle de Elle a pour but de permettre la réalisation de coupes fines (d'une ...
 Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
Université Frères Mentouri Constantine 1 1ère année LMD / TC / SNV
Pour l'étude histologique classique la préparation des coupes fines se fait Le but de cette technique est d'éliminer l'eau contenue dans les organes
 TP 7 Histologie Les techniques de MO et de ME sont utilisées en
TP 7 Histologie Les techniques de MO et de ME sont utilisées en
différents éléments de la préparation. Comme les colorants sont en solution aqueuse les coupes doivent d'abord subir une réhydratation. Celle-ci est effectuée
 Les techniques de préparation des coupes pour les microscopies
Les techniques de préparation des coupes pour les microscopies
Le plus souvent le matériel histologique (= cellules contenues dans un tissu) est fixé
 Aperçu des principales colorations histologiques et intérêt pour le
Aperçu des principales colorations histologiques et intérêt pour le
L'inclusion a pour but la réalisation de coupes histologiques. Le milieu d'inclusion le plus utilisé est la paraffine. Comme la paraffine est hydrophobe le.
 Sans titre
Sans titre
A. Fixation macroscopie
 HISTOLOGIE : les COUPES dans des TISSUS VEGETAUX Une
HISTOLOGIE : les COUPES dans des TISSUS VEGETAUX Une
En voici un exemple : il s'agit d'une coupe dans une tige d'Asparagus avec coloration et montage selon le processus déve-.
 Guide sur lassurance qualité en anatomopathologie - Phases pré
Guide sur lassurance qualité en anatomopathologie - Phases pré
technique des préparations histologiques ? › Les lames sont-elles de qualité suffisante (fixation des tissus épaisseur des coupes
 Préparation des tissus : information générale
Préparation des tissus : information générale
Préparation des tissus : information générale. Tissus inclus dans la paraffine. - Technique solidifiant les tissus et permettant de confectionner des coupes
 La Plateforme dHistologie et de Microscopie Électronique Services
La Plateforme dHistologie et de Microscopie Électronique Services
et d'isolation de tissus ou de cellules à partir de coupes histologiques ou de préparations cellulaires par microdissection laser (LCM).
 Chapitre II : Méthodes d’étude de la cellule TD N°2
Chapitre II : Méthodes d’étude de la cellule TD N°2
1- Préparation des coupes pour observation au microscope optique Pour l’étude histologique classique la préparation des coupes fines se fait en plusieurs étapes : a) Prélèvement Le prélèvement effectué sur un organe doit se faire aussi délicatement que possible afin de ne pas meurtrir les tissus
 Les colorations histologiques - Université Paris-Saclay
Les colorations histologiques - Université Paris-Saclay
Les coupes du bloc de paraffine sont réalisées avec un microtome permettant d’obtenir des sections (coupes histologiques) de 3 à 5 microns d’épaisseur Les coupes sont recueillies sur des lames de verre et mises à sécher (sur la nuit à 40-45°C ou 1H max 60°C) - La plupart des tissus sont transparents
 Searches related to technique de préparation des coupes histologiques PDF
Searches related to technique de préparation des coupes histologiques PDF
1- Préparation des coupes pour observation au microscope optique [Figure 1] Pour l’étude histologique classique la préparation des coupes fines se fait en plusieurs étapes : a) Prélèvement Le prélèvement effectué sur un organe doit se faire aussi délicatement que possible afin de ne pas meurtrir les tissus
Déshydratation
Les échantillons fixés dans des solutions aqueuses ne peuvent être imprégnés en paraffine directement. L’eau des tissus doit être éliminée par déshydratation dans une succession de bains d’éthanol de concentration croissante (70%, 95% à 100%).
Clarification
Bien que le tissu soit maintenant essentiellement exempt d’eau, il ne peut toujours pas être imprégné dans la paraffine car celle-ci est non miscible dans l’éthanol. Il faut utiliser un solvant intermédiaire miscible à la fois dans l’éthanol et dans la paraffine. L’agent de clarification le plus couramment utilisé est le xylène.
Comment faire une coupe histologique ?
La préparation d’une coupe histologique consiste à réaliser des sections, c’est-à-dire des tranches très fines de tissus destinés à être observés par transparence au microscope. Les coupes à congélation présentent certains avantages que la technique en paraffine n’offre pas : la congélation permet une conservation optimale de l’ADN et de l’ARN.
Comment faire des coupes fines dans un tissu biologique ?
Le but est d’éliminer l’eau des tissus et de la remplacer par un milieu qui se solidifie pour permettre la réalisation de coupes fines (4 à 5µm). Pour cela, le tissu biologique doit être inclus dans une matrice dure (paraffine). Les principales étapes de ce processus sont la déshydratation, la clarification et l’imprégnation. Déshydratation
Comment faire des coupes de tissu?
Les coupes sont recueillies sur des lames de verre et mises à sécher (sur la nuit à 40-45°C ou 1H max 60°C). - La plupart des tissus sont transparents ?Les colorationsréalisées sur lames, accentuent les contrastes pour pouvoir reconnaîtredifférents éléments du tissu. LES ETAPES DE LA COLORATION -Déparaffinage (toluène / xylène - éthanol)
Comment traiter les tissus biologiques ?
Traitement des tissus Le but est d’éliminer l’eau des tissus et de la remplacer par un milieu qui se solidifie pour permettre la réalisation de coupes fines (4 à 5µm). Pour cela, le tissu biologique doit être inclus dans une matrice dure (paraffine). Les principales étapes de ce processus sont la déshydratation, la clarification et l’imprégnation.
Past day
technique de préparation des coupes histologiques
PDF Télécharger Les techniques de microscopies optique et électronique technique de préparation des coupes histologiques technique histologique but et principe,technique histologique microscope photonique,les étapes de préparation d'une coupe histologique,les applications des techniques histologiques,histologie fixation, lgo algo-sr relsrch richAlgo" data-155="6463b6afed8d5">pdfprof.com › PDF_Doc_Telecharger_Gratuitstechnique de préparation des coupes histologiques - PDF Prof pdfprof.com › PDF_Doc_Telecharger_Gratuits Cached
1. Méthodes d'études en histologie | 9
1. Méthodes d'études en histologie
1. Quel(s) ordre(s) est(sont) possible(s) pour l'analyse histologique
A. Fixation, macroscopie, inclusion, coupe, coloration, microscopie B. Macroscopie, inclusion, fixation, coupe, coloration, microscopieC. Congélation, coupe, coloration, microscopie
D. Fixation, coloration, inclusion, coupe, microscopie E. Décalcification, fixation, inclusion, coupe, microscopie2. A propos des méthodes d'études en cytologie ou en histologie
A. La fixation d'un tissu prévient la putréfaction, l'autolyse B. La macroscopie peut être réalisée avant et/ou après la fixation C. L'inclusion précède la décalcification des pièces osseusesD. L'hématéine est un fixateur simple
E. Pour la réalisation d'une apposition, on écrase puis on étale un petit fragment tissulaire sur une lame de verre3. A propos des techniques histologiques
A. La fixation est une technique de conservation de cellules et tissus B. L'étude macroscopique peut précéder et suivre l'étape de fixation C. La décalcification précède l'étape de fixation D. L'inclusion en paraffine ou en résine permet de conférer une consistance ferme à une pièce tissulaire E. Un bloc de tissu inclus en paraffine peut être coupé au microtome ou à l'ultramicrotome4. Les prélèvements
A. Les prélèvements à visée cytologique ne font jamais l'objet d'une inclusion B. Certains prélèvements histologiques peuvent être réalisés par biopsie C. Les prélèvements par frottis vaginal ont pour coloration de routine la coloration de Papanicolaou D. Si un état frais ou une congélation ne sont pas prévus, le prélèvement est précédé d'une fixation E. L'exérèse est un prélèvement chirurgical de tout ou partie d'un tissu ou d'un organe10 | QCM Histologie
5. Méthodes d'études
A. Un examen histologique extemporané peut avoir pour séquence: Fixation, envoie au laboratoire, macroscopie, inclusion, coupe, coloration, microscopie B. Un examen histologique extemporané peut avoir pour séquence: Envoi au laboratoire, macroscopie, congélation, coupe, coloration, microscopie C. Un examen cytologique extemporané peut avoir pour séquence: Envoi au laboratoire, fixation, coloration, microscopie D. La coupe au cryostat se fait sur des tissus portés à une température d'environ: -20°C à -30°C E. Les blocs de tissus fixés et inclus en paraffine doivent être stockés en chambre froide après leur utilisation pour éviter la dégradation des tissus6. Méthodes d'études en histologie
A. Pour la réalisation d'un état frais, la macroscopie de la pièce peut être réalisée avant ou après fixation B. La macroscopie peut être réalisée par un automate C. En routine, après fixation, on coupe des pièces tissulaires en 30x20x3mm pour la réalisation d'une inclusion en paraffine D. En routine, après fixation, on coupe des pièces tissulaires en 5x5x5mm pour la réalisation de coupes au cryostat E. La technique d'empreinte est compatible avec l'état frais et permet un examen rapide de l'organisation tissulaire7. A propos de la technique d'histoenzymologie
A. Elle peut être utilisée sur des coupes de tissus congelés B. Elle peut être utilisée sur des coupes de tissus fixés C. Elle comporte une étape de coloration standard D. Elle est compatible avec la microscopie électronique E. Elle implique l'utilisation d'anticorps marqués8. Une biopsie ostéomédullaire
A. Peut servir, avant toute fixation, à la réalisation de plusieurs empreintes cytologiquesB. Peut être en partie congelée
C. Doit obligatoirement être décalcifié pour permettre les coupes ultérieures D. Peut permettre l'étude de l'organisation histologique de la moelle hématopoïétique E. Ne peut pas subir l'étape de coloration du fait de son caractère calcifié, même après fixation et décalcification1. Méthodes d'études en histologie | 11
9. La congélation d'un fragment tissulaire permet:
A. De le couper avec un microtome
B. De le couper avec un cryotome
C. De réaliser si nécessaire un examen extemporanéD. D'extraire les acides nucléiques
E. D'effectuer des techniques d'histoenzymologie
10. Quel(s) ordre(s) est(sont) possible(s) pour l'analyse histologique
A. Fixation, envoi au laboratoire, macroscopie, inclusion, coupe, coloration, microscopie B. Macroscopie, fixation, inclusion, envoi au laboratoire, coupe, coloration, microscopie C. Microscopie, inclusion, fixation, envoi au laboratoire, macroscopie, coupe, coloration D. Envoi au laboratoire, macroscopie, inclusion, fixation, coupe, coloration, microscopie E. Envoi au laboratoire, macroscopie, congélation, coupe, coloration, microscopie11. La macroscopie
A. Est une analyse qui peut faire partie de l'examen à l'état frais B. Est un examen qui doit toujours être réalisé avant la fixationC. Permet d'établir un diagnostic histologique
D. Est un préalable à toute étude cytologique E. Sur une pièce tumorale, la macroscopie permet de sélectionner les zones nécrotiques qui feront l'objet de la suite de l'analyse histologique12. Méthodes d'études en histologie
A. La congélation est un mode de fixation qui préserve les activités enzymatiques des tissus B. La congélation permet la conservation de pièces histologique qui pourront servir, plusieurs années après encore, à des études moléculaires et enzymatiques C. Une coupe et une coloration par l'hématéine éosine safran (HES) peuvent être réalisées sur un bloc de tissu fixé par le liquide de Bouin, inclus en paraffine et archivé à température ambiante depuis plusieurs années D. L'inclusion en paraffine d'un fragment tissulaire est une étape préalable à la coupe au cryomicrotome E. Le matériel prélevé par ponction d'un liquide ne peut pas faire l'objet d'une fixation12 | QCM Histologie
13. Parmi les substances suivantes quel(s) est(sont) celle(s) habituellement
utilisée(s) pour une fixationA. Liquide de Bouin
B. Formol
C. Hématéine
D. Paraffine
E. Tétra oxyde d'osmium
14. Pour une analyse morphologique
A. Il est souvent nécessaire, en microscopie optique, de faire appel à des colorations pour augmenter le contraste de coupes comme, par exemple, le trichrome de Masson qui marque en vert le cytosquelette B. Il peut être fait appel à un microscope optique inversé à contraste de phase pour observer des cellules vivantes C. Il est nécessaire, pour la microscopie à fluorescence, de réaliser un marquage de l'échantillon par immunofluorescence D. Lors de la préparation standard d'un échantillon en vue de son observation en microscopie photonique, il est classiquement fait appel à une fixation, au formol par exemple, pour préserver les structures biologiques et les constituants biochimiques E. Il est toujours nécessaire de réaliser des coupes histologiques ultrafines, après fixation et inclusion en résine, pour observer un échantillon en microscopie électronique15. La coloration
A. La coloration HES (hématéine éosine safran) est une coloration standard B. La coloration HES est une coloration trichromique C. La coloration HES colore les éléments acides en rose et les éléments basiques en bleu D. La coloration de Gram est une " coloration spécifique », pour des bactéries E. La coloration est incompatible avec l'examen extemporané de cellules et de tissus16. Les colorations histologiques spéciales
A. Utilisent l'affinité de certains organites cellulaires pour certains colorants B. Utilisent l'affinité de molécules complexes intracellulaires pour certains colorants C. Utilisent l'affinité de molécules complexes extracellulaires pour certains colorantsD. Sont utilisables en microscopie optique
E. Ne sont jamais utilisables en microscopie électronique1. Méthodes d'études en histologie | 13
17. Méthodes d'études en histologie
A. Après décongélation d'une pièce cryoconservée, la décomposition moléculaire reprend en l'absence de fixation B. Les techniques immuno-enzymatiques peuvent être réalisées sur des coupes de tissus congelés C. Les techniques immuno-enzymatiques peuvent être réalisées sur des coupes de tissus fixés dans le liquide Bouin et inclus en paraffine D. La microcopie électronique ne peut pas être réalisée sur une pièce de tissu congelé E. Les blocs de tissus en paraffine peuvent être congelés pour réaliser des coupes au cryomicrotome18. Colorations spéciales
A. Les fibres de réticuline peuvent être révélées par des colorations argentiques B. Les colorations spécifiques à l'O-Red-Oil ou aux Soudans ne peuvent se faire qu'à l'état frais ou sur coupe de tissus congelés C. Le bleu de Crésyl est un colorant métachromatique utilisé pour les cytologies du sang, de frottis D. Une infection à HPV (Papilloma Virus Humain) peut être révélée par coloration spéciale d'une coupe de biopsie du col utérin E. Il n'y a pas de restriction à utiliser une coloration spécifique sur unéchantillon à l'état frais ou congelé
19. Réaction de Schiff à l'acide périodique (PAS)
A. La réaction de Schiff à l'acide périodique (PAS) est une coloration trichrome B. Le glycogène est coloré en bleu par la réaction de Schiff à l'acide périodique C. L'action de la diastase couplée à des réactions de Schiff à l'acide périodique permet de distinguer le glycogène d'une part des mucopolysaccharides d'autre part D. Les granulations des mastocytes présentent une métachromasie après coloration par la réaction de Schiff à l'acide périodique E. La réaction de Schiff à l'acide périodique peut être appliquée à des tissus fixés par le formol et inclus en paraffine14 | QCM Histologie
20. Méthodes d'études en histologie
A. Les cellules d'un frottis ou d'un brossage peuvent être fixées dans du sérum physiologique B. Les pièces inclues en paraffine doivent subir une étape préalable de déparaffinage/réhydratation avant la coloration C. Toutes les colorations spécifiques peuvent être utilisées aussi bien pour des états frais que pour des colorations après fixation/inclusion D. Pour une bonne préservation des acides nucléiques il est nécessaire de conserver les échantillons à -20/-30°C E. Le liquide de Bouin contient de l'alcool, du formol et de l'acide acétique21. A propos des techniques spéciales
A. L'histochimie permet de mettre en évidence des constituants spécifiques in situ B. L'hybridation in situ permet de mettre en évidence et de localiser des segments d'ADN ou d'ARN C. L'histoenzymologie consiste à révéler la présence ou l'absence d'un substrat cellulaire D. L'immunohistologie n'est pas possible sur tissu fixé au liquide de Bouin du fait de son autofluorescence E. Le typage leucocytaire peut être réalisé à l'aide d'anticorps spécifiques couplés à un traceur peroxydase22. Méthodes et techniques en histologie
A. La macroscopie peut être réalisée avant et après fixation B. La fixation est une étape qui permet de donner une consistance ferme à une pièce tissulaire C. La paraffine est solide à une température de 37°C D. L'inclusion est indispensable pour la réalisation de coupes au microtome ou à l'ultramicrotome E. La coloration doit toujours précéder l'étape de l'inclusion23. A propos des méthodes d'études en histologie
A. Le Bleu de toluidine est un colorant métachromatique parce qu'il a la capacité de produire deux teintes différentes selon les structures concernées B. En microscopie optique, les échantillons doivent être déparaffinées avant l'étape de la coloration C. L'immunohistochimie peut être compatible avec une observation en microscopie électronique D. La clarification est une étape de l'inclusion qui rend impossible la coloration des inclusions lipidiques E. Le rouge Sirius est un colorant du collagène1. Méthodes d'études en histologie | 15
24. Pour une description morphologique des biostructures
A. Il est souvent nécessaire, en microscopie optique, de faire appel à des colorations pour augmenter le contraste des coupes B. Il peut être fait appel à un microscope optique inversé pour observer des cellules vivantes C. Il est nécessaire, pour la microscopie à fluorescence, de réaliser un marquage de l'échantillon par immunofluorescence D. Il est toujours nécessaire de réaliser des coupes histologiques ultrafines, après fixation et inclusion en résine, pour observer un échantillon en microscopie électronique E. La technique de cytométrie en flux nécessite une dissociation préalable des tissus solides pour mettre en suspension les cellules25. La préparation standard d'un fragment d'organe pour son observation
en microscopie optique nécessite: A. Une fixation qui permet de préserver les activités biologiques B. Une inclusion ou une congélation pour durcir l'échantillon afin d'en permettre la coupe C. La réalisation de coupes à l'aide d'un ultramicrotomeD. Une coloration pour augmenter les contrastes
E. Le montage des coupes sur grilles
26. A propos des méthodes d'études en histologie
A. Dans une technique d'hybridation in situ, il est possible que la sonde soit révélée à l'aide d'un anticorps marqué B. Le GFP (Green Fluorescent Protein) est un traceur fluorescent rouge C. La microscopie confocale est une microscopie à fluorescence D. La coloration du glycogène par le PAS (acide periodique et réactif de Schiff) est abolie par l'action préalable de la diastase E. La coloration usuelle pour un frottis cervico-vaginal est le trichrome deMasson
27. Parmi les techniques suivantes, laquelle(lesquelles) est(sont) adaptée(s)
pour la détection et la localisation de protéines membranairesA. Immunofluorescence
B. Hybridation in situ
C. Immunohistochimie avec marquage à l'or colloïdalD. Cytométrie en flux
E. Coloration de Perls
16 | QCM Histologie
28. La microscopie
A. Les microscopies optiques utilisent un éclairage de l'objet par une lumière blanche B. Le pouvoir de grandissement d'un microscope correspond à la distance qui permet de distinguer deux points distants C. Les microscopes électroniques permettent un grossissement jusqu'à 200 fois supérieur aux microscopes optiques D. Les microscopies optiques, comme électroniques, sont toujours basées sur la transmission de photons, ou d'électrons, au travers de l'objet observé E. La microscopie est une étape incontournable pour la réalisation des études macroscopiques à partir d'un prélèvement tissulaire29. Sont visibles en microscopie optique
A. Les cellules eucaryotes
B. Les ribosomes
C. Les virus
D. Les bactéries
E. Les noyaux cellulaires
30. La microscopie
A. En microscopie optique l'image observée correspond à des photons émis par la source lumineuse qui traversent la préparation B. Les objectifs d'un microscope optique peuvent grossir jusqu'à 1500 fois C. Le pouvoir séparateur de l'oeil atteint 0,22 micromètre D. L'analyse en microscopie électronique nécessite une inclusion en paraffine E. La microscopie électronique permet un grossissement de 100 000 fois31. Les microscopies
A. La microscopie optique à fond claire nécessite toujours de faire appel à des colorations pour augmenter le contraste des tissus et des cellules B. Il est possible d'utiliser un microscope optique inversé à contraste de phase pour observer des cellules vivantes C. Il est nécessaire, pour la microscopie à fluorescence, de réaliser un marquage de l'échantillon par immunofluorescence D. Pour la microscopie électronique à transmission il est possible de visualiser un marqueur fluorescent E. En microscopie confocale, un système de trou d'aiguille (pin hole) permet de sélectionner spécifiquement les rayons fluorescents à partir d'un seul plan focal, en éliminant ceux des autres plans focauxquotesdbs_dbs44.pdfusesText_44[PDF] coupe au microtome
[PDF] huile de paraffine
[PDF] argumenter un texte seconde
[PDF] graphique proportionnel
[PDF] coefficient de proportionnalité
[PDF] exemple de situation de proportionnalité
[PDF] exemple de proportionnalité dans la vie courante
[PDF] exemple de non proportionnalité
[PDF] réponse négative candidature spontanée
[PDF] navigateur portugais du xv siecle 3 lettres
[PDF] le temps de la révolution et de l'empire cm1
[PDF] évaluation révolution industrielle cm2
[PDF] le temps de la république
[PDF] de la restauration au second empire cm2 evaluation
