 JOULE 210X275+NOTO_chimie_atkins_jones
JOULE 210X275+NOTO_chimie_atkins_jones
Le Dr Joule a dispensé de nombreux cours sur la chimie des hétérocycles à un publique industriel et académique au. Royaume-Uni et ailleurs. Il est
 cours de COH_master2 LCBOSN nvx
cours de COH_master2 LCBOSN nvx
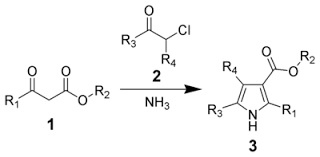
❖ PYRROLE. Il est aromatique. Page 9. Prof. BEKRO Y. A. / Prof. MAMYRBEKOVA BEKRO/Chimie organique hétérocyclique/Master2.
 Chimie organique heterocyclique
Chimie organique heterocyclique
Enfin quelques lignes retracent I'histoire de la chimie heterocyclique. Pour realiser cet ouvrage
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
Les règles de nomenclature UICPA pour les hétérocycles ne seront pas traitées dans ce programme cependant on donnera quelques noms triviaux des hétérocycles.
 Présentation
Présentation
1 sept. 2021 Ce cours aborde de façon concise et systématique tous les aspects de la chimie des hétérocycles de la nomenclature aux applications comme ...
 Chapitre 8: HETEROCYCLES SATURES
Chapitre 8: HETEROCYCLES SATURES
→ un quart des publications de chimie organique. ➢ Hétéroatomes les plus INTRODUCTION A LA CHIMIE DES HETEROCYCLES. 1- Cycles à 3 ou 4 sommets. 1-1 ...
 Notes cours
Notes cours
Chimie organique hétérocyclique: structures fondamentales chimie et biochimie des principaux composés naturels; Milcent
 Hétérocycles dérivés de limidazoline et de la pyrimidine: nouvelles
Hétérocycles dérivés de limidazoline et de la pyrimidine: nouvelles
10 jui. 2014 aziridine cependant n'a été isolée au cours de ces réactions (29). ... International de Chimie Hétérocyclique Tokyo (1983) p. f.J.96. 180 ...
 Cours de Chimie organométallique
Cours de Chimie organométallique
Cas des carbènes : Les carbènes N-hétérocycliques (NHC) sont σ-donneurs et très faiblement π-accepteurs. Page 26. 26. II- Les liaisons métal-ligand. La liaison
 Synthèse dhétérocycles spiraniques à visée thérapeutique
Synthèse dhétérocycles spiraniques à visée thérapeutique
31 mai 2017 hétérocycliques antérieurement élaborés au sein du laboratoire ou synthétisé au cours de ce travail ... chimie de spécialité et chimie fine ...
 Notes cours
Notes cours
Un carbone à la jonction de cycle porte le numéro de l'atome qui le précède suivi de la lettre a (figure 2.8). Page 26. CHIMIE ORGANIQUE HÉTÉROCYCLIQUE. COR
 cours de COH_master2 LCBOSN nvx
cours de COH_master2 LCBOSN nvx
COURS DE CHIMIE ORGANIQUE HETEROCYCLIQUE. MASTER 2-Chimie et Physico-chimie des substances naturelles. LCBOSN. Programme. Introduction. Hétérocycles à cinq
 JOULE 210X275+NOTO_chimie_atkins_jones
JOULE 210X275+NOTO_chimie_atkins_jones
Le Dr Joule a dispensé de nombreux cours sur la chimie des hétérocycles à un publique industriel et académique au. Royaume-Uni et ailleurs.
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
Les règles de nomenclature UICPA pour les hétérocycles ne seront pas traitées dans ce programme cependant on donnera quelques noms triviaux des hétérocycles. N.
 Cours de Chimie Hétérocyclique 2014/2015
Cours de Chimie Hétérocyclique 2014/2015
???? ??? ??????. -. ??????. Université d'El oued. COURS DE. CHIMIE HETEROCYCLIQUE. Master 2 : Chimie Organique. Analytique
 Chapitre 8: HETEROCYCLES SATURES
Chapitre 8: HETEROCYCLES SATURES
INTRODUCTION A LA CHIMIE DES HETEROCYCLES. 1- Cycles à 3 ou 4 sommets. 1-1- Relations structure-réactivité un quart des publications de chimie organique.
 Association Tunisienne de Chimie Hétérocyclique et ses
Association Tunisienne de Chimie Hétérocyclique et ses
23 mai 2021 La participation par Webinaire au CMCH 4-2021 se fait en français ou anglais. Les manifestations sont des : 1) Conférences ;.
 Untitled
Untitled
Chimie organique heterocyclique. Structures fondamentales. Chimie et biochimie des principaux composes naturels. ReneMILCENT.
 Dr LARAOUI Habiba
Dr LARAOUI Habiba
Cours de chimie organique heterocyclique master-2 Chimie et Physico-chimie des substances naturelles. LCBOSN. 10. Stéphane Quideau. La Chimie Organique dans la
 UNIVERSITE PARIS 5 (RENE DESCARTES) Référence GALAXIE
UNIVERSITE PARIS 5 (RENE DESCARTES) Référence GALAXIE
8 janv. 2018 chimie générale et organique en exercices dirigés (ED) et cours ... aspects déjà développés au sein de l'unité (chimie hétérocyclique ...
 [PDF] hétérocyclique - Furet du Nord
[PDF] hétérocyclique - Furet du Nord
Le Dr Joule a dispensé de nombreux cours sur la chimie des hétérocycles à un publique industriel et académique au Royaume-Uni et ailleurs
 [PDF] cours-de-COH_master2-20170809-LCBOSN-nvxpdf
[PDF] cours-de-COH_master2-20170809-LCBOSN-nvxpdf
COURS DE CHIMIE ORGANIQUE HETEROCYCLIQUE MASTER 2-Chimie et Physico-chimie des substances naturelles LCBOSN Programme Introduction Hétérocycles à cinq
 [PDF] Chimie organique heterocyclique - Numilog
[PDF] Chimie organique heterocyclique - Numilog
1) Le systeme est dessine selon les dispositions suivantes : I'heterocycle est a droite du cycle benzenique et I'heteroatome est situe si possible vers le
 [PDF] Chimie des hétérocycles aromatiques -:: UMI E-Learning ::
[PDF] Chimie des hétérocycles aromatiques -:: UMI E-Learning ::
Chap 3: Isoxazoles Pyrazoles et Isothiazoles ou 12 azoles La chimie hétérocyclique est une vaste et importante branche de la chimie organique Les
 Cours de Chimie Heterocyclique PDF Hétérocycle Pyridine - Scribd
Cours de Chimie Heterocyclique PDF Hétérocycle Pyridine - Scribd
SYNTHÈSE REACTIVITÉ ET PROPRIETES PHYSICO-CHIMIQUES DES COMPOSÉS HÉTÉROCYCLIQUES Á 5 ET 6 CHAÎNOS 14 Cours de Chimie Hétérocyclique 2014/2015 I PYRROLE
 [PDF] Dr LARAOUI Habiba
[PDF] Dr LARAOUI Habiba
Support du cours officiel de la matière Chimie Organique Approfondie 1 hétérocycles où leur description et leur réactivité ont été discutées
 [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
IV-1- Les homocycles IV-2- Les cycles aromatiques IV-3- Les hétérocycles V/ NOMENCLATURE DES FONCTIONS SIMPLES ET MULTIPLES V-1- Les alcools : R-OH
 [PDF] Chimie Hétérocyclique Moderne - Faculté des Sciences dOrsay
[PDF] Chimie Hétérocyclique Moderne - Faculté des Sciences dOrsay
Le cours sera illustré d'exercices et d'exemples Jour 1 : Synthèse Hétérocyclique + Rappel sur les hétérocycles : structure propriétés et synthèses
 [PDF] Télécharger Livre de Chimie organique heterocyclique
[PDF] Télécharger Livre de Chimie organique heterocyclique
[PDF] Télécharger Livre Gratuit: Chimie organique heterocyclique : Structures fondamentales chimie et biochimie des principaux composes naturels
Quels sont les éléments de la chimie organique ?
Plus d'un million de corps sont connus et ce nombre ne cesse de croître, et cela bien que les composés organiques ne renferment qu'un très petit nombre d'éléments différents : outre le carbone, on trouve principalement de l'hydrogène, de l'azote, de l'oxygène, des halogènes et, plus rarement, du soufre, du phosphore,Pourquoi la chimie organique est la chimie du carbone ?
La chimie organique se définit maintenant simplement par l'étude des composés à base de carbone autres que les oxydes de carbone, les cyanures, les carbonates et les carbures autres que les hydrocarbures. On l'appelle également la chimie du carbone (voir aussi Composé organique).Comment nommer les heterocycles ?
En nomenclature systématique, le nom d'un hétérocycle est formé à partir du nom du carbocycle correspondant auquel on ajoute un préfixe pour identifier l'hétéroatome : oxa- pour l'oxygène, thia- pour le soufre et aza- pour l'azote.Numérotation du cycle pour positionner les substituants
1La numérotation des atomes de carbone se fait en commen?nt par une tête de pont , numérotée 1.2On continue ensuite le long de la plus longue chaîne jusqu' à l' autre tête de pont.3Puis on continue sur la plus longue branche restante vers l 'atome de départ.
UNIVERSITE CADI AYYAD
Faculté Polydisciplinaire
SafiDépartement de Chimie
COURS DE CHIMIE ORGANIQUE
Semestre 2
SVIPréparé par :
Moulay Rachid LAAMARI
2016-2017
SOMMAIRE
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUEII-1- Orbitales atomiques (OA)
II-2- Valence du carbone
II-3- Hybridation du carbone
II-4- Liaisons covalentes
II-5- Comparaison entre sp3, sp2 et sp du carbone
II-6-Chapitre II : ECRITURE DES FORMULES ET FONCTIONS
EN CHIMIE ORGANIQUE
I/ ECRITURE DES FORMULES
I-1- Formule brute
I-2- Formule développée plane (FDP)
I-3- Formule semi-développée (FSD)
I-4- Formule simplifiée (FS)
II/ DIVERSES FONCTIONS ET GROUPEMENT FONCTIONNELS
II-1-II-2- Principales fonctions organiques
II-2-4- Fonctions tétravalentes
Chapitre III : PRINCIPALES REGLES DE NOMENCLATURE
DES COMPOSES ORGANIQUES
I/ NOMENCLATURE DES ALCANES ACYCLIQUES
I-1- Alcanes à chaîne linéaire
I-2- Alcanes à chaîne ramifiée
II/ NOMENCLATURE DES HYDROCARBURES ACYCLIQUES INSATURESII-1- Les alcènes : CnH2n
II-2- les alcynes : CnH2n-2
III/ NOMENCLATURE DES DERIVES HALOGENES (R-X)
IV/ NOMENCLATURE DES COMPOSES CYCLIQUES
IV-1- Les homocycles
IV-2- Les cycles aromatiques
IV-3- Les hétérocycles
V/ NOMENCLATURE DES FONCTIONS SIMPLES ET MULTIPLESV-1- Les alcools : R-OH
V-2- Les éthers (oxydes) : R-O-
V-3- Les amines
V-4- Les cétones : R-COR' avec R et R'
HV-5- Les aldéhydes : R-CHO
V-6- Acides carboxyliques : R-COOH
V-7- Dérivées des acides carboxyliques
VI/ NOMENCLATURE DES COMPOSES A PLUSIEURS FONCTIONSChapitre IV : ISOMERIE PLANE
I/ ISOMERIE DE CONSTITUTION
I-1-I-2- Isomérie de position
I-3- Isomérie de fonction
II/ ISOMERIE TAUTOMERIE
II-1-Tautomérie des aldéhydes et des cétonesII-2-Tautomérie des amides
II-3-Tautomérie des imines
Chapitre V : STEREOCHIMIE ISOMERIE CONFORMATIONNELLEI/ REPRESENTATION DES MOLECULES ACYCLIQUES
I-1- Molécule contenant un carbone sp3
I-2- Molécule contenant deux carbones sp3
I-3- Analyse conformationnelle des chaînes saturées aliphatiques II/ REPRESENTATON DES MOLECULES CYCLIQUES SATUREESII-1- Cyclopropane
II-2- Cyclobutane
II-3- cyclopentane
II-4- Cyclohexane
Chapitre VI : ISOMERIE OPTIQUE
I/ CHIRALITE
II/ MOLECULES CONTENANT UN SEUL CARBONE ASYMETRIQUEIII/ CONFIGURATIONS ABSOLUES R ET S
III-1- Règles de Cahn-Ingold et Prelog
III-2- Examen de la molécule
III-3- Projection de Fischer
IV/ Composés CONTENANT deux carbones asymétriques IV-1- Molécules possédant deux *C différents IV-2- Molécules possédant deux *C identiques CHAPITRE VII : ISOMERIE GEOMETRIQUE CISTRANS OU Z-EI/ ISOMERIE GEOMETRIQUE POUR LES ALCENES
I-1- ISOMERIE CIS-TRANS
I-2- ISOMERIE Z-E
II/ ISOMERIE GEOMETRIQUE CIS-TRANS POUR LES CYCLOALCANESII-1-DIMETHYLCYCLOBUTANE
II-2- DIMETHYLCYCLOHEXANE
CHAPITRE VIII : EFFETS ELECTRONIQUES
I/ EFFET INDUCTIF
I-1- E-I)
I-2-I-3- CONSEQUENCES DES EFFETS INDUCTIFS
II/ CONJUGAISON ET AROMATICITE
II-1- CONJUGAISON
II-2- AROMATICITE
III/ EFET MESOMERE
III-1- EFFET MESOMERE ATTRACTEUR (-M)
III-2- EFFET MESOMERE DONNEUR (+M)
Chapitre I : INTRODUCTION A LA CHIMIE ORGANIQUE
I/ COMPOSES ORGANIQUES
Les composés organiques sont des composés qui contiennent essentiellement du carbone sauf le monoxyde de carbone (CO), le dioxyde de carbone (CO2), les carbonates (K2CO3, Na2CO3, NaHCO3), les cyanures (KCN, NaCN), le dissulfure (CS2) et les carbures (CaC2) qui sont des composés inorganiques. Les composés organiques sont formés de liaisons covalentes. Ils sont rarement soluble dans l'eau et se décomposent facilement par la chaleur.Leurs densités sont voisines de l'unité.
II/ NATURE ELECTRONIQUE DES LIAISONS EN CHIMIE ORGANIQUE Pour décrire la nature des liaisons C-C et/ou C-H, on utilise la notion dépendent des nombres quantiques n, l et m (voir cours de chimie généraleI S1).
n : nombre quantique principale n>0, il détermine la distance moyenne entre l : 0< l < n, nombre quantique secondaire ou azimutal, il définit la sous couche, l = 0 orbitale s l = 1 orbitale p, etc. m : -l < m < l, nombre quantique magnétique, il définit la case quantique, à un niveau l correspond (2l + 1) valeurs (cases) de m.II-1- Orbitales atomiques (OA)
y a une grande proba organique sont s et p.II-1-1-
de la classification périodique des éléments. Il a sa couche externe à moitié remplie. Pour compléter sa couche périphérique, il pourra se lier à lui mêmeH He
Li Be B 6C N O F Ne
Na Mg Al Si P S Cl Ar
Le numéro atomique du carbone est 6 par conséquent sa structureélectroniques est 1s22s22p2.
II-1-2- Formes des OA du carbone
O. s y z x -1, 0, 1) correspond à 3 orbitales px, py et pz. Ces dernières ont chacune deux lobes et leurs axes de symétrie respectifs Ox, Oy et Oz sont perpendiculaires entre eux.Remarque: Le noyau se tr
II-2- Valence du carbone
r avec La configuration électronique externe du carbone à l'état fondamental est 2s22p2.2p22s2
Cette valence (VC = 2) permet la formation des molécules instables car la couche périphérique du carbone est incomplète (6e-, il faut 8e-).Exemple : CCl2
Octet (8e- sur la couche externe), le carbone
doit faire 4 liaisons donc il doit avoir 4 électrons célibataires sur sa couche externe (VC = 4). Pour cela, le carbone doit être dans un état excité c-à-d un électron de la sous couche 2s passe à la sous couche 2p.2p22s22p32s1
Excitation
Etat fondamentalEtat excité
Exemple : CH4 (8e- autour du carbone donc sa couche périphérique est saturée).Cette hypothèse tétravalence du
carbone (VC = 4) mais non pas sa géométrie qui se traduit parII-3- Hybridation du carbone
Une combinaison linéaire des OA conduit aux orbitales dites orbitales hydrides (OH) spatialement et énergétiquement équivalentes entre elles.2px 2py 2pz2s1
Etat excité
Par des différentes combinaisons linéaires des OA du carbone, on peut avoir3, sp2 et sp.
II-3-1- Hybridation sp3
re que les quatre liaisons C-H du méthane (CH4) sont identiques et indiscernables. Chacune forme avec les trois autres le même 2py et 2pz) du carbone subissent une combinaison linéaire pour donner 4 orbitales hybrides (OH). Cette combinaison met en jeu une orbitale s et 3 orbitales p pour conduire à quatre orbitales hybrides sp3 équivalentes.1 s+3 p4 sp3(4 OH)
px y z x pypz109°28'
sp3sp3 sp3 sp3 s Le carbone hybridé sp3 possède une géométrie tétraédrique.Remarque
II-3-2- Hybridation sp2
La combinaison linéaire met en jeu une orbitale s et deux orbitales p pour conduire à trois orbitales hybrides sp2 équivalentes dont leurs axes de inchangée et son axe de symétrie est perpendiculaire au plan des axes des orbitales hybrides sp2.1 s+2 p3 sp2(3 OH)
z pz120°
sp2 sp2 sp2 Le carbone hybridé sp2 possède une géométrie triangulaire.II-3-3- Hybridation sp
Elle met en jeu une orbitale s et une orbitale p pour conduire à deux orbitales hybrides sp dont les axes forment un angle de 180° et sont confondus. Les deux autres orbitales atomiques p (py et pz) restent naturelles et sont perpendiculaires aux deux orbitales hybrides sp.1 s+1 p2 sp(2 OH)
py pz spsp Le carbone hybridé sp possède une géométrie linéaire.II-4- Liaisons covalentes
Le carbone, situé sur la colonne centrale de la classification périodique, peut se lier à peut se lier à lui même, aux éléments de la mê des liaisons covalentes et . Une liaison covalente vient du recouvrement axial de deux orbitales hybrides (sp, sp2, sp3) dans le cas de la liaison C- et une orbitale s dans le cas de la liaison C-H. Une liaison covalente vient du recouvrement latéralII-4-1- Recouvrement axial
par rapport à ce même axe. Il aboutit à la formation de liaison covalente .Exemple 1 : méthane CH4 (4)
sp3sp3 sp3 sp3 s Csp3H HH H109°28'
La géométrie de CH4est tétraédrique
C H H H H +4H Conclusion : Un atome de carbone entouré de 4 liaisons est hybridé en sp3.Exemple 2 : éthane CH3-CH3
Chaque carbone est entouré de 3 liaisons (C-H) et une liaison (C-C). HH HH HHquotesdbs_dbs12.pdfusesText_18[PDF] clayden organic chemistry pdf
[PDF] nomenclature chimie organique exercices corrigés
[PDF] nomenclature chimie organique priorité
[PDF] nomenclature chimie exercices
[PDF] qcm chimie organique pdf
[PDF] qcm paces ue1
[PDF] atomistique cours et exercices corrigés pdf
[PDF] les alcools exercices corrigés pdf
[PDF] cours de chimie organique generale pdf
[PDF] chimie organique terminale s exercice
[PDF] chimie terminale d pdf
[PDF] fiche chimie terminale s
[PDF] tout en un physique psi pdf
[PDF] fiche chimie organique pcsi
