 JOULE 210X275+NOTO_chimie_atkins_jones
JOULE 210X275+NOTO_chimie_atkins_jones
Le Dr Joule a dispensé de nombreux cours sur la chimie des hétérocycles à un publique industriel et académique au. Royaume-Uni et ailleurs. Il est
 cours de COH_master2 LCBOSN nvx
cours de COH_master2 LCBOSN nvx
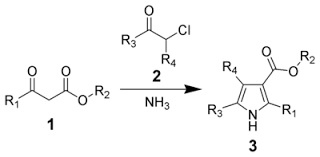
❖ PYRROLE. Il est aromatique. Page 9. Prof. BEKRO Y. A. / Prof. MAMYRBEKOVA BEKRO/Chimie organique hétérocyclique/Master2.
 Chimie organique heterocyclique
Chimie organique heterocyclique
Enfin quelques lignes retracent I'histoire de la chimie heterocyclique. Pour realiser cet ouvrage
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
Les règles de nomenclature UICPA pour les hétérocycles ne seront pas traitées dans ce programme cependant on donnera quelques noms triviaux des hétérocycles.
 Présentation
Présentation
1 sept. 2021 Ce cours aborde de façon concise et systématique tous les aspects de la chimie des hétérocycles de la nomenclature aux applications comme ...
 Chapitre 8: HETEROCYCLES SATURES
Chapitre 8: HETEROCYCLES SATURES
→ un quart des publications de chimie organique. ➢ Hétéroatomes les plus INTRODUCTION A LA CHIMIE DES HETEROCYCLES. 1- Cycles à 3 ou 4 sommets. 1-1 ...
 Notes cours
Notes cours
Chimie organique hétérocyclique: structures fondamentales chimie et biochimie des principaux composés naturels; Milcent
 Hétérocycles dérivés de limidazoline et de la pyrimidine: nouvelles
Hétérocycles dérivés de limidazoline et de la pyrimidine: nouvelles
10 jui. 2014 aziridine cependant n'a été isolée au cours de ces réactions (29). ... International de Chimie Hétérocyclique Tokyo (1983) p. f.J.96. 180 ...
 Cours de Chimie organométallique
Cours de Chimie organométallique
Cas des carbènes : Les carbènes N-hétérocycliques (NHC) sont σ-donneurs et très faiblement π-accepteurs. Page 26. 26. II- Les liaisons métal-ligand. La liaison
 Synthèse dhétérocycles spiraniques à visée thérapeutique
Synthèse dhétérocycles spiraniques à visée thérapeutique
31 mai 2017 hétérocycliques antérieurement élaborés au sein du laboratoire ou synthétisé au cours de ce travail ... chimie de spécialité et chimie fine ...
 Notes cours
Notes cours
Un carbone à la jonction de cycle porte le numéro de l'atome qui le précède suivi de la lettre a (figure 2.8). Page 26. CHIMIE ORGANIQUE HÉTÉROCYCLIQUE. COR
 cours de COH_master2 LCBOSN nvx
cours de COH_master2 LCBOSN nvx
COURS DE CHIMIE ORGANIQUE HETEROCYCLIQUE. MASTER 2-Chimie et Physico-chimie des substances naturelles. LCBOSN. Programme. Introduction. Hétérocycles à cinq
 JOULE 210X275+NOTO_chimie_atkins_jones
JOULE 210X275+NOTO_chimie_atkins_jones
Le Dr Joule a dispensé de nombreux cours sur la chimie des hétérocycles à un publique industriel et académique au. Royaume-Uni et ailleurs.
 COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
Les règles de nomenclature UICPA pour les hétérocycles ne seront pas traitées dans ce programme cependant on donnera quelques noms triviaux des hétérocycles. N.
 Cours de Chimie Hétérocyclique 2014/2015
Cours de Chimie Hétérocyclique 2014/2015
???? ??? ??????. -. ??????. Université d'El oued. COURS DE. CHIMIE HETEROCYCLIQUE. Master 2 : Chimie Organique. Analytique
 Chapitre 8: HETEROCYCLES SATURES
Chapitre 8: HETEROCYCLES SATURES
INTRODUCTION A LA CHIMIE DES HETEROCYCLES. 1- Cycles à 3 ou 4 sommets. 1-1- Relations structure-réactivité un quart des publications de chimie organique.
 Association Tunisienne de Chimie Hétérocyclique et ses
Association Tunisienne de Chimie Hétérocyclique et ses
23 mai 2021 La participation par Webinaire au CMCH 4-2021 se fait en français ou anglais. Les manifestations sont des : 1) Conférences ;.
 Untitled
Untitled
Chimie organique heterocyclique. Structures fondamentales. Chimie et biochimie des principaux composes naturels. ReneMILCENT.
 Dr LARAOUI Habiba
Dr LARAOUI Habiba
Cours de chimie organique heterocyclique master-2 Chimie et Physico-chimie des substances naturelles. LCBOSN. 10. Stéphane Quideau. La Chimie Organique dans la
 UNIVERSITE PARIS 5 (RENE DESCARTES) Référence GALAXIE
UNIVERSITE PARIS 5 (RENE DESCARTES) Référence GALAXIE
8 janv. 2018 chimie générale et organique en exercices dirigés (ED) et cours ... aspects déjà développés au sein de l'unité (chimie hétérocyclique ...
 [PDF] hétérocyclique - Furet du Nord
[PDF] hétérocyclique - Furet du Nord
Le Dr Joule a dispensé de nombreux cours sur la chimie des hétérocycles à un publique industriel et académique au Royaume-Uni et ailleurs
 [PDF] cours-de-COH_master2-20170809-LCBOSN-nvxpdf
[PDF] cours-de-COH_master2-20170809-LCBOSN-nvxpdf
COURS DE CHIMIE ORGANIQUE HETEROCYCLIQUE MASTER 2-Chimie et Physico-chimie des substances naturelles LCBOSN Programme Introduction Hétérocycles à cinq
 [PDF] Chimie organique heterocyclique - Numilog
[PDF] Chimie organique heterocyclique - Numilog
1) Le systeme est dessine selon les dispositions suivantes : I'heterocycle est a droite du cycle benzenique et I'heteroatome est situe si possible vers le
 [PDF] Chimie des hétérocycles aromatiques -:: UMI E-Learning ::
[PDF] Chimie des hétérocycles aromatiques -:: UMI E-Learning ::
Chap 3: Isoxazoles Pyrazoles et Isothiazoles ou 12 azoles La chimie hétérocyclique est une vaste et importante branche de la chimie organique Les
 Cours de Chimie Heterocyclique PDF Hétérocycle Pyridine - Scribd
Cours de Chimie Heterocyclique PDF Hétérocycle Pyridine - Scribd
SYNTHÈSE REACTIVITÉ ET PROPRIETES PHYSICO-CHIMIQUES DES COMPOSÉS HÉTÉROCYCLIQUES Á 5 ET 6 CHAÎNOS 14 Cours de Chimie Hétérocyclique 2014/2015 I PYRROLE
 [PDF] Dr LARAOUI Habiba
[PDF] Dr LARAOUI Habiba
Support du cours officiel de la matière Chimie Organique Approfondie 1 hétérocycles où leur description et leur réactivité ont été discutées
 [PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
[PDF] COURS DE CHIMIE ORGANIQUE Semestre 2 SVI
IV-1- Les homocycles IV-2- Les cycles aromatiques IV-3- Les hétérocycles V/ NOMENCLATURE DES FONCTIONS SIMPLES ET MULTIPLES V-1- Les alcools : R-OH
 [PDF] Chimie Hétérocyclique Moderne - Faculté des Sciences dOrsay
[PDF] Chimie Hétérocyclique Moderne - Faculté des Sciences dOrsay
Le cours sera illustré d'exercices et d'exemples Jour 1 : Synthèse Hétérocyclique + Rappel sur les hétérocycles : structure propriétés et synthèses
 [PDF] Télécharger Livre de Chimie organique heterocyclique
[PDF] Télécharger Livre de Chimie organique heterocyclique
[PDF] Télécharger Livre Gratuit: Chimie organique heterocyclique : Structures fondamentales chimie et biochimie des principaux composes naturels
Quels sont les éléments de la chimie organique ?
Plus d'un million de corps sont connus et ce nombre ne cesse de croître, et cela bien que les composés organiques ne renferment qu'un très petit nombre d'éléments différents : outre le carbone, on trouve principalement de l'hydrogène, de l'azote, de l'oxygène, des halogènes et, plus rarement, du soufre, du phosphore,Pourquoi la chimie organique est la chimie du carbone ?
La chimie organique se définit maintenant simplement par l'étude des composés à base de carbone autres que les oxydes de carbone, les cyanures, les carbonates et les carbures autres que les hydrocarbures. On l'appelle également la chimie du carbone (voir aussi Composé organique).Comment nommer les heterocycles ?
En nomenclature systématique, le nom d'un hétérocycle est formé à partir du nom du carbocycle correspondant auquel on ajoute un préfixe pour identifier l'hétéroatome : oxa- pour l'oxygène, thia- pour le soufre et aza- pour l'azote.Numérotation du cycle pour positionner les substituants
1La numérotation des atomes de carbone se fait en commen?nt par une tête de pont , numérotée 1.2On continue ensuite le long de la plus longue chaîne jusqu' à l' autre tête de pont.3Puis on continue sur la plus longue branche restante vers l 'atome de départ.
REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
UNIVERSITE MOHAMED KHIDER DE BISKRA
FACULTE DES SCIENCES EXACTES ET SCIENCES DE LA NATURE ET DE LA VIEDEPARTEMENT DES SCIENCES DE LA MATIERE
2020/2021
Support du cours
Matière : Chimie Organique Approfondie 1
3ème Année Licence Chimie Pharmaceutique
Dr LARAOUI Habiba
2PREFACE
Le présent polycopié est destiné principalement comme support pédagogique aux étudiants en troisième année Licence Chimie Pharmaceutique. Il contient le programme officiel de la matière Chimie Organique Approfondie 1. Le contenu de cette matière peut également aider les étudiants de biologie, de pharmacie, etcà une bonne compréhension de la matière. Ce polycopié de trois parties principales. La première partie estconsacrée à un rappel sur les réactions de base en chimie organique, notamment : les réactions
de substitution nucléophile (SN) sur les dérivés halogénésRX En plus, des définitions claires et des
notions de base appropriées sont inclus. Dans la deuxième partie, les composés aromatiquessont abordés sous différents point de vue (préparations, propriétés physiques, réactivités
chimiques, etc). La dernière partie qui est la plus importante englobe une série des
hétérocycles où leur description et leur réactivité ont été discutées.Ce modeste polycopié a été expertisé sérieusement par les collègues Pr MELKEMI
pour toutes recevoir plus de commentaires et decritiques de la part de nos lecteurs, en particulier, les collègues enseignants chercheurs
spécialistes en chimie organique. 3Sommaire
CHAPITRE I : Réactions de base en chimie organiqueI.1. Réactions de substitution nucléophile6
I.1.1. Réactions de substitution nucléophile monomoléculaire SN8 I.1.2. Réactions de substitution nucléophile bimoléculaire SN214I.2. ȕ-élimination et compétition SN/E18
I.2.1. E119
I.2.2. E2 21
I.2.3. 23
I.3. Réactions de substitution nucléophile sur un carbone hybridésp223I.3.1. 23
I.3.2. 24
I.3.3. ....25
I.4. .26
I.4.1. Additions électrophiles sur les alcènes.26 I.4.2. Additions électrophiles sur les alcynes 33 I.4.3. Additions électrophiles sur les systèmes conjugués35CHAPITRE II : Composés aromatiques
II.1. Hydrocarbures aromatiques40
II.2. Substitutions 40
II.3. 43
II.4. Autres 47
II.5. Dérivés phénoliques et quinones49
II.5.1. Phénols49
II.5.2. 56
II.6. 59
4CHAPITRE III : Hétérocycles
III.1. Généralités67
III.2. Nomenclature des hétérocycles67
III.3. Hétérocycles à cinq chainons74
III.3.1. Pyrrolidine et ses dérivés74
III.3.2. Imidazole et ses dérivés76
III.4. Hétérocycles à six chainons79
III.4.1. Pyridine, pipéridine et leurs dérivés79 III.4.2. Acide barbiturique et ses dérivés84 III.5. Hétérocycles à cinq chainons benzéniques85III.5.1. Indoles.85
III.6. Hétérocycles à six chainons benzéniques90III.6.1. Quinoléines et isoquinoléines90
III.7. Hétérocycles à plusieurs hétéroatomes95III.7.1. Benzodiazépines et dérivés.95
III.7.2. Phénothiazines et dérivés.96
III.7.3. Antibiotiques-lactames.97
Références 99
5CHAPITRE I
REACTIONS DE BASE EN CHIMIE ORGANIQUE
REACTIONS DE BASE EN CHIMIE ORGANIQUE
6 I.1. Réactions de substitution nucléophile (SN)AN par un élément riche en
électrons " molécule neutre ou anion » et de départ nucléofuge DNLe bilan réactionnel de la SN est
le suivant : a) Réactifs nucléophilesUn réactif est dit nucléophile
une liaison covalente, soit avec un atome déficitaire en électrons comme le proton H+, soitélectrophile
structure moléculaire, soit une charge négative (anion) portée par un hétéroatome (ion
hydroxyde OH-, ion alcoolate RO-, ion thiolate RS-, ion cyanure CN-, ion amidure NH2-, ion azoture N3-) ou par un atome de carbone (carbanion R3C-), soit un ou plusieurs sites à forte densité électronique (H2O, NH3, H2S, R3P, ). b) Réactifs électrophiles pauvres en électrons,une liaison covalente. Les électrophiles contiennent une charge positive portée par un
hétéroélément (NO2+, Br+, R-N=N+, ), un proton H+, carbocation R3C+, ou bien un site à
faible densité électronique (acide de Lewis : AlCl3, ZnCl2, BF3 des fonctions carbonylés (R2C=O), nitrile (R-CN) et imine (R2C=N-).REACTIONS DE BASE EN CHIMIE ORGANIQUE
7 c) Composés halogénés (R-X) nH2n+1X ouR-X dont R : groupement alkyle et X : halogène (Cl, Br, I). Ce sont des composés saturés, ils
des substitutions ou des éliminations. C-X) est hétérolytique (ou ionique). Donc, les dérivéshalogénés se prêtent bien à ce genre de réactions de substitution, du fait de la polarisation et
de la polarisabilité de ce type de liaison.La polarisation de la liaison carbone-
des atomes " C » et " X ». En effet, cette liaison se comporte comme un petit dipôle électrique
rtielle négative " į », à cause de soncharge partielle positive " į »). Ceci indique que cette liaison est polarisée et la molécule
RX possède un moment dipolaire permanent.
r-X est polarisable et son déplacement est facile.Augmentation de la taille de X
C-F C-Cl C-Br C-I
Augmentation de la force du lien
REACTIONS DE BASE EN CHIMIE ORGANIQUE
8 d) Les groupes partants (Nucléofuge)Les groupes partants, ou nucléofuge " X », sont libérés comme anion X-, après une
rupture hétérolitique de la liaison C-X. On peut citer : : I- > Br - > Cl- >> F- Le groupe " OH » étant un très mauvais groupe partant, il est converti par actionExemple:
R-X (X: -OSO2ArMe " OTs; Tosylate », -OSO2ArBr "OBs; Brosylate », -OSO2ArNO2 "OTs; Nosylate », -OSO2Me "-OMs; Mésylate », -OSO2CF3 " -OTf; Triflate».Les triflates sont des meilleurs groups partants.
OCO2R (esters) ou les sels amines quaternaires R3N+ dans le cas où le mauvais groupe partant est une amine. I.1.1. Réaction de substitution nucléophile monomoléculaire (SN1) a) Mécanisme réactionnel La SN1 est caractérisée par un mécanisme constitué de deux étapes distinctes :1ère Etape (lente) : carbocation plan »
REACTIONS DE BASE EN CHIMIE ORGANIQUE
9 Dans cette étape (lente et limitante par sa vitesse) la liaison C-X est fortement polarisée en raison de la nature du groupe partant " X s " į » portées par leshydrogènes permettent des interactions avec " X » chargé négativement " - į » avec
formation de liaison hydrogène. Les solvants utilisés dans ce type de réaction sont le plus souvent les alcools (MeOH, (CH3COCH3/H2O). La formation du carbocation est favorisée lorsque le carbone fonctionnel est tertiaire.2ème Etape (rapide) : attaque du réactif nucléophile sur le carbocation plan formé
Dans le cas où le carbone fonctionnel est chiral (les quatre substituants sont différents), racémique. En effet, la substitution nucléophile SN1 est non stéréospécifique.constituants une substitution nucléophile SN1, est présentée dans le diagramme énergétique
suivant :REACTIONS DE BASE EN CHIMIE ORGANIQUE
10En général, il existe pour une réaction en deux étapes, deux états de transition et un
les deux maximas. Ce creux correspond à un intermédiaire de reux profond), plusExemple 1 :
Mélange racémique ĮD = 0
Exemple 2 :
Mélange de deux diastéréoisomères ĮD b) Loi de vitesseLa réaction de substitution nucléophile SN1 obéit à une loi de vitesse du premier ordre :
V = K [R-X]
La vitesse est proportionnelle à la concentration du substrat et indépendante de la
concentration du réactif nucléophile.REACTIONS DE BASE EN CHIMIE ORGANIQUE
11 c) Facteurs influençant le mécanisme réactionnel SN1Classe de substrat : une SN1
stable. Cette stabilité est favorisée par tout effet électronique (inductif donneur +I ou mésomère donneur +M) permettant de diminuer la charge positive sur le carbone central (carbocation).Augmentation de la stabilité (+I)
C+ allylique stable (+M) C+ benzylique stable (+M) En conclusion, la stabilité du carbocation est comme suivant : C+ tertiaire > C+ secondaire ~ C+ benzylique ~ C+ allylique > C+ primaire Cas particulier (réarrangement) : le carbocation formé lors de la première étape1 peut soit réagir tel quel avec le nucléophile, soit se réarrange pour conduire
à un carbocation isomère plus stable. En effet, les proportions des produits normaux et réarrangés résultent des valeurs relatives des constantes de vitesse des processus SN1REACTIONS DE BASE EN CHIMIE ORGANIQUE
12Exemple 1 :
Exemple 2 :
Le nucléofuge (groupe partant) : plus la liaison C-X est polarisable (plus longue) plus sa rupture est facile et plus la réaction est rapide. La longueur de la liaison croît quand le volume du nucléofuge " X » augmente.TsO- > I- > Br- > Cl- ~ H2O > F- > OH-, NH2-, RO-
Meilleurs groupes partant Mauvais groupes partantsREACTIONS DE BASE EN CHIMIE ORGANIQUE
13 Le nucléophile : la vitesse de la réaction de type SN1 est indépendante de la sur la vitesse de la réaction. Cependant, le nucléophile doit être plus réactif que le nucléofuge. Le solvant : un solvant polaire protique (pouvant faire des liaisons hydrogènes, àN1, car il facilite la formation du
général, le solvant intervient de deux façons :1. Par sa constante diélectrique " ȗ
charges de signes opposés.2. Par son moment dipolaire " ȝ » qui lui permet de solvater les molécules chargées ou
les ions. Le tableau ci-après présente quelques solvants et leurs propriétés physico-chimiques :Solvant non dissociant
Solvant intermédiaire
Solvant dissociant
ȗ> 40
Apolaire
Polaire
aprotiquePolaire
protiquePolaire
aprotiquePolaire
protiquePolaire
aprotiquePolaire
protique - Hexane - CCl4ȗ = 2.2)
- Benzèneȗ = 2.3)
-Pyridineȗ = 12)
-THFȗ = 7.6)
- (Et)2Oȗ4.3)
-CH2Cl2ȗ8.9)
-CH3CO2Hȗ6.1)
-Acétoneȗ 20.7)
-Acétonitryleȗ37.5)
-DMFȗ36.7)
-EtOHȗ24.5)
-MeOHȗ32.7)
-DMSOȗ46.7)
-H2Oȗ78.5)
-H2O/EtOH80%/20%
ȗ67)
-Formamideȗ111)
-N-méthylFormamide
ȗ182.4)
REACTIONS DE BASE EN CHIMIE ORGANIQUE
14Exemple : influence du méthanol (solvant polaire et protique) sur la polarisabilité de la
liaison C-Br du substrat. I.1.2. Réaction de substitution nucléophile bimoléculaire (SN2) a) Mécanisme réactionnel Au cours du processus de la substitution de type SN2, le réactif nucléophile (Nu : chargénégativement ou neutre) attaque le carbone lié au groupe partant du côté opposé à " X »,
un mécanisme concerté.Inversion de Walden
qui augmente la polarisation de la liaison C-X (effet du champ externe). A ce moment-là, (voir le diagramme énergétique). Ensuite, au moment où le Nu forme une liaison avec le carbone, la liaison C-X se rompt en libérant X-.REACTIONS DE BASE EN CHIMIE ORGANIQUE
15 N2, si le carbone central est asymétrique, il y a inversion de la configuration du carbone central (inversion de Walden) mais pas forcément changement de la (Cahn-Ingold-Prelog) du groupe entrant (Nu) et celui du groupe sortant (X). En conséquence, la substitution nucléophile SN2 est stéréospécifique.Exemple 1 :
Exemple 2 :
REACTIONS DE BASE EN CHIMIE ORGANIQUE
16 b) Loi de vitesseDans le mécanisme réactionnel de la substitution nucléophile SN2, le réactif nucléophile
-X) interviennent et plus particulièrement dans : V = K [R-X][Nu] c) Facteurs influençant le mécanisme réactionnel SN2Classe du substrat :
difficile en rai difficile à atteindre. Par contre, si ce carbone est primaire ou à la rigueur e qui explique que le mécanisme SN2 est spécifique des groupes " R » primaires (plus particulièrement le méthyle), et assez souvent secondaires, mais jamais tertiaires.CH3-X > RCH2-X > R2CHX > R3C-X
Nature du nucléofuge : la même chose que SN1 pour la SN la liaison C-X est polarisable plus sa rupture est facile. Nucléophile : un nucléophile puissant favorise une SN2. En réalité, un grand nombre de facteurs influent sur la nucléophilie : La nucléophilie augmente avec la charge : OH- > H2O, NH2- > NH3 La solvatation du nucléophile : plus il est solvaté, moins il est nucléophile. I- < Br- < Cl- < F- (dans un solvant polaire aprotique) I- > Br- > Cl- > F- (dans un solvant polaire protique) La taille du nucléophile : plus le Nu est volumineux, moins il est réactif. moins il est nucléophile. nt : plus il est polarisable, plus il est Nu.I- > Br- > Cl- > F-
H2S > H2O
REACTIONS DE BASE EN CHIMIE ORGANIQUE
17 Solvant: un solvant polaire protique solvate le nucléophile par les liaisons hydrogènes. Ceci va diminuer la vitesse de la réaction. En revanche, un solvant polaire aprotique augmente la vitesse, c.-à-d., favorise la SN2. lieu sur le carbone de la double liaison.Exemple 1 :
Exemple 2 :
e) Substitution intramoléculaire SNi Dans ce type de réaction, il y a une rétention de configuration. Ceci selon un processuscis, c'est-à-dire que le groupe entrant attaque du même côté que le groupe partant. Cette
nt actifs en dérivés halogénés par action de PCl5 ou SOCl2.REACTIONS DE BASE EN CHIMIE ORGANIQUE
18 N.B : configuration (SN2), si on ajoute au milieu réactionnel une base comme la pyridine. Ceci est exprimé par le mécanisme réactionnel suivant : I.2. Réactions ȕ-élimination et compétition SN/E un effet inductif attracteur quiȕun caractère acide et
A retenir :
majoritairement parmi tous lesisomères de positions possibles le dérivé éthylènique le plus stable, c'est-à-dire le plus
conjugué puis le plus substitué (règle de Saytzeff appelé alcène type " Hofmann régiosélèctive. Les bases fortes sont, en général, les bases conjuguées des acides faibles. On donne quelques exemples de bases fortes : EtO-,Na+ ; K+,OH- ; (iPr)2N-,Li+. Deux mécanismes limites sont généralement admis : E1 et E2.REACTIONS DE BASE EN CHIMIE ORGANIQUE
19I.2.1. Réactions 1)
a) Mécanisme réactionnel1ère Etape (lente) : cette étape, cinétiquement limitante, est identique à celle de la SN1
2ème Etape :
Ce type de réaction :
V = K [RX]
b) Stéréochimie stéréospécifique mais partiellement stéréosélective :REACTIONS DE BASE EN CHIMIE ORGANIQUE
20Exemple 1:
Exemple 2:
c) Facteurs influençant le mécanisme réactionnel E1 Classe du substrat : la même chose pour la SN1, c.-à-d. autant le carbone fonctionnel est plus substitué plus le carbocation formé est stable. En effet, plus le dérivé éthylénique obtenu est substitué plus il est stable. Toutefois, laCeci est
Nucléofuge : la vitesse augmente avec le pouvoir nucléofuge de " X ». Solvant : La vitesse augmente avec la polarité du solvant. Ainsi, les solvants protiques favorisent la première étape en stabilisant X- libéré.Base :
cinétiquement limitante.REACTIONS DE BASE EN CHIMIE ORGANIQUE
21I.2.2. Réactions
a) Mécanisme réactionnel (mécanisme concerté synchrone) les liaisons C-H et C-X doivent être antipériplanaires). La loi de la vitesse est du deuxième ordre :V = K [RX][Base]
b) Stéréochimie diastéréospécifique. La stéréochimie ANTI de laSaytzeff).
REACTIONS DE BASE EN CHIMIE ORGANIQUE
22Exemple 1 :
Mécanisme
Lors une E2 les groupements H et Cl doivent être dans un même plan en position anti o Dans cet exemple le couple thréo (ici 2S, 3RZ, tandis que le couple érythro (2S, 3S ou 2R, 3RE.Exemple 2 :
Mécanisme
configuration chaise plus stable favorisée conformation défavorisée moins stable
-Me et Br en positions équatoriales -Me et Br en positions axialesREACTIONS DE BASE EN CHIMIE ORGANIQUE
quotesdbs_dbs12.pdfusesText_18[PDF] clayden organic chemistry pdf
[PDF] nomenclature chimie organique exercices corrigés
[PDF] nomenclature chimie organique priorité
[PDF] nomenclature chimie exercices
[PDF] qcm chimie organique pdf
[PDF] qcm paces ue1
[PDF] atomistique cours et exercices corrigés pdf
[PDF] les alcools exercices corrigés pdf
[PDF] cours de chimie organique generale pdf
[PDF] chimie organique terminale s exercice
[PDF] chimie terminale d pdf
[PDF] fiche chimie terminale s
[PDF] tout en un physique psi pdf
[PDF] fiche chimie organique pcsi
