 TP N°2 DÉTERMINATION EXPÉRIMENTALE DE LA CAPACITÉ
TP N°2 DÉTERMINATION EXPÉRIMENTALE DE LA CAPACITÉ
Trouver expérimentalement la capacité calorifique de certains métaux connaissant celle de l'eau. Comparer ces valeurs expérimentales aux valeurs théoriques. 1)
 TP de Thérmodynamique
TP de Thérmodynamique
1 Capacité Calorifique des Métaux et Chaleur Latente de Fusion de la Glace. 9. 1.1 Motivations .
 TP2: la capacité calorifique du calorimètre et la capacité thermique
TP2: la capacité calorifique du calorimètre et la capacité thermique
TP thermodynamique 2eme année physique La capacité calorifique C d'une substance est la grandeur physique qui détermine la quantité de chaleur.
 INTRODUCTION :
INTRODUCTION :
La capacité calorifique C mesure l'effet d'une addition de chaleur sur la température 2-Détermination de la chaleur massique des éprouvettes (métaux) :.
 FACULTE DES SCIENCES DEPARTEMENT DE PHYSIQUE
FACULTE DES SCIENCES DEPARTEMENT DE PHYSIQUE
partie intégrante de la manipulation ; une séance de TP à pour but aussi On se propose de déterminer la capacité calorifique de certains métaux tels que ...
 = (m2.c2+ m3.c3).(?f??2 ) m1.(?1??f ) Corps 1 : métal chaud m c
= (m2.c2+ m3.c3).(?f??2 ) m1.(?1??f ) Corps 1 : métal chaud m c
TP DE PHYSIQUE : MESURE DE LA CAPACITE THERMIQUE MASSIQUE DE DIVERS METAUX. 1) Principe et but de l'expérience. On place un métal chaud dans l'eau froide
 Mesures de propriétés thermiques des métaux par procédé
Mesures de propriétés thermiques des métaux par procédé
15 oct. 2016 sur du solide en remontant aux valeurs de la capacité calorifique et de la ... Température de la zone polaire Tp: puissance Joule.
 TP CHIMIE-1 & TP CHIMIE-2
TP CHIMIE-1 & TP CHIMIE-2
TP I : Préparation d'une solution d'acide faible l'acide oxalique . Déterminer la capacité calorifique du calorimètre et la Chaleur de neutralisation.
 TP :détermination de la capacité thermique massique dun solide
TP :détermination de la capacité thermique massique dun solide
Objectif : Calculer la capacité thermique massique de plusieurs métaux donnés (en choisir 1 par groupe). Mode opératoire. Un solide de masse m est chauffé dans
 Thermodynamique - Calorimétrie
Thermodynamique - Calorimétrie
(Ccal: capacité calorifique du calorimètre et ceau: chaleur massique de l'eau) ce TP d'étudier expérimentalement la transformation de l'eau distillée et ...
 [PDF] TP de Thermodynamique - Université de Bejaia
[PDF] TP de Thermodynamique - Université de Bejaia
Capacité Calorifique des Métaux TP de Thermodynamique 1 1 Motivations Déterminer la capacité calorifique du calorimètre
 1: Présentation: Apacité Calorifique Des Métaux C Partie Théorique
1: Présentation: Apacité Calorifique Des Métaux C Partie Théorique
Téléchargez comme PDF TXT ou lisez en ligne sur Scribd En thermodynamique on distingue la capacité calorifique à volume constant Tp 2 Calorimetre
 [PDF] TP N°2 DÉTERMINATION EXPÉRIMENTALE DE LA CAPACITÉ
[PDF] TP N°2 DÉTERMINATION EXPÉRIMENTALE DE LA CAPACITÉ
Trouver expérimentalement la capacité calorifique de certains métaux connaissant celle de l'eau Comparer ces valeurs expérimentales aux valeurs théoriques 1)
 (PDF) apacité calorifique des métaux C - Academiaedu
(PDF) apacité calorifique des métaux C - Academiaedu
Partie théorique: 1 : PRÉSENTATION calorifique capacité quantité de chaleur qu'il faut fournir à un système pour élever sa température d'un kelvin
 [PDF] TP :détermination de la capacité thermique massique dun solide
[PDF] TP :détermination de la capacité thermique massique dun solide
Objectif : Calculer la capacité thermique massique de plusieurs métaux donnés (en choisir 1 par groupe) Mode opératoire Un solide de masse m est chauffé dans
 [PDF] TP 15 Capacité thermique massique dun métal
[PDF] TP 15 Capacité thermique massique dun métal
Capacité thermique massique d'un métal T P 15 TRANSFERTS THERMIQUES : capacité thermique massique de l'aluminium I RAPPEL SUR LA QUANTITE DE CHALEUR
 [PDF] Ex 4 Capacité thermique massique du cuivre - PTSI Ginette
[PDF] Ex 4 Capacité thermique massique du cuivre - PTSI Ginette
Ex 4 Capacité thermique massique du cuivre Dans un calorimètre dont la valeur en eau vaut µ = 40 g on verse m = 100 g d'eau
 TP Chimie + Compte rendu - la capacité calorifique des métaux
TP Chimie + Compte rendu - la capacité calorifique des métaux
18 avr 2018 · TP Chimie + Compte rendu - la capacité calorifique des métaux 6367 * TP Chimie + Compte rendu - la capacité calorifique des métaux 6367 pdf
 TP Chimie + Compte rendu - la capacité calorifique des métaux
TP Chimie + Compte rendu - la capacité calorifique des métaux
Télécharger gratuitement le document TP Chimie + Compte rendu - la capacité calorifique des métaux en Compte rendu - TP Chimie S2 sur DZuniv
 [PDF] TP-chimiepdf
[PDF] TP-chimiepdf
La capacité thermique du calorimètre est donc : Ccalorimetre = ?ce avec ce = 4 18 J g-1 K-1 la capacité thermique massique de l'eau
Comment calculer la capacité calorifique d'un métal ?
La capacité thermique (C) d'un objet s'obtient en divisant la quantité d'énergie fournie (E) par la variation de température (T). La formule se présente ainsi : C = E/T.Quelle est la formule de la capacité calorifique ?
Exprimée dans l'unité de Joule, la capacité thermique représente l'énergie à apporter à un corps pour augmenter sa température de 1 Kelvin. La capacité thermique massique C = C/m, rapportée à un kilogramme du corps considéré. La capacité thermique molaire Cm = C/n, rapportée à une mole du corps considéré.Comment calculer CP et CV ?
On a donc :
1cv = du/dT (J/kg/K)2cp = dh/dT (J/kg/K)- La capacité thermique (tout court) : Cp=mcp=ncpm C p = m c p = n c p m en joule par kelvin (J.K-1).
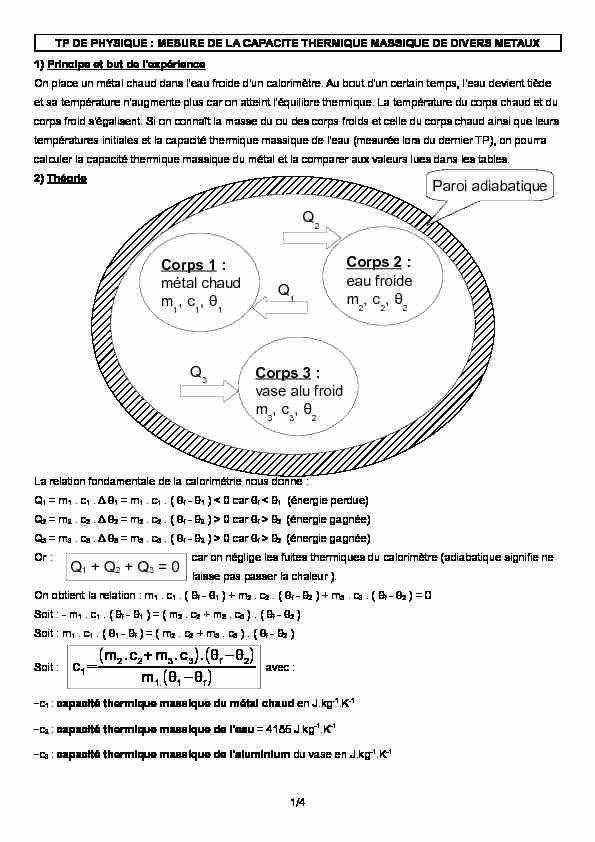
TP DE PHYSIQUE : MESURE DE LA CAPACITE THERMIQUE MASSIQUE DE DIVERS METAUX1) Principe et but de l'expérienceOn place un métal chaud dans l'eau froide d'un calorimètre. Au bout d'un certain temps, l'eau devient tiède
et sa température n'augmente plus car on atteint l'équilibre thermique. La température du corps chaud et du
corps froid s'égalisent. Si on connaît la masse du ou des corps froids et celle du corps chaud ainsi que leurs
températures initiales et la capacité thermique massique de l'eau (mesurée lors du dernier TP), on pourra
calculer la capacité thermique massique du métal et la comparer aux valeurs lues dans les tables.2) ThéorieLa relation fondamentale de la calorimétrie nous donne :Q1 = m1 . c1 . Δ θ1 = m1 . c1 . ( θf - θ1 ) < 0 car θf < θ1 (énergie perdue)Q2 = m2 . c2 . Δ θ2 = m2 . c2 . ( θf - θ2 ) > 0 car θf > θ2 (énergie gagnée)
Q3 = m3 . c3 . Δ θ3 = m3 . c3 . ( θf - θ2 ) > 0 car θf > θ2 (énergie gagnée)
Or : car on néglige les fuites thermiques du calorimètre (adiabatique signifie nelaisse pas passer la chaleur ).On obtient la relation : m1 . c1 . ( θf - θ1 ) + m2 . c2 . ( θf - θ2 ) + m3 . c3 . ( θf - θ2 ) = 0Soit : - m1 . c1 . ( θf - θ1 ) = ( m2 . c2 + m3 . c3 ) . ( θf - θ2 ) Soit : m1 . c1 . ( θ1 - θf ) = ( m2 . c2 + m3 . c3 ) . ( θf - θ2 )Soit : c1=(m2.c2+m3.c3).(θf-θ2)
m1.(θ1-θf)avec : -c1 : capacité thermique massique du métal chaud en J.kg-1.K-1 -c2 : capacité thermique massique de l'eau = 4185 J.kg-1.K-1 -c3 : capacité thermique massique de l'aluminium du vase en J.kg-1.K-11/4Corps 1 :
métal chaudm1, c1, θ1Corps 2 : eau froidem2, c2, θ2Corps 3 :
vase alu froidm3, c3, θ2Q2 Q1Q3Paroi adiabatiqueQ1 + Q2 + Q3 = 0
-m1 : masse du métal chaud en grammes (g)-m2 : masse de l'eau froide en grammes (g)-m3 : masse du vase en aluminium du calorimètre en grammes (g)-θ1 : température initiale du métal chaud en degrés Celsius (°C)-θ2 : température initiale de l'eau et du vase alu en degrés Celsius (°C)-θf : température finale de l'ensemble en degrés Celsius (°C)3) Détermination de la capacité thermique massique de l'aluminiuma) théorie
Comme premier métal chaud, on prendra l'aluminium car c'est celui du vase interne du calorimètre d'où :Q1 = m1 . c3 . Δ θ1 = m1 . c3 . ( θf - θ1 ) < 0 car θf < θ1 (énergie perdue)Q2 = m2 . c2 . Δ θ2 = m2 . c2 . ( θf - θ2 ) > 0 car θf > θ2 (énergie gagnée)
Q3 = m3 . c3 . Δ θ3 = m3 . c3 . ( θf - θ2 ) > 0 car θf > θ2 (énergie gagnée)
Or : Donc : m1 . c3 . ( θf - θ1 ) + m2 . c2 . ( θf - θ2 ) + m3 . c3 . ( θf - θ2 ) = 0Donc : - m1 . c3 . ( θf - θ1 ) - m3 . c3 . ( θf - θ2 ) = m2 . c2 . ( θf - θ2 )Donc : m1 . c3 . ( θ1 - θf ) - m3 . c3 . ( θf - θ2 ) = m2 . c2 . ( θf - θ2 )Donc : c3 . [ m1 . ( θ1 - θf ) - m3 . ( θf - θ2 ) ] = m2 . c2 . ( θf - θ2 )
Donc : c3=m2.c2.(θf-θ2)
m1.(θ1-θf)-m3.(θf-θ2)On peut trouver la capacité thermique de l'aluminium c3 grâce à la mesure de m1, m2, m3, θ1, θ2, θf et en
connaissant c2 = 4185 J.kg-1.K-1. b) protocole expérimental-Faire chauffer de l'eau dans une capsule émaillée au bec bunsen ; -Peser l'échantillon d'aluminium sur la balance électronique (m1) ; -Peser le vase interne en aluminium du calorimètre (m3) ;-Appuyer sur " tare » et peser l'eau froide mise dans le vase du calorimètre avec une éprouvette graduée
de 250 mL (m2) ;-Remonter correctement le calorimètre et mettre le couvercle et le thermomètre dans l'eau. Attendre que la
température se stabilise en mélangeant et mesurer la température initiale des corps froids (θ2) ;
-Immerger totalement l'échantillon d'aluminium dans l'eau chaude de la capsule émaillée jusqu'à ébullition.
Mettre un second thermomètre dans l'eau bouillante et mesurer la température initiale du corps chaud
(θ1) ; -transférer rapidement le métal chaud dans l'eau froide du calorimètre ; -Fermer rapidement le couvercle du calorimètre ; -Mélanger jusqu'à stabilisation de la température ;2/4Q1 + Q2 + Q3 = 0 -Mesurer la température finale du mélange (θf) ;-L'expérience est terminée, videz le calorimètre, séchez-le soigneusement avec un chiffon sec.c) résultat de l'expériencem1m2m3θ1θ2θfc3
d) calcul du pourcentage d'erreur de votre groupe Pour l'aluminium, la valeur trouvée dans les tables est : c3= 897 J.kg-1.K-1 %erreur=∣cexp-ctabulé∣ ctabuléx100=∣c3-897∣897x100=
e) calcul du pourcentage d'erreur de la classegr. 1gr. 2gr. 3gr. 4gr. 5gr. 6gr. 7gr. 8̄c3 %erreur=∣cexp-ctabulé∣ ctabuléx100=∣̄c3-897∣897x100=
f) conclusion4) Détermination de la capacité thermique massique d'autres métauxa) Protocole expérimentalLe protocole expérimental est Identique au précédentb) Formule théorique à utiliser (voir paragraphe 2)c1=(m2.c2+m3.c3).(θf-θ2)
m1.(θ1-θf) c) Résultats de votre groupeMétalm1m2m3θ1θ2θfc1ctabulé%erreurlaiton377 plomb129 acier460 zinc390 3/4 d) Résultats de la classe - laitongr. 1gr. 2gr. 3gr. 4gr. 5gr. 6gr. 7gr. 8̄c1%erreur=∣̄c1-377∣377x100= - plomb
gr. 1gr. 2gr. 3gr. 4gr. 5gr. 6gr. 7gr. 8̄c1 %erreur=∣̄c1-129∣129x100= - acier
gr. 1gr. 2gr. 3gr. 4gr. 5gr. 6gr. 7gr. 8̄c1 %erreur=∣̄c1-460∣460x100= - zincgr. 1gr. 2gr. 3gr. 4gr. 5gr. 6gr. 7gr. 8̄c1
%erreur=∣̄c1-390∣390x100= e) Conclusion4/4
quotesdbs_dbs29.pdfusesText_35[PDF] tp determination de la capacité thermique massique d'un corps solide
[PDF] mps cosmétologie parfum
[PDF] mps police scientifique physique chimie
[PDF] mps cosmétologie maths
[PDF] les étapes du compte rendu objectif
[PDF] compte rendu critique exemple pdf
[PDF] compte rendu objectif 3as
[PDF] compte rendu objectif d'un texte argumentatif 3as
[PDF] compte rendu objectif d'un texte argumentatif exemple
[PDF] exemple d'un compte rendu d'une pièce de théâtre
[PDF] compte rendu theatre bac
[PDF] corrigé concours surveillant pénitentiaire 2015
[PDF] recristallisation de l'acide benzoique tp
[PDF] extraction de lacide benzoique corrigé
