 7. Transferts de protons Equilibres acide-base
7. Transferts de protons Equilibres acide-base
Ce proton “réagit” avec l'eau pour former l'ion hydronium H3O+: L'acide chlorhydrique est donc à la fois un acide de Brønsted et un acide d'Arrhenius. L'
 Exercice 1 : 1/ a/ Définir un acide et une base selon Bronsted. b
Exercice 1 : 1/ a/ Définir un acide et une base selon Bronsted. b
Exercice 2 : Parmi les réactions chimiques suivantes indiquer celles qui font intervenir des acides et des bases de Bronsted. Préciser le cas échéant l'acide et
 Acides et bases
Acides et bases
20 nov. 2020 Un acide (au sens de Brönsted) est une espèce chimique capable de fournir un proton H+. Exemples : L'acide éthanoïque CH3COOH le chlorure d' ...
 SA1_PC : réactions acide-base
SA1_PC : réactions acide-base
5 mai 2018 Source : Journal officiel du 18 avril 2001. acide de Brønsted. ♢ Domaine : Chimie. ♢ Définition : Entité moléculaire ou l'espèce.
 COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
En 1923 Joannes Brönsted
 série-n°1-les-acides-et-les-bases-de-bronsted--2013-2014
série-n°1-les-acides-et-les-bases-de-bronsted--2013-2014
Exercice 5 :Réaction acido-basique effervescente. L'acide éthanoïque (ou acide acétique) présent dans le vinaigre
 COURS.5 QUEST-CE QUUN ACIDE ET UNE BASE DE
COURS.5 QUEST-CE QUUN ACIDE ET UNE BASE DE
CHIMIE : LES ACIDES ET BASES DE BRONSTED. QU'EST-CE QU'UN ACIDE ET UNE BASE DE BRONSTED ? BACCARI. 1/2. COURS.5 : LES ACIDES ET LES BASES DE BRONSTED. Tawbac
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
À retenir : — définition des acides et bases de Brønsted;. — définition du pH du pKa ;. — définition de Ke et sa valeur à 25◦C;. — définition d'un acide fort/
 1) Définition de Bronsted : 2) Notion de couple acide-base : 3
1) Définition de Bronsted : 2) Notion de couple acide-base : 3
On appelle base de Bronsted toute espèce chimique capable de capter un proton H+ pendant une transformation chimique. 2) Notion de couple acide-base : Example:
 F2School
F2School
Acides-bases 1 : Acides et bases de Brønsted Indiquez le couple acide / base conjuguée dans les réactions suivantes : a) C6H5COOH + H2O. H3O+ + C6H5COO– b ...
 SA1_PC : réactions acide-base
SA1_PC : réactions acide-base
5 mai 2018 I Que sont les acides et les bases ? 1. Acide et base : déhinitions selon la théorie de Brönsted et Lowry. En 1923 le chimiste danois Johannes ...
 7. Transferts de protons Equilibres acide-base
7. Transferts de protons Equilibres acide-base
Dans l'eau les acides et les bases définis selon Arrhenius (voir §2) correspondent également à la définition de Brønsted-Lowry. Thomas Lowry. (1874-1936).
 ACIDES ET BASES
ACIDES ET BASES
3 déc. 1998 Pour Brönsted un acide est un donneur de proton et une base un ... En chimie organique c'est la notion d'acide et base selon Lewis qui est ...
 COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
En 1923 Joannes Brönsted
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
1.2 Couples acide/base. 1.2.1 Acides et bases de Brønsted. La théorie de Johannes Brønsted (1923) définit les acides et les bases :.
 Acides et bases
Acides et bases
20 nov. 2020 Couple acide/base. 1.1. Acide. Un acide (au sens de Brönsted) est une espèce chimique capable de fournir un proton H+.
 SA1_PSI : réactions acide-base
SA1_PSI : réactions acide-base
I Que sont les acides et les bases ? 1. Acide et base : déBinitions selon la théorie de Brönsted et Lowry. En 1923 le chimiste danois Johannes Nicolaus
 Exercices
Exercices
Une base de Brönsted est susceptible de capter un ion hydrogène. Base de Brönsted. Acide conjugué. NO3. –. HNO3 car NO3.
 1) Définition de Bronsted : 2) Notion de couple acide-base : 3
1) Définition de Bronsted : 2) Notion de couple acide-base : 3
On appelle base de Bronsted toute espèce chimique capable de capter un proton H+ pendant une transformation chimique. 2) Notion de couple acide-base :.
 Chapitre 3 : Réactions acido-basiques
Chapitre 3 : Réactions acido-basiques
entre un acide et une base. Le plan suivant est proposé : • Acide et base au sens de Brönsted. • Réactions acido-basiques. • pH d'une solution aqueuse.
Chapitre 3
223.1.2 Origine de l"acidité et basicité des espèces . . . . . . . . . . . . . . . . . . . . .
223.2 Réactions acido-basiques . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
233.2.1 Couple acide-base . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
233.2.2 Réaction acido-basique . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
233.3 pH d"une solution aqueuse . . . . . . . . . . . . . . . . . . . . . . . . . . . .
243.3.1 Définition du pH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
243.3.2 Échelle de pH dans l"eau . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
243.3.3 Mesure du pH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2422Chapitre 3.Réactions acido-basiquesA
ucours du programme de première, on étudie les généralités sur les réactions chimiques (tableaux
d"avancement, énergie d"une réaction etc.), ainsi que le cas particulier des réactions d"oxydoré-
duction, qui font intervenir un échange d"électrons entre des espèces.Dans le chapitre qui suit, on s"intéresse à une autre famille de réaction chimique :les réactions
acido-basiques. Ces réactions se font par échange d"un proton H+entre un acide et une base. Le plan suivant est proposé :Réactions acido-basiques
pH d"une solution aqueuse
hydrogène H hydrogène H+.Remarque:Selon les cas, les acides et les bases peuvent être des espèces ioniques ou non. Lors-
qu"elles sont ioniques, elles n"existent pas seules en solution, elles sont toujours accompagnées d"un ion
spectateur qui permet d"assurer l"électroneutralité. Par exemple, l"acide chlorhydrique HCL se dissout dans l"eau en ions oxonium H3O+et chlorure Cl-.
Seuls les ions H
3O+sont porteurs du caractère acide, les ions Cl-sont spectateurs.
3.1.2 Origine de l"acidité et basicité des espècesStructure d"un acide
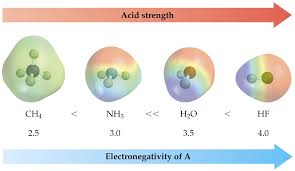
Lorsqu"une molécule présente uneliaison polariséeentre un hydrogène et un atome plusélectronégatif, on dit que la molécule est acide. La liaison est fragilisée par cette polarité et la
molécule peut ainsi céder plus ou moins facilement l"ion H +.Structure d"une base Lorsqu"une molécule présente un atome portant un ou plusieursdoublets non-liant, comme l"atome d"azote par exemple, alors cette molécule est une base. Ces doublets non-liant sont des réserves d"électrons susceptibles de venir combler la lacune électronique d"un ion H +pour lecapter.Exemples:La figure3.1 présen tele sc hémad eLewis de l"acide éthanoïque et d el"ammoniac, res-
pectivement un acide et une base.Poisson Florian Spécialité Physique-Chimie Terminale3.2.Réactions acido-basiques23Figure 3.1- à gauche : acide éthanoïque présentant une liaison OH polarisée - à droite : ammoniac présentant un
doublet non-liant3.2 Réactions acido-basiques
3.2.1 Couple acide-baseCouple acide-base
Lorsqu"un acide noté AH cède un proton H
+, il se transforme en sa base conjuguée notée A- selon la demi-équation suivante :AH=A-+ H+
On dit que le couple AH/A
-est uncouple acide-base.Remarque:Certaines espèces peuvent à la fois jouer le rôle de base et d"acide. Elles sont appelées
espècesamphotères, ouampholytes.L"eau H
2O est une espèce amphotère, elle est la base conjuguée de l"ion oxonium H3O+et l"acide
conjugué de l"ion hydroxyde HO -. Les deux couples acide-base associés sont H3O+/H2O et H2O/HO-.3.2.2 Réaction acido-basiqueRéaction acido-basique
Soient deux couples acide-base A
1H/A1-et A2H/A2-. Une réactionacido-basique(aussi appe-
lée réaction partransfert de proton) est la transformation chimique qui a lieu lorsque l"acide d"un couple échange un proton avec la base d"un autre couple pour former leurs base et acide conjugués. L"équation bilan de la réaction est la suivante : A1H + A2-A
1-+ A2HExemples
Réaction entre l"acide éthanoïque, acide du couple CH3COOH/CH3COO-, et l"ammoniac, base du couple NH4+/NH3:
CH3COOH + NH3CH
3COO-+ NH4+
Du fait de son caractère amphotère dans les couples H3O+/H2O et H2O/HO-, l"eau peut réagir
avec elle même. Cette réaction est appeléeautoprotolyse de l"eau: 2H 2OH3O++ HO-Spécialité Physique-Chimie Terminale Poisson Florian
24Chapitre 3.Réactions acido-basiques3.3 pH d"une solution aqueuse
3.3.1 Définition du pH
Les réactions acido-basiques font intervenir un transfert d"ions H +. Lorsqu"on est en solution aqueuse(donc où le solvant est l"eau), on va définir le caractère acide ou basique de la solution en fonction de la
quantité d"ions H +présents en solution. Or dans l"eau l"ion H+n"existe pas en tant que tel, il est associé à une molécule d"eau pour former l"ion oxonium selon la demi-équation suivante : H2O + H+=H3O+.pH d"une solution aqueuse
Lepotentiel hydrogène, oupH, d"une solution aqueuse, est lié à la concentration en ion oxonium H3O+par la formule suivante :
pH =-log? [H3O+]?C
0??[H3O+]=C010-pH
AvecC0= 1 mol.L-1la concentration de référence.Remarque:La fonctionlogest la fonction mathématique logarithme décimal. Elle est définie telle
que siy= logx, alorsx= 10y(cf. chapitre de maths sur le logarithme népérien).3.3.2 Échelle de pH dans l"eau
Dans l"eau, la valeur du pH est comprise entre 0 et 14. Le pH central est donc 7, on l"appelle lepH neutre. Si7Un pH-mètre, appareil muni d"une sonde pH-métrique que l"on immerge dans la solution et qui
indique une valeur plus précise du pH.Poisson Florian Spécialité Physique-Chimie Terminalequotesdbs_dbs14.pdfusesText_20[PDF] acide et base exercices corrigés pdf
[PDF] acide et base pdf
[PDF] acide et base selon bronsted
[PDF] acide et base terminale s
[PDF] acide faible anglais
[PDF] acide faible base forte
[PDF] acide faible définition
[PDF] acide faible et acide fort
[PDF] acide faible et ph
[PDF] acide faible ph pka
[PDF] acide fort base forte exercice corrigé pdf
[PDF] acide fort et faible ph
[PDF] acide fort ou faible ph
[PDF] acide phosphorique faible
