 7. Transferts de protons Equilibres acide-base
7. Transferts de protons Equilibres acide-base
Ce proton “réagit” avec l'eau pour former l'ion hydronium H3O+: L'acide chlorhydrique est donc à la fois un acide de Brønsted et un acide d'Arrhenius. L'
 Exercice 1 : 1/ a/ Définir un acide et une base selon Bronsted. b
Exercice 1 : 1/ a/ Définir un acide et une base selon Bronsted. b
Exercice 2 : Parmi les réactions chimiques suivantes indiquer celles qui font intervenir des acides et des bases de Bronsted. Préciser le cas échéant l'acide et
 Acides et bases
Acides et bases
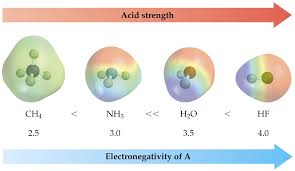
20 nov. 2020 Un acide (au sens de Brönsted) est une espèce chimique capable de fournir un proton H+. Exemples : L'acide éthanoïque CH3COOH le chlorure d' ...
 SA1_PC : réactions acide-base
SA1_PC : réactions acide-base
5 mai 2018 Source : Journal officiel du 18 avril 2001. acide de Brønsted. ♢ Domaine : Chimie. ♢ Définition : Entité moléculaire ou l'espèce.
 COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
En 1923 Joannes Brönsted
 série-n°1-les-acides-et-les-bases-de-bronsted--2013-2014
série-n°1-les-acides-et-les-bases-de-bronsted--2013-2014
Exercice 5 :Réaction acido-basique effervescente. L'acide éthanoïque (ou acide acétique) présent dans le vinaigre
 COURS.5 QUEST-CE QUUN ACIDE ET UNE BASE DE
COURS.5 QUEST-CE QUUN ACIDE ET UNE BASE DE
CHIMIE : LES ACIDES ET BASES DE BRONSTED. QU'EST-CE QU'UN ACIDE ET UNE BASE DE BRONSTED ? BACCARI. 1/2. COURS.5 : LES ACIDES ET LES BASES DE BRONSTED. Tawbac
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
À retenir : — définition des acides et bases de Brønsted;. — définition du pH du pKa ;. — définition de Ke et sa valeur à 25◦C;. — définition d'un acide fort/
 1) Définition de Bronsted : 2) Notion de couple acide-base : 3
1) Définition de Bronsted : 2) Notion de couple acide-base : 3
On appelle base de Bronsted toute espèce chimique capable de capter un proton H+ pendant une transformation chimique. 2) Notion de couple acide-base : Example:
 F2School
F2School
Acides-bases 1 : Acides et bases de Brønsted Indiquez le couple acide / base conjuguée dans les réactions suivantes : a) C6H5COOH + H2O. H3O+ + C6H5COO– b ...
 SA1_PC : réactions acide-base
SA1_PC : réactions acide-base
5 mai 2018 I Que sont les acides et les bases ? 1. Acide et base : déhinitions selon la théorie de Brönsted et Lowry. En 1923 le chimiste danois Johannes ...
 7. Transferts de protons Equilibres acide-base
7. Transferts de protons Equilibres acide-base
Dans l'eau les acides et les bases définis selon Arrhenius (voir §2) correspondent également à la définition de Brønsted-Lowry. Thomas Lowry. (1874-1936).
 ACIDES ET BASES
ACIDES ET BASES
3 déc. 1998 Pour Brönsted un acide est un donneur de proton et une base un ... En chimie organique c'est la notion d'acide et base selon Lewis qui est ...
 COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
En 1923 Joannes Brönsted
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
1.2 Couples acide/base. 1.2.1 Acides et bases de Brønsted. La théorie de Johannes Brønsted (1923) définit les acides et les bases :.
 Acides et bases
Acides et bases
20 nov. 2020 Couple acide/base. 1.1. Acide. Un acide (au sens de Brönsted) est une espèce chimique capable de fournir un proton H+.
 SA1_PSI : réactions acide-base
SA1_PSI : réactions acide-base
I Que sont les acides et les bases ? 1. Acide et base : déBinitions selon la théorie de Brönsted et Lowry. En 1923 le chimiste danois Johannes Nicolaus
 Exercices
Exercices
Une base de Brönsted est susceptible de capter un ion hydrogène. Base de Brönsted. Acide conjugué. NO3. –. HNO3 car NO3.
 1) Définition de Bronsted : 2) Notion de couple acide-base : 3
1) Définition de Bronsted : 2) Notion de couple acide-base : 3
On appelle base de Bronsted toute espèce chimique capable de capter un proton H+ pendant une transformation chimique. 2) Notion de couple acide-base :.
 Chapitre 3 : Réactions acido-basiques
Chapitre 3 : Réactions acido-basiques
entre un acide et une base. Le plan suivant est proposé : • Acide et base au sens de Brönsted. • Réactions acido-basiques. • pH d'une solution aqueuse.
SA1_PSI : réactions acide-base
lycée Jean DautetPCSILycée Jean DautetPCSI D.Lecorgne
Dansleprogramme:
KWWSZZZHQVHLJQHPHQWVXSUHFKHUFKHJRXYIU
1 Ð Ractions dÕoxydo-rduction
Notions et contenus Capacits exigibles
Oxydants et rducteurs
([HPSOHVXVXHOVQRPQDWXUHHWIRUPXOHGHVLRQVWKLRVXOIDWHSHUPDQJDQDWHGLFKURPDW H
pOHFWURGHVGHUpIpUHQFH pOpPHQWjSDUWLUGHVDS RVLWLR QGDQVOHWDEOHDXSpULRGLTXH
LQFRPSDWLEOHVRXODQDWXUHGHVHVSqFHV
PDMRULWDLUHV
Ractions dÕoxydo-rduction
$VSHFWWKHUPRG\QDPLTXH 'LVPXWDWLRQHWPpGLDPXWDWLRQ3UpYRLUTXDOLWDWLYHPHQ WRXTXDQWLWDWLYHPHQWOH
FDUDFWqUHWKHUPRG\QDPLTXH PHQWIDYRULVpRX
Pratiquer une dmarche exprimentale mettant en jeu des ractions dÕoxydo-rduction.2 Ð Ractions acide-base, de complexation, de prcipitation
Notions et contenus Capacits exigibles
Ractions acido-basiques
GLDJ UDPPHGHSUpGRPLQDQFH
VXOIXULTXHQLWULTXHFKORUK\GULT XH
SKRVSKRULTXHDFpWLTXHGHODVRXGHOD
VROXW LRQVWDPSRQ
Ractions de complexation
FRQVWD QWHVGHIRUPDWLRQRXGHGLVVRFLDWLRQ
GLDJ UDPPHGHSUpGRPLQDQFHHQIRQFW LRQGH
S/ Ractions de dissolution ou de prcipitationGHVROXELOLWpK
VVROXELOLWpHWFRQGLWLRQGHSUpFLSLWDWLRQ
IDFW HXUVLQIOXHQoDQWODVROXELOLWp
,GHQWLILHUODQDWXUHGHVUpDFWLRQ VHQVROXWL RQVDTXHXVHV
([WUDLUHGHUHVVRXUFHVGLVSRQLEO HVOHVGRQ QpHVWKHUPRG\QDPLTXHVSHUWLQHQWHVSRXUSUpYRLU
DTXHXVHRXSRXULQWHU SUpWHUG HVREVHUYDWLRQV
H[SpULPHQWDOHV
SRXUXQHpTXDWL RQGHUpDFWL RQFRPELQDLVRQ
WKHUPRG\QDPLTXHVVRQWFRQQXHV
OHFWXUHGHFRXUEHVGHG LVWULEXWLR QHWGH
GLDJUDPPHVGHSUpGRPLQDQFHHW
UpFLSURTXHPHQW
'pWHUPLQHUODFRPSRVLWLRQFKLPLTXH GXV\VWqPHFKLPLTXHHWGHWUDQVIRUP DWLRQWR WDOHSRX UXQH
WUDQVIRUPDWLRQPRGpOLVpHSDUXQHUpDFWLRQ
FKLPLTXHXQLTXH
8WLOLVHUOHVGLDJUDPPHVGH SUpGRPL QDQFHRX
LQFRPSDWLEOHVRXODQDWXUHGHVHVSqFHV
PDMRULWDLUHV
KWWSZZZHQVHLJQHPHQWVXSUHFKHUFKHJRXYIU
1 Ð Ractions dÕoxydo-rduction
Notions et contenus Capacits exigibles
Oxydants et rducteurs
([HPSOHVXVXHOVQRPQDWXUHHWIRUPXOHGHVLRQVWKLRVXOIDWHSHUPDQJDQDWHGLFKURPDW H
pOHFWURGHVGHUpIpUHQFH pOpPHQWjSDUWLUGHVDS RVLWLR QGDQVOHWDEOHDXSpULRGLTXH
LQFRPSDWLEOHVRXODQDWXUHGHVHVSqFHV
PDMRULWDLUHV
Ractions dÕoxydo-rduction
$VSHFWWKHUPRG\QDPLTXH 'LVPXWDWLRQHWPpGLDPXWDWLRQ3UpYRLUTXDOLWDWLYHPHQ WRXTXDQWLWDWLYHPHQWOH
FDUDFWqUHWKHUPRG\QDPLTXH PHQWIDYRULVpRX
Pratiquer une dmarche exprimentale mettant en jeu des ractions dÕoxydo-rduction.2 Ð Ractions acide-base, de complexation, de prcipitation
Notions et contenus Capacits exigibles
Ractions acido-basiques
GLDJ UDPPHGHSUpGRPLQDQFH
VXOIXULTXHQLWULTXHFKORUK\GULT XH
SKRVSKRULTXHDFpWLTXHGHODVRXGHOD
VROXW LRQVWDPSRQ
Ractions de complexation
FRQVWD QWHVGHIRUPDWLRQRXGHGLVVRFLDWLRQ
GLDJ UDPPHGHSUpGRPLQDQFHHQIRQFW LRQGH
S/ Ractions de dissolution ou de prcipitationGHVROXELOLWpK
VVROXELOLWpHWFRQGLWLRQGHSUpFLSLWDWLRQ
IDFW HXUVLQIOXHQoDQWODVROXELOLWp
,GHQWLILHUODQDWXUHGHVUpDFWLRQ VHQVROXWL RQVDTXHXVHV
([WUDLUHGHUHVVRXUFHVGLVSRQLEO HVOHVGRQ QpHVWKHUPRG\QDPLTXHVSHUWLQHQWHVSRXUSUpYRLU
DTXHXVHRXSRXULQWHU SUpWHUG HVREVHUYDWLRQV
H[SpULPHQWDOHV
SRXUXQHpTXDWL RQGHUpDFWL RQFRPELQDLVRQ
WKHUPRG\QDPLTXHVVRQWFRQQXHV
OHFWXUHGHFRXUEHVGHG LVWULEXWLR QHWGH
GLDJUDPPHVGHSUpGRPLQDQFHHW
UpFLSURTXHPHQW
'pWHUPLQHUODFRPSRVLWLRQFKLPLTXH GXV\VWqPHFKLPLTXHHWGHWUDQVIRUP DWLRQWR WDOHSRX UXQH
WUDQVIRUPDWLRQPRGpOLVpHSDUXQHUpDFWLRQ
FKLPLTXHXQLTXH
8WLOLVHUOHVGLDJUDPPHVGH SUpGRPL QDQFHRX
LQFRPSDWLEOHVRXODQDWXUHGHVHVSqFHV
PDMRULWDLUHV
IQuesontlesacidesetlesbases?
En19 3,lechimistedanoisJohannesNicolausBRÖNSTED(chimistedanoisnéen1879- estunaccepteurdeprotonVocabulaire de la chimie et des matriaux
achiral, -e,adj. !Domaine :Chimie/Strochimie. !Dfinition :Se dit dÕun objet, en particulier dÕune entit molculaire, superposable son image dans un miroir. ! Note :ÇCh È se pr ononce [k]. ! Voir aussi :chiral, chiralit. ! quivalent tranger :achiral.Source: Journal officieldu 18 avril 2001.
acide de Br¿nsted chimique correspondante, capable de cder un hydron (proton) en ! Note : On qualifie les acides de ce type de ÇfortsÈ ou ÇfaiblesÈ selon aqueuse. ! Voir aussi :base de Br¿nst ed, h ydron. ! quivalenttranger : Br¿nsted acid, protonic acid.
Source: Journal officieldu 8 octobre 2003.
5 !Domaine :Chimie/Strochimie. ! Dfinition :Diffrence entre un minimum donn et un maximum voisin de lÕnergie potentielle dÕune entit molculaire dans une modification conformationnelle rsultant dÕune rotation autour dÕune liaison. ! Voir aussi :angle de torsion. ! quivalent tranger :rotational barrier.Source: Journal officieldu 18 avril 2001.
base de Br¿nsted chimique correspondante, capable dÕaccepter un hydron (proton) en ! Note: On qualifie les bases de ce type de ÇfortesÈ ou ÇfaiblesÈ selon en solution aqueuse. ! Voir aussi : acide de Br¿nst ed, h ydron. ! quivalent tranger : Br¿nsted base.Source: Journal officieldu 8 octobre 2003.
base de Lewis chimique correspondante, capable de fournir un doublet dÕlectrons. ! Note : Une base de Lewis est donc capable de ragir avec un acide de Lewis pour former un adduit par mise en commun du doublet de la base. 14Vocabulaire de la chimie et des matriaux
achiral, -e,adj. !Domaine :Chimie/Strochimie. !Dfinition :Se dit dÕun objet, en particulier dÕune entit molculaire, superposable son image dans un miroir. ! Note :ÇCh È se pr ononce [k]. ! Voir aussi :chiral, chiralit. ! quivalent tranger :achiral.Source: Journal officieldu 18 avril 2001.
acide de Br¿nsted chimique correspondante, capable de cder un hydron (proton) en ! Note : On qualifie les acides de ce type de ÇfortsÈ ou ÇfaiblesÈ selon aqueuse. ! Voir aussi :base de Br¿nst ed, h ydron. ! quivalenttranger : Br¿nsted acid, protonic acid.
Source: Journal officieldu 8 octobre 2003.
5 !Domaine :Chimie/Strochimie. ! Dfinition :Diffrence entre un minimum donn et un maximum voisin de lÕnergie potentielle dÕune entit molculaire dans une modification conformationnelle rsultant dÕune rotation autour dÕune liaison. ! Voir aussi :angle de torsion. ! quivalent tranger :rotational barrier.Source: Journal officieldu 18 avril 2001.
base de Br¿nsted chimique correspondante, capable dÕaccepter un hydron (proton) en ! Note: On qualifie les bases de ce type de ÇfortesÈ ou ÇfaiblesÈ selon en solution aqueuse. ! Voir aussi : acide de Br¿nst ed, h ydron. ! quivalent tranger : Br¿nsted base.Source: Journal officieldu 8 octobre 2003.
base de Lewis chimique correspondante, capable de fournir un doublet dÕlectrons. ! Note : Une base de Lewis est donc capable de ragir avec un acide de Lewis pour former un adduit par mise en commun du doublet de la base. 142.Acidesetbasesconjuguées
cetacidecèdeunproton. cettebaseaccepteunproton. êtrequ'échangéentre undonneuretuna ccepteur;la acide-base. composéamphotère. 3 O ,maisc'estaussiunÉquilibred'autoprotolysedel'eau:
2H 2 O (l) =H 3 O (aq) +HO (aq) pX=-LogX X=10 -pX K E =[H 3 O ][HO ]/c° pK E =-Log(K E3.2.Espècesamphotères
Uneespècequi estl'acided'uncoupleet labase
unampholyte. le bicarbonate de sodium en solution produit des ions HCO 3 espèce amphotère pH=-Log(a H3O+ pH=-Log([H 3 O ]/c°)SorenPeterLauritzSǿrensen
1868-1939
l'électrode indicatricedesions oxoniumest l'électrodedeverreII-laréac4onacide/base
1.Lesacidesfortsetlesbasesfortes
lorsqu'ilssontdissousdansl'eau. ,sabaseconjuguée,et H 3quotesdbs_dbs14.pdfusesText_20[PDF] acide et base exercices corrigés pdf
[PDF] acide et base pdf
[PDF] acide et base selon bronsted
[PDF] acide et base terminale s
[PDF] acide faible anglais
[PDF] acide faible base forte
[PDF] acide faible définition
[PDF] acide faible et acide fort
[PDF] acide faible et ph
[PDF] acide faible ph pka
[PDF] acide fort base forte exercice corrigé pdf
[PDF] acide fort et faible ph
[PDF] acide fort ou faible ph
[PDF] acide phosphorique faible
