 7. Transferts de protons Equilibres acide-base
7. Transferts de protons Equilibres acide-base
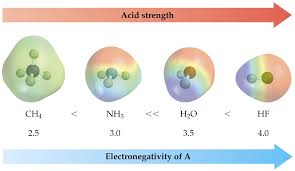
Ce proton “réagit” avec l'eau pour former l'ion hydronium H3O+: L'acide chlorhydrique est donc à la fois un acide de Brønsted et un acide d'Arrhenius. L'
 Exercice 1 : 1/ a/ Définir un acide et une base selon Bronsted. b
Exercice 1 : 1/ a/ Définir un acide et une base selon Bronsted. b
Exercice 2 : Parmi les réactions chimiques suivantes indiquer celles qui font intervenir des acides et des bases de Bronsted. Préciser le cas échéant l'acide et
 Acides et bases
Acides et bases
20 nov. 2020 Un acide (au sens de Brönsted) est une espèce chimique capable de fournir un proton H+. Exemples : L'acide éthanoïque CH3COOH le chlorure d' ...
 SA1_PC : réactions acide-base
SA1_PC : réactions acide-base
5 mai 2018 Source : Journal officiel du 18 avril 2001. acide de Brønsted. ♢ Domaine : Chimie. ♢ Définition : Entité moléculaire ou l'espèce.
 COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE‑BASE ?
En 1923 Joannes Brönsted
 série-n°1-les-acides-et-les-bases-de-bronsted--2013-2014
série-n°1-les-acides-et-les-bases-de-bronsted--2013-2014
Exercice 5 :Réaction acido-basique effervescente. L'acide éthanoïque (ou acide acétique) présent dans le vinaigre
 COURS.5 QUEST-CE QUUN ACIDE ET UNE BASE DE
COURS.5 QUEST-CE QUUN ACIDE ET UNE BASE DE
CHIMIE : LES ACIDES ET BASES DE BRONSTED. QU'EST-CE QU'UN ACIDE ET UNE BASE DE BRONSTED ? BACCARI. 1/2. COURS.5 : LES ACIDES ET LES BASES DE BRONSTED. Tawbac
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
À retenir : — définition des acides et bases de Brønsted;. — définition du pH du pKa ;. — définition de Ke et sa valeur à 25◦C;. — définition d'un acide fort/
 1) Définition de Bronsted : 2) Notion de couple acide-base : 3
1) Définition de Bronsted : 2) Notion de couple acide-base : 3
On appelle base de Bronsted toute espèce chimique capable de capter un proton H+ pendant une transformation chimique. 2) Notion de couple acide-base : Example:
 F2School
F2School
Acides-bases 1 : Acides et bases de Brønsted Indiquez le couple acide / base conjuguée dans les réactions suivantes : a) C6H5COOH + H2O. H3O+ + C6H5COO– b ...
 SA1_PC : réactions acide-base
SA1_PC : réactions acide-base
5 mai 2018 I Que sont les acides et les bases ? 1. Acide et base : déhinitions selon la théorie de Brönsted et Lowry. En 1923 le chimiste danois Johannes ...
 7. Transferts de protons Equilibres acide-base
7. Transferts de protons Equilibres acide-base
Dans l'eau les acides et les bases définis selon Arrhenius (voir §2) correspondent également à la définition de Brønsted-Lowry. Thomas Lowry. (1874-1936).
 ACIDES ET BASES
ACIDES ET BASES
3 déc. 1998 Pour Brönsted un acide est un donneur de proton et une base un ... En chimie organique c'est la notion d'acide et base selon Lewis qui est ...
 COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
COMMENT ÉCRIRE UN COUPLE ACIDE?BASE ?
En 1923 Joannes Brönsted
 Chapitre 1 Acides et bases
Chapitre 1 Acides et bases
1.2 Couples acide/base. 1.2.1 Acides et bases de Brønsted. La théorie de Johannes Brønsted (1923) définit les acides et les bases :.
 Acides et bases
Acides et bases
20 nov. 2020 Couple acide/base. 1.1. Acide. Un acide (au sens de Brönsted) est une espèce chimique capable de fournir un proton H+.
 SA1_PSI : réactions acide-base
SA1_PSI : réactions acide-base
I Que sont les acides et les bases ? 1. Acide et base : déBinitions selon la théorie de Brönsted et Lowry. En 1923 le chimiste danois Johannes Nicolaus
 Exercices
Exercices
Une base de Brönsted est susceptible de capter un ion hydrogène. Base de Brönsted. Acide conjugué. NO3. –. HNO3 car NO3.
 1) Définition de Bronsted : 2) Notion de couple acide-base : 3
1) Définition de Bronsted : 2) Notion de couple acide-base : 3
On appelle base de Bronsted toute espèce chimique capable de capter un proton H+ pendant une transformation chimique. 2) Notion de couple acide-base :.
 Chapitre 3 : Réactions acido-basiques
Chapitre 3 : Réactions acido-basiques
entre un acide et une base. Le plan suivant est proposé : • Acide et base au sens de Brönsted. • Réactions acido-basiques. • pH d'une solution aqueuse.
[PDF] acide et base exercices corrigés pdf
[PDF] acide et base pdf
[PDF] acide et base selon bronsted
[PDF] acide et base terminale s
[PDF] acide faible anglais
[PDF] acide faible base forte
[PDF] acide faible définition
[PDF] acide faible et acide fort
[PDF] acide faible et ph
[PDF] acide faible ph pka
[PDF] acide fort base forte exercice corrigé pdf
[PDF] acide fort et faible ph
[PDF] acide fort ou faible ph
[PDF] acide phosphorique faible
